Бронхиальная астма (БА) относится к числу наиболее распространенных хронических заболеваний органов дыхания. В общей популяции она встречается более чем у 5 % населения. Медико-социальная значимость БА связана с высокой инвалидизацией, частыми жизнеугрожающими обострениями, а также со значительными экономическими затратами.
БА – хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клеточные элементы. Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, кашля [1]. При БА могут развиваться такие осложнения, как астматический статус, эмфизема легких, пневмосклероз, хроническое легочное сердце, дыхательная недостаточность [2]. Наличие хронического воспаления является фактором формирования инсулинорезистентности (ИР), что сопряжено с риском развития сахарного диабета (СД) 2 типа (СД2) [3].
Возникающие при СД2 нарушения микроциркуляции и нервной регуляции приводят к изменениям механики дыхания, легочной гемодинамики, иммунного ответа и реактивности бронхов [4]. СД является прямым фактором риска развития болезней сердечно-сосудистой системы, патологии нервной системы, нарушений функций опорно-двигательного аппарата [5, 6].
Цель исследования: оценка взаимосвязи адипокинов и гормонально-метаболических показателей больных БА и при ее сочетании с СД2.
Материал и методы
Обследованы 53 женщины в возрасте от 44 до 70 лет, которые были разделены на 2 группы. В 1-ю группу вошли 27 пациенток с БА, их средний возраст составил 58,56 ± 0,79 года, а индекс массы тела (ИМТ) – 29,81 ± 0,92 кг/м2. Вторая группа включила 26 больных с сочетанием СД2 и БА (средний возраст – 61,23±0,95 года; ИМТ – 33,73 ± 1,29 кг/м2).
В группу контроля вошли 23 женщины, средний возраст которых составил 51,26 ± 1,73 года, а ИМТ – 26,08 ± 1,23 кг/м2.
Диагноз «сахарный диабет 2 типа» поставлен на основании критериев ВОЗ (2013) [7]. Диагноз «бронхиальная астма» ставил пульмонолог на основании рекомендаций GINA (2011) [1].
Все больные СД на момент исследования находились на таблетированной сахароснижающей терапии.
В исследование не включили больных БА, постоянно получавших лечение пероральными или ингаляционными глюкокортикостероидами.
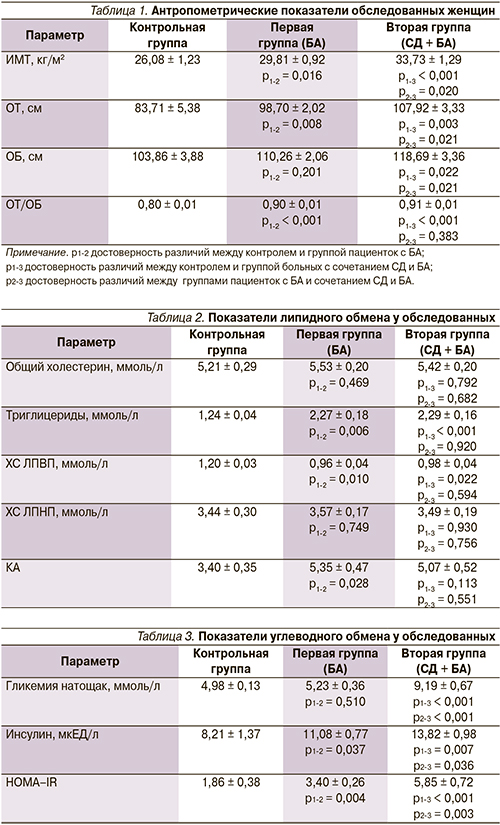
Всем обследованным женщинам определили антропометрические показатели: рост, массу тела, окружность талии (ОТ), окружность бедер (ОБ), рассчитали ИМТ и соотношение ОТ/ОБ.
Всем пациенткам произведен забор крови из локтевой вены утром натощак. Определение гликемии в плазме венозной крови осуществлено глюкозооксидазным методом на биохимическом анализаторе «Screen Master Plus» компании Hospitex diagnostic (Швейцария). Уровень иммунореактивного инсулина (ИРИ), концентрации лептина, резистина и адипонектина в сыворотке крови исследован методом иммуноферментного анализа на аппарате «Expert Plus» (Asys, Австрия). ИР оценена по показателю HOMA-IR (ИРИ × гликемия натощак/22,5). Показатели липидного спектра крови (общий холестерин, холестерин липопротеидов низкой плотности [ХС ЛПНП], триглицериды, холестерин липопротеидов высокой плотности (ХС ЛПВП) определены спектрофотометрическим методом на биохимическом анализаторе «Screen Master Plus». Уровень интерлейкина-6 (ИЛ-6) и ИЛ-10 определен методом иммуноферментного анализа на аппарате «Expert Plus».
Для обработки полученных данных использованы следующие методы математической статистики: t-критерий Стьюдента равенства средних (при неизвестной дисперсии), однофакторный многомерный дисперсионный анализ. Проведена проверка выборки на нормальность, использован критерий согласия Колмогорова–Смирнова. Рассчитаны показатели дескриптивной статистики: среднее арифметическое значение со средней ошибкой М ± m, среднее квадратическое отклонение среднего арифметического значения (σ). При проверке всех гипотез использован уровень значимости р = 0,05. Статистическая обработка результатов проведена с помощью Microsoft Excel для Windows.
Результаты и обсуждение
В табл. 1 представлены результаты антропометрического обследования. Если у женщин с БА ИМТ соответствовал избыточной массе тела, то при сочетании СД2 с БА имели место значения ИМТ, свидетельствующие о I степени ожирения. Показатели ОТ > 80 см и ОТ/ОБ > 0,8 позволяют диагностировать у больных 1-й и 2-й групп висцеральный тип ожирения.
Как следует из табл. 2, уровни общего холестерина и ХС ЛПНП у больных БА и БА + СД имели лишь тенденцию к повышению (р > 0,05). При этом концентрация триглицеридов была у них достоверно повышена, а ХС ЛПВП значимо снижена (р < 0,05) относительно уровня в контрольной группе. Эти изменения сопровождались повышением коэффициента атерогенности (КА; р > 0,05).
Уровень гликемии был существенно повышен (р < 0,05) у больных с сочетанием СД2 и БА (табл. 3). Увеличение концентрации глюкозы происходило на фоне достоверного усиления ИР у всех больных исследуемых групп относительно контроля. ИР сопровождалась компенсаторной гиперинсулинемией.
У женщин с БА и БА в сочетании с СД выявлено достоверное повышение (р < 0,001) содержания провоспалительного ИЛ-6 и противовоспалительного ИЛ-10 (табл. 4) относительно контроля. Это свидетельствует о субклиническом воспалении у указанного контингента больных. Вероятно, это можно объяснить тем, что при ожирении возникает оксидативный стресс вследствие токсического действия промежуточных продуктов метаболизма жирных кислот, а также пролиферацией клеток макрофагального типа в жировой ткани [8].
Жировая ткань является метаболически активным органом и продуцирует множество гормоноподобных веществ и цитокинов, которые действуют пара- и эндокринно [9]. Эти вещества называют адипокинами. В настоящее время известна масса адипокинов: лептин, резистин, адипонектин, висфатин, фактор некроза опухоли-α и т.д. [9, 10].
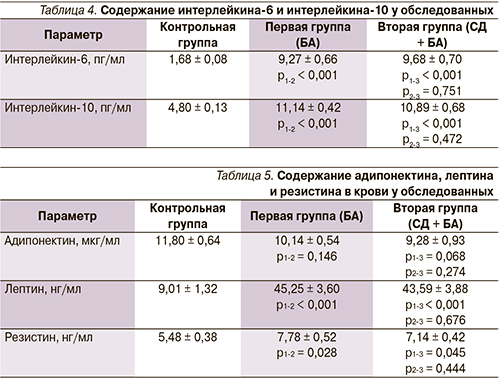
Уровень лептина был достоверно выше (р < 0,05) у всех пациенток 1-й и 2-й групп по сравнению с контролем (табл. 5). По-видимому, это можно объяснить тем, что при ожирении возникает компенсаторная резистентность гипоталамуса к центральному действию лептина, что в последующем по механизму отрицательной обратной связи приводит к гиперлептинемии [11]. У женщин с БА обнаружена положительная корреляция между концентрацией лептина и ОТ (r = 0,383; р = 0,049), лептина и ОБ (r = 0,408; р = 0,035) и отрицательная – с уровнем адипонектина (r = -0,469; р = 0,014). У пациенток с сочетанием БА и СД2 уровень лептина положительно коррелировал с ИМТ (r = 0,401; р = 0,042) и отрицательно – с концентрацией адипонектина (r = -0,589; р = 0,002).
Уровень резистина был достоверно выше (р < 0,05) относительно контроля у больных БА с сочетанием БА плюс СД2. У женщин с БА обнаружена положительная корреляция между концентрацией резистина и инсулина (r = 0,444; р = 0,020). У пациенток с сочетанием БА и СД2 выявлена положительная корреляция уровней резистина и инсулина (r = 0,461; р = 0,018), резистина и НОМА (r = 0,428; р = 0,029). По-видимому, определенную роль в развитии ИР при сочетании этих заболеваний играет резистин.
Обнаружена тенденция к снижению концентрации адипонектина у больных 1-й и 2-й групп относительно контроля (р > 0,05). В группе пациенток с сочетанием БА и СД2 выявлена отрицательная корреляция между уровнем адипонектина и ИМТ (r = -0,625; р < 0,001), адипонектина и ОТ (r = -0,635; р < 0,001), адипонектина и ОБ (r = -0,558; р = 0,003).
Выводы
В группах больных БА и ее сочетанием с СД2 выявлена атерогенная дислипидемия.
У женщин с БА и при ее сочетании с СД2 выявлена выраженная ИР, которая сопровождалась компенсаторной гиперинсулинемией.
У больных БА с ее сочетанием с СД2 выявлена гиперлептинемия, гиперрезистинемия, тенденция к снижению уровня адипонектина на фоне субклинического воспаления.



