Тромбоэмболии и лежащие в их основе тромбозы являются третьим по частоте сердечно-сосудистым заболеванием (после ишемической болезни сердца и инсульта) среди взрослого населения [1]. В основе возникновения тромбов лежат три основных процесса: замедление тока (стаз) крови, нарушение целостности внутреннего слоя сосуда (эндотелия) и нарушение свертываемости крови – т.н. триада Вирхова. Исходя из этого можно определить и факторы риска возникновения тромбозов, и людей, относящихся к группам повышенного риска развития тромбоэмболизма (ТЭ). Под термином «венозный ТЭ» имеют в виду объединенное понятие, включающее возникновение тромбозов и тромбоэмболических осложнений.
К факторам риска развития тромбозов и тромбоэмболий относятся:
- нарушения свертываемости крови (врожденные – наследственная тромбофилия; онкологические заболевания – особенно рак легких, желудка и поджелудочной железы; инфекционные процессы; прием некоторых лекарственных препаратов – пероральные контрацептивы, особенно содержащие эстрогены);
- состояния, вызывающие гиперкоагуляцию (большая раневая поверхность, например послеродовый период, обезвоживание);
- уменьшение физической подвижности (тяжелые госпитализированные пациенты, парализованные, пациенты, соблюдающие постельный режим после операций, люди, длительно находящиеся в малоподвижном состоянии (перелеты, работа за компьютером);
- наличие затруднения оттока крови (любое сдавление вен – беременность, роды, опухоли, чрезмерное мышечное напряжение);
- травма, переломы костей таза, нижних конечностей, оперативное вмешательство (эндопротезирование суставов);
- ятрогении: наличие катетеров в венах, искусственные клапаны сердца, искусственный водитель ритма или имплантированный кардиовертер-дефибриллятор.
Факторами, предрасполагающими к возникновению тромбозов и тромбоэмблических осложнений, служат также курение, ожирение, наличие таких заболеваний, как атеросклероз, артериальная гипертония, сердечная недостаточность, пороки сердца, наличие фибрилляции предсердий. По сути, факторы, предрасполагающие к развитию тромбозов, часто являются и факторами риска развития тромбоэмболических осложнений.
Тромбоэмболия – синдром острого нарушения кровообращения в результате полного или частичного закрытия просвета артерии (эмболизации) тромбом. Как правило, тромбы формируются в венозном русле. При этом одной из частых причин эмболий в артерии большого круга кровообращения считаются тромбы из ушка левого предсердия, формирующиеся при фибрилляции предсердий (например, тромбоэмболические инсульты, инфаркты различных органов, эмболии конечностей). При образовании тромба в венах большого круга кровообращения или правых отделах сердца эмбол попадает в легочные артерии – развивается тромбоэмболия легочной артерии (ТЭЛА). Самой частой причиной возникновения ТЭЛА считается тромбоз глубоких вен нижних конечностей. При этом в 70–95 % источник исходит из илиоковального или илиофеморального сегмента, 5–20 % – из правых отделов сердца и 0,5–2,0 % – из системы верхней полой вены. Другими источниками эмболии могут служить тромбозы вен таза.
В Европе частота смертей от венозного ТЭ превышает суммарную частоту смертей от рака груди, синдрома иммунодефицита и дорожно-транспортных происшествий [2]. С учетом высокой смертности и инвалидизации пациентов с тромбоэмболическими осложнениями становится очевидной важность проведения лечебных и профилактических мероприятий по предупреждению венозного ТЭ.
Хорошо известны подходы, которые использовались в недавнем прошлом и используются в настоящее время, касающиеся внутривенного или подкожного введения гепаринов, главным образом низкомолекулярных. Для приема внутрь до недавнего времени фактически был лишь один препарат – непрямой антикоагулянт варфарин. Введение этих подходов в клиническую практику позволило значимо снизить риск тромбоэмболических осложнений для разных категорий пациентов. Основные препараты, используемые для лечения тромбозов и профилактики тромбоэмболических осложнений, способы введения и их активность в отношении Xa- и IIa-факторов, приведены в таблице. Однако и гепарины, и варфарин обладают широким спектром действия на факторы свертывания крови, в связи с чем могут повышать и риск кровотечений. В связи с этим лечение такого типа требует лабораторного контроля свертываемости и тщательной титрации доз, например, для варфарина с целью эффективного и безопасного лечения.
Однако с недавнего времени ситуация изменилась и в результате многолетнего целенаправленного поиска были созданы препараты для приема внутрь, обладающие выраженной противотромботической активностью. Некоторые из них уже используют в широкой клинической практике (см. таблицу), остальные находятся на разных стадиях клинических исследований.
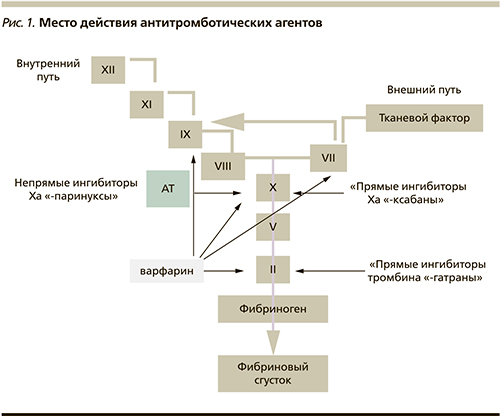
По механизму действия новые антитромботические препараты являются ингибиторами Ха- или IIа-фактора коагуляционного каскада (рис. 1).
В отличие от ранее используемых препаратов (гепарины, варфарин) их действие более «точечное» и тем самым обеспечивается большая безопасность лечения.
Ингибиторы IIa-фактора блокируют активность тромбина – фермента, который катализирует превращение фибриногена в фибрин. Ингибиторы Xa-фактора могут быть прямыми (ксабаны) или непрямыми (паринуксы). При этом непрямые ингибиторы влияют на Xа-фактор через связывание с антитромбином, прямые действуют непосредственно на активацию Ха-фактора. В любом случае суммарный эффект этих ингибиторов Ха- и IIа-факторов будет заключаться в уменьшении активности тромбина и образования фибрина, а в конечном итоге – приводить к уменьшению свертываемости крови.
Наиболее существенным отличием в фармакокинетических параметрах новых антикоагулятов является более короткий период полуэлиминации (8–15 часов) по сравнению с варфарином (60 часов), что делает терапию ими более безопасной.
Биодоступность при приеме внутрь у апиксабана и ривароксабана наиболее высокая (80 %) по сравнению с дабигатраном (6 %), самое высокое связывание с белками плазмы у ривароксабана (95 %) по сравнению с дабигатраном (35 %), почечный клиренс у ривароксабана более сбалансированный, и практически отсутствует удлинение времени полуэлиминации при снижении скорости клубочковой фильтрации.
Следует отметить, что классические исследования препаратов, влияющих на коагуляцию, проходят несколько этапов, во время которых оценивают эффективность и безопасность при ортопедических вмешательствах, возможность лечения и профилактики при острых тромбозах и эффективность использования пациентами с фибрилляцией предсердий и при остром коронарном синдроме. Поскольку сейчас мы стоим на позициях выбора терапии для конкретного пациента на основе доказательной медицины, очень важно представлять: какие исследования проводили с тем или иным препаратом и какие были получены результаты, характеризующие эффективность и безопасность терапии? В связи с этим рассмотрим результаты исследований одного из новых антитромботических препаратов – ривароксабана (Ксарелто). Этот препарат привлекает внимание по нескольким позициям: доза не зависит от возраста пациентов, массы их тела и скорости клубочковой фильтрации, что облегчает работу врача, и это единственный из новых антикоагулянтов, который принимают однократно в сутки (для профилактики инсульта и системной эмболии у пациентов с фибрилляцией предсердий и профилактики рецидивов ТГВ и ТЭЛА), что обеспечивает большее удобство для пациентов и тем самым снижается риск нарушения режима дозирования; может назначаться с первого дня лечения ТГВ и ТЭЛА в остром периоде.
Следует отметить, что все исследования ривароксабана были построены таким образом, чтобы доказать, что предлагаемые новый препарат и новый режим лечения обладают эффективностью, не меньшей, чем общепринятая терапия (non inferiority study).
Первый вопрос, на котором следует остановиться: возможность профилактики тромбоэмболических осложнений у пациентов с фибрилляцией предсердий, которая является самым частым видом нарушений ритма сердца и частота которой резко увеличивается с возрастом [3, 4], что особенно важно с учетом роста популяции пожилых людей в мире.
Самым частым тромбоэмболическим осложнением неклапанной фибрилляции предсердий остается инсульт. Без эффективной антикоагуляции частота инсультов составляет 5 % в год [5] Указывают, что риск эмболического инсульта у пациентов с фибрилляцией в 5 раз выше, чем у людей с нормальным ритмом сердца [6]. Важно, что фибрилляция предсердий в отсутствие тромбопрофилактики служит причиной эмболического инсульта в 45 % случаев и в 15–20 % – всех инсультов [7].
В многоцентровом рандомизированном двойном слепом исследовании ROCKET-AF на 14 269 пациентах с фибрилляцией предсердий проведено сравнение ривароксабана, назначаемого однократно в суточной дозе 20 мг (15 мг в сутки при скорости клубочковой фильтрации 30–49 мл/мин) с варфарином в дозах, позволяющих достигать международного нормализованного отношения (МНО) 2–3 [8].
По сути, в этом исследовании речь шла о вторичной профилактике тромбоэмболических осложнений, поскольку в исследование включали пациентов, уже перенесших инсульт или преходящее нарушение мозгового кровообращения, или системную эмболию и имевших по крайней мере два из таких факторов риска, как сердечная недостаточность, фракция выброса менее 35 %, возраст старше 75 лет, артериальная гипертензия и сахарный диабет.
Следует сразу оговориться: данная категория пациентов была более тяжелой (риск по шкале CHADS2 составил в среднем 3, 4), чем рассматривалась в исследованиях других пероральных антикоагулянтов. Основной целью данного исследования было доказать, что эффективность и безопасность Ксарелто при приеме 1 раз в сутки не уступают варфарину в индивидуально подобранной дозе. При проведении анализа в популяции пациентов, завершивших исследование согласно протоколу, частота инсульта и системной эмболии в группе ривароксабана составила 1,7 против 2,2 % в год в группе стандартной терапии; относительный риск (ОР) составил 0,79; 95 % доверительный интервал (ДИ) – 0,66–0,96 (p = 0,02). Не получено различий при проведении анализа в когорте пациентов, имевших намерение лечиться (ОР – 0,88; 95 % ДИ – 0,75–1,03).
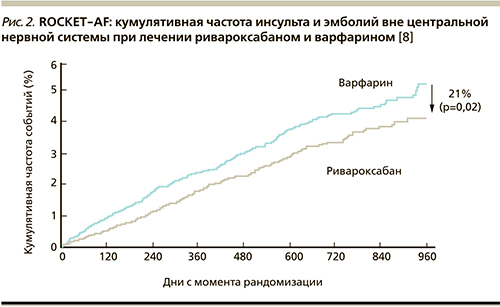
Суммарная частота больших кровотечений или небольших, но клинически значимых оказалась сопоставимой в обеих группах лечения (14,9 и 14,5 % в год; ОР – 1,03; 95 % ДИ – 0,96–1,11; p = 0,44). В группе ривароксабана чаще встречались нетяжелые желудочно-кишечные кровотечения. Однако, наверное, одной из самых важных причин, по которой отдают предпочтение новым антикоагулянтам при фибрилляции предсердий, является значимое уменьшение риска внутримозговых геморрагических инсультов по сравнению с приемом варфарина (рис. 2). Это важно, особенно с учетом того, что среди пациентов с фибрилляцией предсердий много лиц пожилого возраста с более высоким риском геморрагических осложнений вообще и внутримозговых кровоизлияний в частности.
В исследовании ROCKET AF было получено статистически значимое снижение риска внутричерепных кровоизлияний на 33 % (ОР – 0,67; 95 % ДИ– 0,47–0,93; p = 0,02) и смертельных кровотечений в 2 раза (ОР – 0,50 95 % ДИ – 0,31–0,79; p = 0,003). В группе пациентов, принимавших ривароксабан, общая смертность была на 15 % ниже, чем в группе получавших варфарин, однако разница не достигла статистической значимости (ОР – 0,85; 95 % ДИ – 0,70–1,02). Таким образом, для профилактики тромбоэмболических осложнений рекомендована длительная терапия ривароксабаном в дозе 20 мг в сутки однократно с пищей.
Хотелось бы обратить внимание, что в этом исследовании была подтверждена реально существующая клиническая проблема – далеко не все пациенты с фибрилляцией предсердий, получающие варфарин, достигают рекомендуемых значений МНО. Даже в рамках этого исследования рекомендуемые значения МНО были получены лишь в 58 % проведенных анализов.
Вторая клинически значимая проблема – это профилактика венозного ТЭ при ортопедических операциях. Проблема острая, т.к. эти операции являются группой среднего оперативного риска, при этом они не жизнеспасающие и проводятся лишь для улучшения качества жизни пациентов, поэтому профилактика возможных жизнеугрожающих осложнений приобретает особо важное значение.
Итак, с препаратом ривароксабан была проведена программа исследований RECORD на пациентах, перенесших операции по протезированию тазобедренных (RECORD-1 RECORD-2) и коленных суставов (RECORD-3 RECORD-4). Во всех этих исследованиях назначение ривароксабана было более эффективным в качестве профилактики венозного ТЭ по сравнению с низкомолекулярным гепарином эноксапарином.
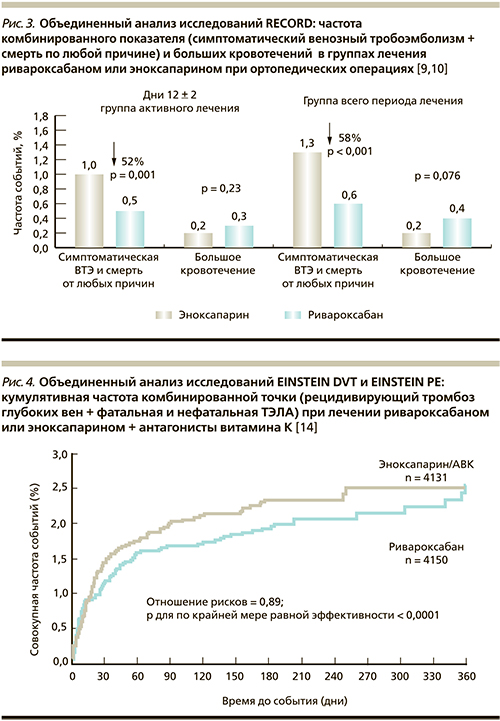
Объединенный анализ данных всех четырех исследований [9] продемонстрировал значительно превосходящую эффективность ривароксабана (начало приема через 6–8 часов после операции) по сравнению с эноксапарином при профилактике симптоматического венозного ТЭ и снижение смертельных исходов по любой причине после операций по поводу замены коленного и тазобедренного суставов. Важно, что при этом не отмечено увеличения количества больших кровотечений (рис. 3).
Несомненное удобство использования ривароксабана в том, что препарат может быть назначен через 6 часов после операции и далее его применяют однократно в дозе 10 мг в течение 5 недель при операциях на тазобедренном суставе и 2 недель при операциях на коленном суставе. Следует заметить, что в исследованиях RECORD оценивали случаи симптомного ТЭ, но на один случай симптомного венозного ТЭ приходится 5 случаев бессимптомного тромбоза глубоких вен после замены тазобедренного сустава и 21 случай асимптомного венозного ТЭ при операциях на коленном суставе [11]. Таким образом, реальная частота тромбообразования при оперативных вмешательствах очень большая и в периоперационном антитромботическом лечении нуждается значительное число людей.
Кроме того, была спланирована программа исследований EINSTEIN с целью доказать, что терапия новым пероральным антикоагулянтом ривароксабаном будет не хуже, чем стандартная общепринятая терапия эноксапарином и антагонистами витамина К, в отношении повторных тромбозов или тромбоэмболических событий и более безопасной в плане возникновения кровотечений. Так, в открытое рандомизированное, основанное на конечных точках исследование EINSTEIN DTV [12] были включены 3449 пациентов с подтвержденным острым тромбозом глубоких вен, из которых 1731 получал ривароксабан и 1718 – терапию эноксапарином с последующим переводом на прием антагонистов витамина К (варфарина или аценокумарола). Ривароксабан назначали в дозе 15 мг 2 раза в день в течение 3 недель и в дальнейшем переводили на прием препарата в суточной дозе 20 мг, эффект оценивали через 3, 6 и 12 месяцев после острого эпизода. Лечение ривароксабаном было столь же эффективным (отсутствие различий между группами р < 0,001), как и стандартная терапия. За время наблюдения число случаев повторного ТЭ составило 36 (2,1 %) в группе ривароксабана против 51 (3,0 %) события в группе сравнения; соответственно ОР составил 0,68; 95 % ДИ – 0,44–1,04. Не было также различий в частоте кровотечений – порядка 8 % в обеих группах, ОР составил 0,97; 95 % ДИ – 0,76–1,22; р = 0,77). Таким образом, была продемонстрирована возможность профилактики осложнений у пациентов с острым венозным тромбозом одним препаратом ривароксабан столь же эффективно и безопасно, как и при использовании стандартной терапии, которая включает начальную терапию низкомолекулярным гепарином с переходом на непрямой антикоагулянт с необходимостью титрации доз и постоянным контролем МНО.
В другом аналогично спланированном исследовании пациентов с подтвержденной ТЭЛА (исследование EINSTEIN PE, 4832 человека) [13] ривароксабан не хуже, чем стандартная терапия эноксапарином и варфарином, влиял на частоту повторных случаев венозного ТЭ. Так, в группе ривароксабана было выявлено 50 (2,1 %) случаев, других нежелательных явлений в группах не отмечено. Это позволяет сделать следующее заключение: терапия ривароксабаном в режиме фиксированной дозы является хорошим подходом к начальному и длительному лечению ТЭЛА и имеет хороший потенциал в плане улучшения соотношения польза/риск.
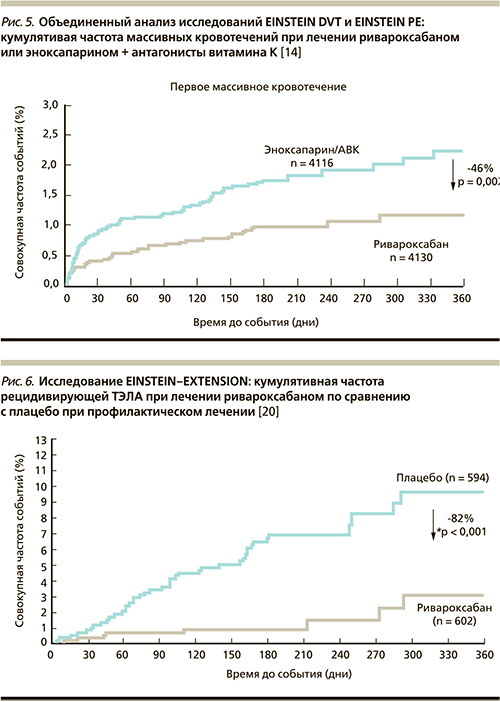
Недавно был опубликован анализ объединенной базы данных этих двух исследований: EINSTEIN-DVT и EINSTEIN-PE [14], в которые суммарно были включены 8282 пациента, из них 4151 получал терапию ривароксабаном и 4131 – стандартную терапию эноксапарином с дальнейшим переводом на терапию антагонистами витамина К. С высокой степенью достоверности (р < 0,001) было продемонстрировано, что терапия ривароксабаном по своей эффективности не уступает стандартной терапии (рис. 4). Так, число случаев венозного ТЭ составило 86 (2,1 %) в группе ривароксабана и 95 (2,3 %) – в группе стандартной терапии (ОР – 0,89; 95 % ДИ – 0,66–1,19). При этом больших кровотечений было достоверно меньше: 40 (1,0 %) против 72 (1,7 %) соответственно в группе получавших ривароксабан и стандартную терапию (ОР – 0,54; 95 % ДИ – 0,37–0,79; p = 0,002) (рис. 5).
Кроме того, проведен анализ в т.н. ключевых подгруппах, т.е. в подгруппах людей, у которых риск всегда выше (уязвимые пациенты, онкологические пациенты, с большими размерами тромба). В подгруппу уязвимых пациентов отнесены лица старше 75 лет, имеющие массу тела < 50 кг, со скоростью клубочковой фильтрации < 50 мл/мин. В этой подгруппе для лиц, леченных ривароксабаном, риск случаев повторного ТЭ был ниже на 32 %, а больших кровотечений – на 73 %, в подгруппе онкологических пациентов риск был ниже на 38 и 39 % соответственно. Таким образом, монотерапия препаратом ривароксабан обеспечивает такой же эффект, как стандартная терапия при большей безопасности.
Важный вопрос касается целесо-образности и безопасности длительной тромбопрофилактики [15], т.к. ранняя ее отмена служит наиболее частой причиной регоспитализаций пациентов после хирургических вмешательств в результате повторных эпизодов венозного ТЭ [16–18], частота которой достигает 6–9 % в год [19]. В связи с этим важно, что параллельно с этими двумя исследованиями (EINSTEIN PE и EINSTEIN DVT) начато двойное слепое рандомизированное плацебо-контролируемое исследование EINSTEIN–EXTENSION [20], в котором оценивали ривароксабан в дозе 20 мг (602 пациента) против плацебо (594 пациента) дополнительно через 6 и 12 месяцев после острого эпизода (52,5 %, это были пациенты, закончившие 6- и 12-месячное лечение по поводу острого венозного ТЭ или ТЭЛА в исследованиях EINSTEIN PE и EINSTEIN DVT). Таким образом, эта часть программы EINSTEIN была направлена на профилактику повторных случаев венозного ТЭ при длительном лечении. Показано (рис. 6), что эффективность лечения ривароксабаном была весьма высокой. Так, частота возникновения случаев повторного ТЭ составила лишь 8 (1,3 %) случаев против 42 (7,1 %) в группе плацебо; ОР составил 0,18; 95 % ДИ – 0,09–0,39; р < 0,001. Важно, что лишь 15 человек необходимо пролечить ривароксабаном для предотвращения одного неблагоприятного события. При этом за время наблюдения в группе ривароксабана лишь у 4 пациентов отмечены большие, но нефатальные кровотечения (0,7 %) против отсутствия кровотечений в группе плацебо, правда различия эти не достигли достоверности (р = 0,11). Это важное свидетельство того, что пациенты, пережившие острый эпизод венозного ТЭ и получившие даже хорошее лечение в острой фазе, нуждаются в достаточно длительном профилактическом лечении и это лечение можно проводить успешно и безопасно с помощью новых пероральных антикоа-гулянтов.
Важно также полученное доказательство того, что лечение одним препаратом, принимаемым однократно, дает схожий эффект при большей безопасности, т.е. стало возможным заменить старую, громоздкую, трудоемкую схему лечения на более простую и удобную для пациентов.
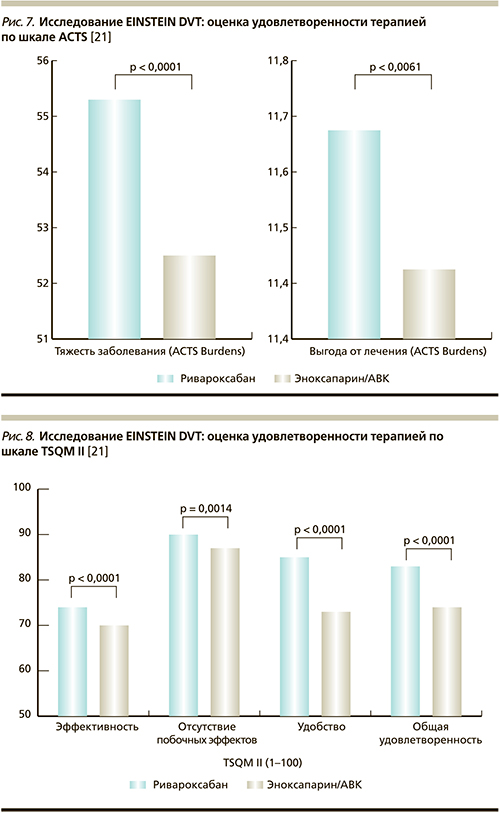
В связи с этим следует остановиться еще на одном аспекте подобной терапии – удовлетворенность пациентов тем или иным видом лечения. Так, в рамках программы EINSTEIN DVT 1472 пациента заполняли вновь разработанный опросник по удовлетворенности лечением the Anti-Clot Treatment Scale (ACTS), который является модификацией Duke Anticoagulation Satisfaction Scale (DASS), а также хорошо известный опросник Treatment Satisfaction Questionnaire for Medication version II (TSQM II). В среднем в группе получавших ривароксабан по обоим опросникам удовлетворенность была значимо выше (p < 0,0001), чем в группе получавших терапию эноксапарином и антагонистами витамина К [21]. Так, по шкале ACTS индекс неудобств, связанных с болезнью (Burdens scores), составил 55,2 балла в группе ривароксабана против 52,6 – в группе сравнения. Индекс удовлетворенности лечением (Benefits scores) был в пользу ривароксабана с высокой степенью достоверности: 11,7 против 11,5 (p = 0,006). Эффект ривароксабана становился отчетливым уже через 2 месяца терапии и сохранялся до 12 месяцев терапии. При этом позитивный эффект ривароксабана не зависел ни от пола, ни от возраста пациентов, ни от наличия злокачественных новообразований, ни от страны, в которой проводилось исследование, ни от некоторых других факторов (рис. 7, 8) [21].
Полученные данные вполне объяснимы, т.к. необходимость ежедневно производить подкожные инъекции, так же как и заборы крови для контроля эффективности и безопасности антикоагулянтной терапии, при всей их малоболезненности оказывает стрессорное влияние на людей. Кроме того, необходимость инъекций и анализов создает сложности для людей, чья работа или повседневная жизнь связана с поездками или нахождением вне дома, определенное хранение, особые условия транспортировки препаратов – все это затрудняет жизнь, а любые затруднения снижают ее качество.
Программа исследований с ривароксабаном расширяется – в феврале 2013 г. начато рандомизированное открытое активно контролируемое исследование безопасности и эффективности, фармакокинетики и фармакодинамики ривароксабана для детей с различными клиническими проявлениями венозных тромбозов (EINSTEIN Junior). В исследование будут включены дети в возрасте от 6 до 18 лет, которые получают лечение не менее 2 месяцев (в случае катетерных тромбозов не менее 6 недель) низкомолекулярными гепаринами или фондапаринуксом натрия и/или антагонистами витамина К. Результаты этого исследования ожидаются в 2015 г.
В настоящее время проводится двойное слепое рандомизированное многоцентровое исследование EINSTEIN CHOICE с целью сравнить эффективность в предупреждении повторных эпизодов ТЭ при длительной терапии пациентов с симптомным тромбозом глубоких вен или ТЭЛА разными дозами ривароксабана (20 и 10 мг) и ацетилсалициловой кислотой (100 мг).
Начат в 2009 г. и будет продолжаться до 2018-го крупнейший международный проспективный регистр у пациентов с неклапанной фибрилляцией предсердий GARFIELD AF: (The Global Anticoagulant Registry in the FIELD (GARFIELD) for patients with Atrial Fibrillation) [22]. Предполагается участие более 1000 клинических центров 35 стран, в т.ч. и России. Цель регистра – в клинической рутинной практике получить информацию об эпидемиологии фибрилляции предсердий, частоте системных эмболий и инсультов, оценить клиническую характеристику пациентов, эффективность и безопасность лечения больных с впервые установленной фибрилляцией предсердий при наличии как минимум одного фактора риска инсульта. Набор пациентов будет проводиться в пяти последовательных когортах с тем, чтобы можно было отследить динамику изменений антитромботической терапии (в связи с изменением национальных рекомендаций во многих странах) и дать заключение о целесообразности использования новых пероральных антикоагулянтов и их эффективности. Предполагается включить 55 тыс. пациентов (50 тыс. проспективно и 5000 ретроспективно). Несомненно, что будут оцениваться и географические различия, а также не только характеристика терапии, но и комплаентность пациентов к лечению с учетом прекращения лечения, перерывов и изменения режима лечения. Будет оценено влияние терапии и течения заболевания на ресурсы здравоохранения. У пациентов, получающих антагонисты витамина К, будут оценивать динамику МНО и тактику подбора доз.
В настоящее время получены некоторые данные [23] по первым двум включенным когортам пациентов. Результаты, полученные в реальной практике, по сути совпадают с полученными в разное время в различных эпидемиологических когортных и рандомизированных исследованиях. Показано, что наибольшей угрозой при естественном течении фибрилляции предсердий является ранняя смертность, при этом инсульт и смертность возрастают с увеличением числа факторов риска для пациента. Далеко не все пациенты получают противотромботическую терапию. У большинства из них применение антагонистов витамина К плохо контролируется, а плохой контроль МНО связан с худшими исходами.
В заключение следует сказать следующее:
- Тромбозы и тромбоэмболии должны рассматриваться как единый процесс и единое заболевание.
- Врачи должны более внимательно оценивать пациентов с точки зрения необходимости проведения профилактических мероприятий венозного ТЭ.
- Следует шире использовать появившиеся в связи с новыми препаратами новые возможности, чтобы обеспечить более быстрое внедрение в практику эффективных и безопасных технологий, тем самым улучшить качество оказания медицинской помощи и удовлетворенность пациентов этой помощью.



