Внастоящее время собрано большое количество данных in vitro и in vivo исследований, демонстрирующих противовирусное действие ряда комплексных гомеопатических препаратов. Эти эффекты подтверждаются и результатами клинических исследований этих препаратов, проведенных на больших выборках пациентов. Однако точные механизмы действия указанного класса лекарственных веществ пока остаются неизученными. Поэтому в данной статье мы рассматриваем особенности механизмов действия подобных лекарственных средств на примере препарата Эуфорбиум композитум (назальный спрей).
Регулируемый цитокинами Т-клеточный ответ на вирусы
Противовирусная защита осуществляется посредством специфических и неспецифических механизмов. Специфический ответ подразумевает контролируемое Т-лимфоцитами образование гуморальных противовирусных антител в В-лимфоцитах. Оно сопровождается неспецифической продукцией интерферонов, которые образуются большинством клеточных форм организма в ответ на вирусный стимул [1]. При этом даже мельчайшие концентрации этих цитокинов (10-11) обладают достоверным противовирусным эффектом [1]. Антигомотоксические препараты, преимущественно представляющие собой комплексы компонентов в потенциях Д2–Д12 (т.е. разведения исходной субстанции 10-2-10-12), как раз имеют необходимую концентрацию «для разговора с цитокинами на одном языке» [3]. Также следует учитывать, что именно сеть цитокинов связывает невральные, эндокринные и иммуногенные структуры организма в один регуляторный механизм [1, 3].

Основная роль в элиминации вирусов отводится цитотоксическим CD8+ Т-лимфоцитам (CTL; см. рисунок) [1, 6]. Они распознают вирусные антигены, как только последние презентируются на поверхности клеток посредством главного комплекса гистосовместимости I. После этого CTL посылают пораженной клетке сигнал апоптоза [5]. Для этого они формируют Fas(CD95)-лиганды, которые связываются с Fas-рецепторами, имеющимися практически у всех клеток. За счет этого в пораженных вирусами клетках запускается программа апоптоза, одновременно CTL высвобождают перфорин, способствующий разрыхлению клеточной мембраны клетки, подлежащей апоптозу [1, 7]. Одновременно с нападением CTL на клетку из лимфоцита высвобождаются неспецифические противовирусные интерфероны (IFN) и еще один цитокин – фактор некроза опухоли α (ФНО-α) [7].
В настоящее время известно, что не все пораженные вирусом клетки подвергаются этому специфическому цитотоксическому процессу; некоторые могут без вреда противостоять инфекции. В противном случае любая вирусная инфекция заканчивалась бы гибелью всего организма [3, 7]. Всегда нужно учитывать сложный характер взаимодействия между интерферонами и ФНО-α, который ведет к развитию неспецифического нецитотоксического и нецитолитического клеточного ответа (см. рисунок).
Противовирусное нецитотоксическое действие Эуфорбиума композитум
Интерфероны не обладают прямым противовирусным действием, а индуцируют механизмы резистентности за счет синтеза 2’-5’-олигоаденилатсинтетазы и Mx-протеинов, которые на отдельных этапах взаимодействуют с вирусной инфекцией. Посредством моноклональных антител к интерферону γ удалось подтвердить существование этого механизма [7].
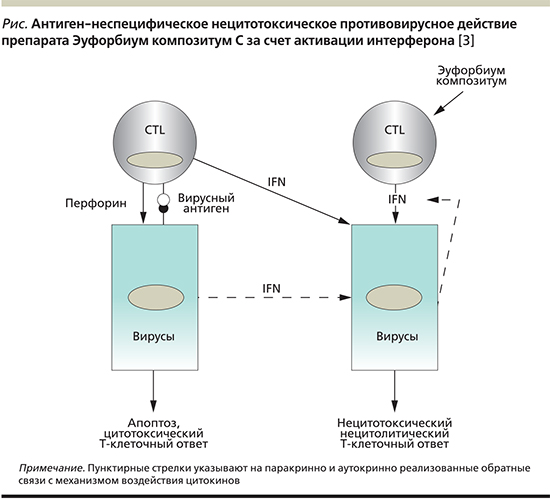
Интерфероны являются потенциальными активаторами макрофагов/моноцитов, благодаря чему последние высвобождают ФНО-α и интерлейкин-12. Последний имеет огромное значение, т.к. он стимулирует CTL к усиленному синтезу интерферонов [2, 7]. Одновременно интерфероны ускоряют пролиферацию Т-лимфоцитов [1]. Пораженные вирусами клетки сами способны продуцировать интерфероны и паракринным путем защищать соседние клетки от поражения вирусом. Так как CTL также могут высвобождать интерферон, они аутокринно стимулируют его собственный синтез (см. рисунок).
Подобные нецитотоксическое и нецитолитическое противовирусное действия могут быть активированы компонентами препарата Эуфорбиум композитум. Как показали первые исследования на культурах цельной крови здоровых пробандов, потенцированные компоненты препарата даже поодиночке способны стимулировать лейкоциты к активному синтезу интерферона (см. таблицу) [6]. Данные в контрольной группе принимались за 100%. Показатели, начиная от +20%, рассматривались в качестве корректного фармакологического эффекта [3].
Для гомеопатической терапии особую важность приобретает то обстоятельство, что показанный механизм регулируемого интерфероном противовирусного действия является неспецифическим. То есть препарат Эуфорбиум композитум обладает широчайшим потенциалом противовирусного применения, не связанным с развитием побочных эффектов. Помимо этого обсуждается вопрос о дополнительном ингибирующем действии препарата Эуфорбиум композитум и его компонентов на нейраминидазу [3], посредством которой вирус группа получает доступ к клетке-хозяину [5, 8].



