Введение
В настоящее время во всем мире наибольшее место в комплексном лечении постинсультного спастического мышечного гипертонуса отводится ботулинотерапии, особенно в случаях, резистентных к общепринятой терапии. Однако во всех случаях после проведения ботулинотерапии требуется активная физиотерапия и физическая реабилитация. Ботулинотерапия не заменяет физиотерапию и лечебную физкультуру, что составляет основу реабилитационной программы для больных, перенесших мозговой инсульт, а представляет лишь интегральную часть комплексного восстановительного лечения, направленного на улучшение двигательных функций [1–3]. Однако в литературе практически не описано подобных программ восстановительного лечения.
Большинство исследований эффективности ботулинотерапии в лечении постинсультной спастичности проводилось в рамках программы реабилитации или включало последующую восстановительную терапию в большей или меньшей степени (не всегда указано). Рандомизированные контролируемые исследования подтверждают преимущество применения дополнительной физиотерапии в снижении спастичности по сравнению с лечением только ботулотоксином [4].
Использование специальных дополнительных лечебных мероприятий, таких как стимулирование или шинирование, часто входит в общее лечение, но их официальная оценка была проведена только в нескольких исследованиях. J. Jankovic провел небольшое рандомизированное плацебо-контролируемое исследование для оценки использования ботулинотерапии вместе с непродолжительной электростимуляцией [5]. Электростимуляция (30 минут три раза в сутки в течение трех дней) приводила к небольшим, но статистически значимым улучшениям. Другое одностороннее слепое рандомизированное контролируемое исследование показало, что применение низкой дозы ботулотоксина (100 ЕД ботулинического токсина типа A-гемагглютинина комплекса) после бинтования лодыжки было таким же эффективным, как и применение стандартной дозы (200–300 ЕД ботулинического токсина типа A-гемагглютинина комплекса) без бинтования при лечении спастического эквиноваруса [6].
Хотя традиционно считается, что ботулинотерапию необходимо применять в комбинации с другими существующими методами восстановительного лечения спастичности, для определения оптимального времени начала лечения (периода заболевания) и возможности комбинированного лечения необходимо проводить дополнительные исследования [7].
Целью исследования стал анализ эффективности комплексного восстановительного лечения постинсультного спастического мышечного гипертонуса в различных периодах заболевания с использованием ботулинического токсина типа А.
Материал и методы
Проведено исследование с участием 307 пациентов в возрасте от 41 до 78 лет (средний возраст – 63,040 ± 0,291 года), прошедших курс нейрореабилитации после перенесенного мозгового инсульта с развитием спастических двигательных нарушений. Наблюдение пациентов и проведение восстановительного лечения проводились с 2009 по 2012 г. в отделении клинической реабилитации ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А.М. Никифорова» МЧС России, Санкт-Петербург. Основная оценка данных исследуемых пациентов проведена до начала восстановительного лечения и через 21 день после его окончания. Дополнительно в те же сроки была произведена оценка данных амбулаторных пациентов, в качестве лечения получавших только инъекции ботулотоксина в спастичные мышцы. Кроме того, всем пациентам, исследуемым амбулаторно через 4 и 6 месяцев от начала проведения реабилитационных мероприятий, была проведена катамнестическая оценка результатов лечения.
При организации исследования учли существующую в настоящее время периодизацию постинсультного этапа, состоящего из 4 периодов [8].
Пациенты были распределены в следующие группы:
- 1-я группа (n = 79) – острый период заболевания (первые 6 недель);
- 2-я группа (n = 71) – ранний восстановительный период заболевания (первые 6 месяцев);
- 3-я группа (n = 101) – поздний восстановительный период (от 6 месяцев до 1 года);
- 4-я группа (n = 56) – резидуальный период (после 1 года).
Для всех пациентов проведена оценка двигательных расстройств паретичных конечностей (оценка активной функции конечностей) по шкале Оргогозо и оценка выраженности мышечной спастичности по модифицированной шкале мышечной спастичности Эшворта. Для оценки пассивной функции руки использовали шкалу ухода за поврежденной рукой ArMA [9]. Повторная оценка выраженности спастического мышечного гипертонуса, активной и пассивной функции конечностей осуществлена через 21 день, 4 и 6 месяцев от начала восстановительного лечения.
При проведении медицинской реабилитации для пациентов, перенесших мозговой инсульт с развитием спастических двигательных нарушений, принцип комплексного восстановительного лечения был взят за основу в нашем исследовании. Использование различных технологий восстановительного лечения (физиотерапии, лечебной физкультуры, рефлексо- и ботулинотерапии) имело место в любом периоде мозгового инсульта с любой выраженностью спастичности.
Для физиотерапевтического лечения (ФТЛ) это был физиотерапевтический аппарат для двухканальной комбинированной терапии «Phyaction GE» («Gymna Uniphy», Германия) по программе лечения «выраженная мышечная атрофия» с применением волновых токов NMES (Neuro Muscular Electro Stimulation). Воздействовали на антагонисты спастичных мышц в зависимости от клинического паттерна спастичности.
Лечебная физкультура (ЛФК). Проводили упражнения, направленные на расслабление мышц, подавление патологических синкинезий, а также ежедневные упражнения на растяжение спастических мышц.
Рефлексотерапия (РТ). Исполь-зовали точки акупунктуры по рекомендациям А.Т. Качана [10]. Метод воздействия – тормозной, глубина введения – каноническая.
Ботулинотерапия (БТ). Расчет дозы препарата ботулинического токсина типа А, а также точки его введения в различные мышцы-мишени определены по рекомендациям M. Brin и Spasticity Study Group [11]. Ботулотоксин вводили на 2-е сутки госпитализации пациента в стационар или амбулаторно. Минимальные дозы вводили при легкой степени спастичности, максимальные – при выраженной и больших размерах мышц. Общая доза ботулотоксина не превышала 400 ЕД. Введение ботулотоксина осуществлено под контролем электромиографии.
В верхней конечности в связи с повышенным тонусом сгибателей запястья и пальцев обязательное введение ботулотоксина осуществлено в следующие мышцы: лучевой сгибатель запястья (20–40 ЕД), локтевой сгибатель запястья (20–40 ЕД), поверхностный сгибатель пальцев (20–40 ЕД), глубокий сгибатель пальцев (30–60 ЕД). Общая доза ботулотоксина составила 75–150 ЕД. В нижней конечности в связи с повышением мышечного тонуса в задней группе мышц голени выясили, какая из мышц задней группы голени (икроножная или камбаловидная) играет ведущую роль в спастичности. В икроножную мышцу вводили 100–150 ЕД ботулотоксина в четыре точки (25–35 ЕД в каждую точку). В тех случаях, когда спастичность в равной мере была вызвана как в икроножной, так и в камбаловидной мышце, дополнительно в дозе 50–100 ЕД в две точки (25–50 ЕД) препарат вводили в камбаловидную мышцу.
В остальные мышцы-мишени верхней и нижней конечностей введение ботулотоксина зависело от клинического паттерна спастичности.
Результаты исследования и обсуждение
Пациенты в острый период заболевания были распределены на 3 группы, получавшие различные программы медицинской реабилитации: программа № 1 – ФТЛ + ЛФК (n = 28); № 2 – ФТЛ + ЛФК + РТ (n = 27); № 3 – БТ (n = 24).
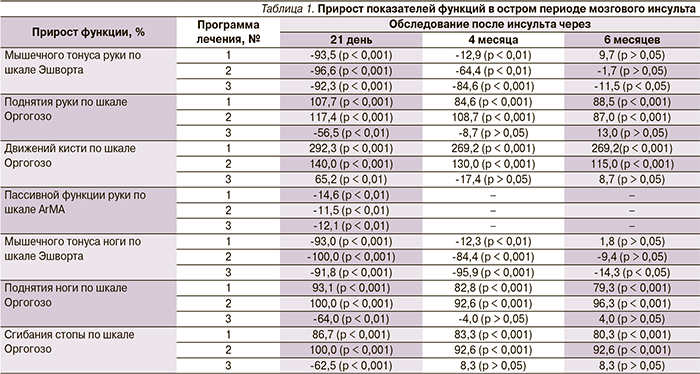
В табл. 1 представлены результаты прироста показателей функций после проведения восстановительного лечения в остром периоде мозгового инсульта, а также катамнестические данные через 4 и 6 месяцев.
Оказалось, что статистически значимое снижение мышечного гипертонуса паретичных конечностей и улучшение пассивной функции руки наблюдались при использовании всех трех программ реабилитации, однако длительность положительного клинического эффекта отмечена при использовании программ № 2 и 3. Выявлена отрицательная динамика активной функции конечностей при использовании программы реабилитации № 3 к 3-й неделе обследования и значимая положительная – к 6-му месяцу. Повторное нарастание мышечного гипертонуса до практически исходных значений наблюдалось на 6-й месяц обследования при всех программах реабилитации. Активная функция паретичных конечностей частично сохранялась после повторного нарастания мышечного гипертонуса при использовании программ № 1 и 2. Последующее сравнение выборочных распределений и средних значений для трех независимых групп ранговым дисперсионным анализом Краскела–Уоллеса показало значимое отличие эффекта программы № 3 от таковых остальных программ (р < 0,001).
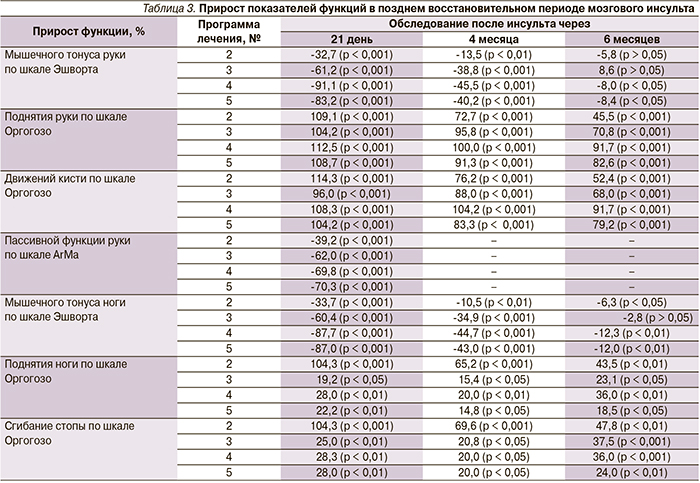
Для определения значимой связи между снижением мышечного гипертонуса и степенью изменения активных движений конечностей была рассчитана непараметрическая корреляция гамма, значимая на уровне 0,05 для изменений по шкале Эшворта и шкале Оргогозо, для всех программ восстановительного лечения. Через 3 недели после проведения восстановительного лечения активная функция конечностей (поднятие руки, движения кисти, поднятие ноги, сгибание стопы) по шкале Оргогозо коррелировала с изменением (снижением) мышечного гипертонуса по шкале Эшворта: поднятие руки/движения кисти (γ = -0,923/-0,836 для программы № 1, γ = -1,000/-1,000 для программы № 2, γ = 0,778/0,889 для программы № 3); поднятие ноги/сгибания стопы (γ = -1,000/-0,923 для программы № 1, γ = -1,000/-1,000 для программы № 2, γ = 1,000/1,000 для программы № 3).
Пациенты в раннем восстановительном периоде были распределены на три группы, получавшие различные программы медицинской реабилитации: программа № 1 – ФТЛ + ЛФК (n = 23), № 2 – ФТЛ + ЛФК + РТ (n = 25), № 3 – БТ (n = 23).
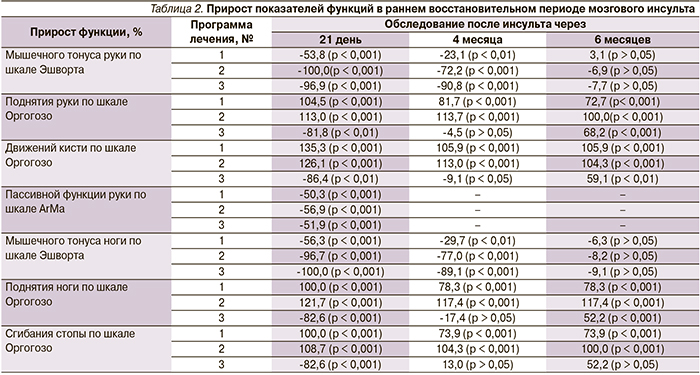
В табл. 2 представлены результаты прироста показателей функций после проведения восстановительного лечения в раннем восстановительном периоде мозгового инсульта, а также катамнестические данные через 4 и 6 месяцев.
Оказалось, что статистически значимое снижение мышечного гипертонуса паретичных конечностей и улучшение пассивной функции руки наблюдались при использовании всех трех программ реабилитации, однако эффективность и длительность положительного клинического эффекта отмечены при использовании программ № 2 и 3.
Выявлена отрицательная динамика активной функции конечностей при использовании программы реабилитации № 3 к 3-й неделе обследования и значимая положительная – к 6-му месяцу. Повторное нарастание мышечного гипертонуса до практически исходных значений наблюдалось на 6-м месяце обследования при всех программах реабилитации. Активная функция паретичных конечностей частично сохранялась после повторного нарастания мышечного гипертонуса при использовании программ № 1 и 2. Последующее сравнение выборочных распределений и средних значений для трех независимых групп ранговым дисперсионным анализом Краскела–Уоллеса показало значимое отличие эффекта программы № 3 от эффектов остальных программ (р < 0,001).
Через 3 недели после проведения восстановительного лечения активная функция конечностей (поднятие руки, движения в кисти, поднятие ноги, сгибание стопы) по шкале Оргогозо коррелировала с изменением (снижением) мышечного гипертонуса по шкале Эшворта при всех трех программах лечения: поднятие руки/движения кисти (γ = -1,000/-1,000 для программы № 1, γ = -1,000/-1,000 для программы № 2, γ = 1,000/1,000 для программы № 3); поднятие ноги/сгибание стопы (γ = -0,825/-0,655 для программы № 1, γ = -1,000/-1,000 для программы № 2, γ = 1,000/1,000 для программы № 3).
Пациенты в поздний восстановительный период заболевания были распределены на 4 группы, получавшие различные программы медицинской реабилитации: программа № 2 – ФТЛ + ЛФК + РТ (n = 24), № 3 – БТ (n = 26), № 4 – БТ + ФТЛ + ЛФК (n = 26), № 5 – БТ + ФТЛ + ЛФК (n = 25). Поскольку в острый и ранний восстановительные периоды мозгового инсульта полученные данные позволили сделать вывод, что длительность лечебного эффекта программы реабилитации № 2 (ФТЛ + ЛФК + РТ) выше, чем программы № 1 (ФТЛ + ЛФК), а изменение выраженности мышечного гипертонуса увеличивается с каждым периодом заболевания, программа лечения № 1 была исключена из исследования.
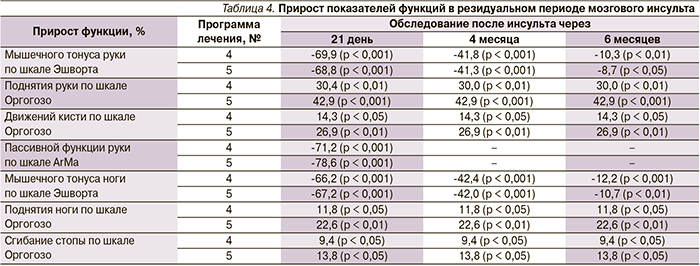
В табл. 3 представлены результаты прироста показателей функций после проведения восстановительного лечения в позднем восстановительном периоде мозгового инсульта, а также катамнестические данные через 4 и 6 месяцев.
Оказалось, что статистически значимое снижение мышечного гипертонуса паретичных конечностей, улучшение активной и пассивной функций руки наблюдались при использовании всех четырех программ реабилитации, однако эффективность и длительность положительного клинического эффекта имели место при использовании программ № 4 и 5. Выявлена незначительная положительная динамика активной функции ноги при использовании программ реабилитации № 4 и 5. Повторное нарастание мышечного гипертонуса до практически исходных значений наблюдалось на 6-м месяце обследования при всех программах реабилитации. Активная функция паретичных конечностей частично сохранялась после повторного нарастания мышечного гипертонуса. Последующее сравнение выборочных распределений и средних значений для четырех независимых групп ранговым дисперсионным анализом Краскела–Уоллеса показало значимое отличие эффекта программ № 4 и 5 от таковых остальных программ (р < 0,001).
Через 3 недели после проведения восстановительного лечения активная функция конечностей (поднятие руки, движения в кисти, поднятие ноги, сгибание стопы) по шкале Оргогозо коррелировала с изменением (снижением) мышечного гипертонуса по шкале Эшворта в программах лечения № 4 и 5: поднятие руки/движения кисти (γ = -0,750/-0,600 – для программы № 4, γ = -0,605/-0,705 – для программы № 5); поднятие ноги/сгибание стопы (γ = -0,600/-0,680 – для программы № 4, γ = -0,655/-0,600 для программы № 5).
В резидуальный период заболевания пациенты были распределены на 2 группы, получавшие различные программы медицинской реабилитации: программа № 4 – БТ + ФТЛ + ЛФК (n = 29), № 5 – БТ + ФТЛ + ЛФК + РТ (n = 27). В связи с тем что наибольшая эффективность лечебного воздействия в позднем восстановительном периоде мозгового инсульта наблюдалась при применении программ № 4 (БТ + ФТЛ + ЛФК) и № 5 (БТ + ФТЛ + ЛФК + РТ), а изменение выраженности мышечного гипертонуса увеличивалось с каждым периодом заболевания, программы лечения № 1 (ФТЛ + ЛФК), 2 (ФТЛ + ЛФК + РТ) и 3 (БТ) были исключены из исследования.
В табл. 4 представлены результаты прироста показателей функций после проведения восстановительного лечения в резидуальном периоде мозгового инсульта, а также катамнестические данные через 4 и 6 месяцев.
Оказалось, что статистически значимое снижение мышечного гипертонуса паретичных конечностей, улучшение активной и пассивной функций наблюдались при использовании обеих программ реабилитации. Повторное нарастание мышечного гипертонуса до практически исходных значений наблюдалось на 6-м месяце обследования при каждой программе реабилитации. Активная функция паретичных конечностей сохранялась после повторного нарастания мышечного гипертонуса. Последующее сравнение выборочных распределений и средних значений для двух независимых групп ранговым U-критерием Манна–Уитни не показало значимых различий по эффектам при данных программах лечения (р > 0,05).
Через 3 недели после проведения восстановительного лечения не выявлена корреляция между активной функцией паретичных конечностей (поднятие руки, движения кисти, поднятие ноги, сгибание стопы) по шкале Оргогозо и изменением (снижением) мышечного гипертонуса по шкале Эшворта (р > 0,05).
Выводы
В острый и ранний восстановительные периоды мозгового инсульта при появившейся и нарастающей спастичности руки наибольшая эффективность лечебного воздействия (улучшение активной функции руки) наблюдается при применении программ медицинской реабилитации в комбинации ФТЛ + ЛФК (р < 0,001) или в комбинации ФТЛ + ЛФК + РТ (р < 0,001). Эффективность данных комплексов достоверно одинакова, однако длительность положительного клинического эффекта выше при применении второго комплекса реабилитации (р < 0,05). В обоих периодах заболевания улучшение пассивной функции руки наблюдается при применении программ ФТЛ + ЛФК, ФТЛ + ЛФК + РТ или БТ (р > 0,05). Однако восстановительное лечение с использованием БТ провоцирует нарастание выраженности пареза, что значимо ухудшает активную функцию верхней конечности (р < 0,001).
В поздний восстановительный и резидуальный периоды мозгового инсульта наибольшая эффективность лечебного воздействия (улучшение активной и пассивной функций руки) наблюдается при применении программ медицинской реабилитации в комбинации БТ + ФТЛ + ЛФК (р < 0,001) или в комбинации БТ + ФТЛ + ЛФК + РТ (р < 0,001). Значимых различий между эффективностью и длительностью лечебного эффекта в данных комбинациях не выявлено (р > 0,05). Использование БТ в виде монотерапии или комплекса без применения БТ не дает максимального лечебного действия как по эффективности, так и по длительности положительного клинического эффекта (р < 0,01).
В острый и ранний восстановительные периоды мозгового инсульта при появившейся и нарастающей спастичности ноги наибольшая эффективность лечебного воздействия (улучшение активной функции ноги) наблюдается при применении программ медицинской реабилитации в комбинации ФТЛ + ЛФК (р < 0,001) или в комбинации ФТЛ + ЛФК + РТ (р < 0,001). Эффективность данных комплексов достоверно одинакова, однако длительность положительного клинического эффекта выше при применении второго комплекса реабилитации (р < 0,05).
В поздний восстановительный и резидуальный периоды мозгового инсульта наибольшая эффективность лечебного воздействия (улучшение активной функции ноги) наблюдается при применении программ медицинской реабилитации в комбинации ФТЛ + ЛФК (р < 0,01) или в комбинации ФТЛ + ЛФК + РТ (р < 0,01). Значимых различий между эффективностью и длительностью лечебного эффекта в данных комбинациях не выявлено (р > 0,05).
Во все периоды заболевания наибольшее снижение мышечного гипертонуса ноги (улучшение пассивной функции) наблюдается при проведении БТ (р < 0,001). Однако восстановительное лечение с использованием БТ в острый и ранний восстановительные периоды мозгового инсульта провоцирует нарастание выраженности пареза (ухудшает активную функцию нижней конечности; р < 0,001), а в поздний восстановительный и резидуальный периоды существенно не влияет на активную функцию (р < 0,01).



