Окислительный стресс (ОС) обеспечивает иммунологическую толерантность во время беременности. Однако чрезмерно высокий уровень активных форм кислорода (AФК) или недостаток ферментов антиоксидантной защиты может вызывать неизбирательное повреждение биологических молекул, нарушать функции или приводить к клеточной смерти [1]. Так, при преэклампсии (ПЭ) уровень ОС и системного воспаления при ПЭ может изменяться в отличие физиологической беременности [2]. По данным L. Myatt и X. Cui [3], G.J. Burton и соавт. [4], ОС развивается на ранних этапах формирования ПЭ.
Глутатион и ферменты его метаболизма – одна из важнейших антиоксидантных систем, защищающих ткани от воспаления различной природы [5]. Увеличение ОС вызывает значительное усиление экспрессии генов глутатионпероксидазы-1 (ГПО1) и глутатионредуктазы (ГР) [6]. Нехватка ГПО1 во время беременности может вызывать значительное увеличение перекисей липидов, вызывать эндотелиальную дисфункцию и развитие ПЭ [7, 9]. Таким образом, актуально исследование ОС и уровня антиоксидантной защиты в развитии ПЭ.
 Материал и методы
Материал и методы
В исследование была включена 31 пациентка. Все пациентки были разделены на 2 группы: I (основную группу) составили 11 беременных с ПЭ, II (группа сравнения) – 20 условно здоровых пациенток. Проведены исследования уровня АФК и антиоксидантной защиты с помощью прибора FORM 3000 (Каллегари, Италия) с использованием тестов FORT, FORD соответственно и экспрессии генов методом qPCR.
Критерием включения в исследование для основной группы служила одноплодная беременность, наступившая в естественном цикле, осложненная ПЭ, для группы сравнения – неосложненное течение данной одноплодной беременности, наступившей в естественном цикле.
Критерии исключения были общими: многоплодная беременность, острые воспалительные заболевания, тяжелая экстрагенитальная патология, аутоиммунные и онкологические заболевания.
Выделение и анализ мРНК. Из каждой плаценты было взято по два фрагмента (из средней части, исключая поверхностные слои) для дальнейшего выделения РНК. Ткань помещали в раствор RNAlater для стабилизации РНК и замораживали при -80°С. Перед лизированием образцы нарезали на криостате для обеспечения равномерного лизиса как трофобласта, так и стромальных клеток. Выделение РНК проводили с использованием набора Синтол (ЕХ-515-50), согласно рекомендациям производителя. Обратную транскрипцию для получения кодирующей ДНК ставили при помощи набора Синтол, согласно рекомендациям производителя (Синтол, «ОТ-1»). В исследованиях использовали праймеры к мРНК транскриптам ГПО1, глутатионредуктазы (ГР) и RPL19 (референсный ген). Для проведения ПЦР использовали набор Синтол (М-428). Для реакции был использован амплификатор Real-Time PCR Detection System CFX96 («Bio Rad», USA). Условия проведения ПЦР следующие: 1 – предварительный нагрев 5 минут; 2 – 45 циклов (10 секунд – 95°С, 30 секунд – 60°С).
Уровень АФК и антиоксидантной защиты был определен с помощью прибора FORM 3000 (Каллегари, Италия) с использованием тестов FORT, FORD соответственно. Тест FORT основан на способности ионов железа катализировать в присутствии гидроперекисей (ROOH) образование свободных радикалов кислорода, при связывании которых производное амина CrNH2 образует устойчивое окрашенное соединение. Интенсивность окраски прямо коррелирует с уровнем АФК в исследуемом образце. Тест FORD основан на взаимодействии предварительно образованных окрашенных радикалов с антиоксидантами исследуемого образца. Интенсивность окраски обратно коррелирует с уровнем антиоксидантов в исследуемом образце. Уровень АФК представлен в виде эквивалентного количества перекиси водорода (Н2О2, ммоль/л), уровень антиоксидантов представлен в виде эквивалентного количества антиоксиданта тролокса (тролокс, ммоль/л).
В качестве исследуемого материала была использована сыворотка венозной крови, полученная путем центрифугирования при 800 g в течение 10 минут при 4°С. Для забора крови использованы стандартные пробирки с гепарином в качестве антикоагулянта. От момента забора крови до проведения тестов проходило не более 30 минут. Тесты проводились согласно инструкции изготовителя.
Статистическая обработка результатов qPCR. Эффективность полимеразной цепной реакции (ПЦР) для каждой пары праймеров была рассчитана при помощи программного обеспечения амплификатора Real-Time PCR Detection System («Bio Rad», USA). Эффективность ПЦР реакции для используемых праймеров была не ниже 1,8. Относительная концентрация исследуемого гена рассчитана по формуле: Сrel target=Сtarget/Сref=(Eref)ct ref/(Etarget)Ct target.
Статистическую обработку результатов проводили при помощи программы «OriginPro 8». Значимость различий между выборками оценивали с использованием однофакторного дисперсионного анализа (ANOVA) со значением p<0,05. Величины представлены как среднее значение±стандартная ошибка среднего (SEM).
 Результаты исследования и обсуждение
Результаты исследования и обсуждение
Возраст беременных, включенных в исследование, составил 31,5±0,9 и 30,8±1,9 года (по группам соответственно). Достоверных различий в частоте перенесенных в детстве детских инфекционных заболеваний, соматических и гинекологических заболеваний замечено не было. Следует отметить, что у всех пациенток, включенных в исследование, не было артериальной гипертензии до наступления настоящей беременности.
Анализ течения настоящей беременности установил, что ее течение у пациенток основной группы чаще осложнялось угрозой прерывания в I и II триместрах, однако различия не достигали статистической значимости. В подавляющем большинстве случаев (81,8%) имела место поздняя ПЭ с дебютом проявлений после 32 недель беременности. При этом уровень систолического артериального давления (САД) составил 140,1±11,2 и 117,5±8,9 мм рт.ст. (по группам соответственно) и диастолического артериального давления (ДАД) 90,5±1,4 и 71,5±2,4 мм рт.ст. Oтеки нижних конечностей отмечены в 54,5% наблюдениях. Уровень протеинурии составил 0,7±0,3 и 0,1±0,1 г/л (по группам соответственно). Анализ показателей клинико-лабораторных данных не выявил статистически значимых различий между группами. Все пациентки были родоразрешены в связи с нарастанием степени тяжести ПЭ путем операции кесарева сечения, которая была произведена типично. Достоверных различий в осложнениях послеоперационного периода выявлено не было. Следует отметить, что статистически значимых различий в оценке состояния детей при рождении и массо-ростовых соотношений в 63,6% случаев не выявлено. Вместе с тем следует отметить, что в 8,3% дети родились в асфиксии тяжелой степени при родоразрешении в сроке 37 недель беременности и в 18,2% – при ранней тяжелой ПЭ (24–26 недель беременности), имело место досрочное родоразрешение с неблагоприятным неонатальным исходом.
Установлено, что уровень АФК при физиологически протекающей беременности к III триместру беременности повышается в 2,2 раза. В группе с ПЭ средние значения АФК были выше на 20%, но не имели статистически значимых различий. Также не имели значимых различий группы по уровню антиоксидантной защиты. Значение уровня АФК у небеременных здоровых женщин находится в диапазоне от 1,80 до 2,44 ммоль/л; Н2О2 – 2,16±0,26.
В группе сравнения АФК составило от 2,44 до 5,74 ммоль/л, Н2О2 – 4,83±1,00; в группе ПЭ АФК – от 4,08 до 7,10 ммоль/л, Н2О2 – 5,37±0,99.
Значения уровня антиоксидантов у здоровых женщин составляют от 0,5 до 1,66 ммоль/л; тролокса – 0,98±0,47. В изучаемых группах уровни антиоксидантов распределились следующим образом: в группе ПЭ – от 0,25 до 0,89 ммоль/л; тролокса – 0,6±0,18, в группе сравнения – от 0,4 до 1,07 ммоль/л; тролока – 0,7±0,25.
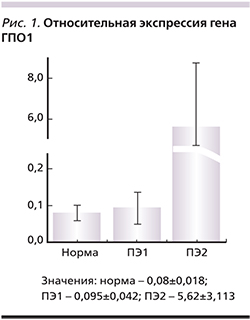
Для изучения уровня генов антиоксидантной системы в плаценте на втором этапе была определена экспрессия ферментов окислительно-восстановительного обмена глутатиона [5, 10]. При исследовании экспрессии ГПО1 было выявлено, что ее уровень достоверно повышается (в 60 раз) при ПЭ (36,4% случаев; ПЭ2) (рис. 1). В других образцах плацент (ПЭ1) уровень экспрессии не отличался от нормы (рис. 1). Уровень экспрессии ГР был повышен во всех образцах плацент женщин с ПЭ по сравнению с нормой более чем в 10 раз (рис. 2).
Сосуды плаценты при ПЭ подвергаются сильному ОС, приводящему к системному воспалению [2].
В исследованиях M. Lappas и соавт. [10] было показано увеличение экспрессии генов ГР во всех случаях относительно нормы и генов в большинстве наблюдений в плаценте при гестационном сахарном диабете.
В данном исследовании установлено, что при ПЭ значительно возрастает экспрессия генов ГР во всех исследуемых случаях и экспрессия генов ГПО1 – в 36,4% [6, 7]. Полученные данные позволяют предположить, что одной из причин развития ПЭ может быть нарушение экспрессии генов антиоксидантных ферментов, приводящее к формированию их недостатка, и как следствие – к нарушению окислительно-восстановительного гомеостаза [10]. Следует отметить, что в подавляющем большинстве анализируемых случаев имела место умеренная поздняя ПЭ, верифицированная согласно критериям тяжести. С учетом отсутствия достоверных различий в осложнениях раннего неонатального периода можно предположить, что регистрируемые изменения уровней экспрессии генов ГПО1 и ГР в плаценте на фоне ОС, приводящего к возникновению апоптоза клеток трофобласта, можно расценивать как компенсаторные. В случаях ранней тяжелой ПЭ в сроках 24–26 недель родоразрешение сопровождалось неблагоприятными перинатальными исходами. Можно предположить, что в вышеуказанных случаях, когда экспрессия генов ГПО1 и ГР возрастает одновременно, в ткани плаценты имеет место избыточная продукция АФК.
Таким образом, ОС приводит к повышению уровня экспрессии генов антиоксидантной защиты в плаценте. В то же время нарушение баланса про- и антиоксидантной систем приводит к развитию избыточного ОС, сопровождающего развитие ряда патологических состояний, в т.ч. и ПЭ, и обосновывает целесообразность определения его в периферической крови для уточнения тактики ведения.



