ВВЕДЕНИЕ
Рак молочной железы (РМЖ) на протяжении многих лет занимает лидирующие позиции по показателям заболеваемости и смертности среди женского населения как в мире, так и в России [1, 2]. Это гетерогенное заболевание, включающее пять основных молекулярных подтипов, характеризующихся различными особенностями клинического течения, прогноза заболевания, что наряду с оценкой распространенности опухолевого процесса в значительной мере определяет выбор и объем комбинированного лечения [3]. Более чем для половины больных одной из основных терапевтических опций является системная химиотерапия (ХТ) – это больные, которым диагностируется люминальный В, трижды негативный и HER-позитивный типы опухоли [3]. В настоящее время цитостатическая терапия активно используется в предоперационном режиме [4], что обусловлено возможностью достижения полного морфологического регресса (ПМР) опухоли, ассоциированного с улучшением отдаленных результатов [5]; стремлением к уменьшению объема первичной опухоли; созданию более благоприятных условий для выполнения органосохраняющих операций [4], а также определением чувствительности первичной опухоли к проводимой ХТ in vivo, позволяя на этом основании планировать лечение в адъювантном режиме.
Однако далеко не всегда при проведении неоадъювантной ХТ (НАХТ) мы получаем ожидаемые результаты. Причин, определяющих низкую эффективность системного лечения больных со злокачественными новообразованиями, достаточно много. Одной из наиболее значимых является отсутствие персонализированного подхода к выбору схем цитостатических препаратов при проведении конвенциональной ХТ. Индивидуализация лечения может быть основана на определении молекулярно-генетических маркеров опухоли, которые служат мишенью действия отдельных препаратов и определяют чувствительность новообразования к ним – генов чувствительности [6, 7], а также маркеров, ассоциированных с неспецифической резистентностью к ХТ – генов множественной лекарственной устойчивости (МЛУ) [8].
Анализ данных литературы и собственных результатов дает основание полагать, что и гены химиочувствительности, и гены МЛУ могут рассматриваться в качестве информативных предсказательных критериев [7, 9, 10]. При наличии клинических показаний к проведению системной ХТ больным РМЖ в неоадъювантном режиме они позволят ответить на два основных вопроса: следует ли ожидать эффекта от планируемой цитостатической терапии и если да, то какие препараты (схемы) необходимо при этом использовать?
Целью нашего исследования стали разработка и проспективная клиническая апробация алгоритма персонализированного назначения НАХТ больным люминальным В HER2(-)-РМЖ с использованием молекулярно-генетических маркеров опухоли.
МЕТОДЫ
Всего в исследование были включены 108 больных операбельным люминальным В HER2(-)-РМЖ. На этапе диагностики всем больным проведено полное клинико-инструментальное обследование, объем которого соответствовал алгоритмам, рекомендованным и утвержденным Минздравом РФ.
Согласно дизайну исследования, больные были разделены на две группы (рис. 1). По основным клинико-морфологическим характеристикам группы были сопоставимыми: у большей части пациенток распространенность процесса оценивалась как IIA–IIB-стадии. Возраст больных варьировался от 22 до 68 лет (в среднем по группам он составил 47 и 48 лет). Опухоли в молочной железе преимущественно были представлены инвазивной карциномой неспецифического типа 2-й степени злокачественности.
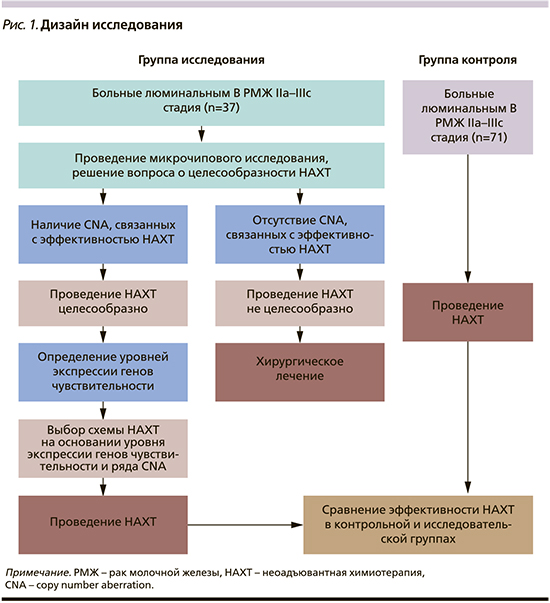
В первую (исследовательскую) группу вошли 37 больных РМЖ. До начала лечения из опухолевой ткани этих пациенток, полученной при биопсии новообразования, выделяли ДНК и РНК. ДНК опухоли использовали для микрочипового исследования на микроматрице CytoScan HD Array (Affymetrix, США). Были определены CNA-маркеры, сопряженные с эффективностью предоперационной ХТ, и копийность локусов генов чувствительности к отдельным препаратам. Если в опухолевой ткани они отсутствовали, первым этапом комбинированного лечения было выполнение радикального оперативного вмешательства. При идентификации маркеров, сопряженных с высокой эффективностью НАХТ, дополнительно к копийности некоторых генов чувствительности (Top2a, TYMS и TUBB3) определяли и уровни их экспрессии, используя РНК опухолевой ткани. Далее по совокупности полученных данных осуществлен выбор схемы лечения. Больным, которым была показана предоперационная ХТ, она назначалась в зависимости от молекулярно-генетических характеристик опухоли по схемам: FAC (5-фторурацил, доксорубицин, циклофосфамид), САХ (циклофосфамид, доксорубицин, капецитабин), таксаны в монорежиме, АТ (доксорубицин, доцетаксел), СР (цисплатин, циклофосфамид).
Во вторую группу (исторический контроль) была включена 71 пациентка, которой НАХТ проведена без учета молекулярно-генетических характеристик опухоли. Все больные на первом этапе лечения получали 4–6 курсов НАХТ по схемам: FAC, САХ, таксаны в монорежиме (доцетаксел) и СМХ (циклофосфамид, метотрексат, капецитабин).
Через 3 недели после окончания последнего курса предоперационной ХТ оценивалась эффективность лечения и выполнялось хирургическое лечение с последующим морфологическим исследованием операционного материала. Адъювантный этап лечения (лучевая, химио- и гормонотерапия) проведен по показаниям, соответствовавшим стандартам. По объему выполненного лечения значимых различий между группами не было.
Морфологическое и иммуногистохимическое исследования. Проводка биопсийного материала, фиксированного в 10–12%-ном нейтральном формалине, осуществлена по стандартной методике. Диагноз РМЖ установлен согласно Гистологической классификации опухолей молочной железы (ВОЗ, 2012). Степень злокачественности определена по модифицированной схеме P. Scarff, H. Bloom и W. Richardson. Оценку патоморфоза провели по системе RCB. Иммуногистохимическое исследование осуществлено по стандартной методике. Использованы антитела фирмы Dako к рецепторам эстрогена (клон 1D5, RTU, мышиные), прогестерона (клон PgR 636, RTU, мышиные) к онкопротеину c-erbB-2 (Her2/neu статус, рабочее разведение 1:500, кроличьи) и Ki-67 (клон MIB-1, RTU, мышиные) фирмы Novocastra (Великобритания).
Для выделения ДНК и РНК образцы опухоли помещали в раствор RNAlater (Ambion, США) и сохраняли при температуре -80°С (после 24-часовой инкубации при +4°С). РНК выделяли с помощью набора RNeasy Plus mini Kit (Qiagen, Германия). ДНК из опухолевой ткани молочной железы выделяли при помощи набора QIAamp DNA mini Kit (Qiagen, Германия).
Уровень экспрессии генов Top2a, TYMS, TUBB3 оценивали при помощи описанной ранее [11] количественной обратно-транскриптазной ПЦР в режиме реального времени (RT-qPCR) по технологии TaqMan на амплификаторе RotorGene-6000 (Corbett Research, Австралия). Для получения кДНК на матрице РНК провели реакцию обратной транскрипции с помощью набора RevertAid™ (ThermoFisher, США) со случайными гексануклеотидными праймерами.
Микроматричный анализ проведен на ДНК-чипах высокой плотности фирмы Affymetrix (США) CytoScanTM HD Array на системе Affymetrix GeneChip® Scanner 3000 7G (Affymetrix, США). Для обработки результатов микрочипирования использована программа «Chromosome Analysis Suite 3.0» (Affymetrix, США). Данная микроматрица позволяет по методу SNP-array определять CNA (copy number aberration: делеции и амплификации) в полногеномном формате размером более 3 kb всех хромосом с чувствительностью 5–10% мутантной ДНК на фоне нормальной ДНК стромы опухоли.
Эффективность НАХТ оценена по шкале ВОЗ на основании данных клинического осмотра, ультразвукового исследования молочных желез и маммографии, проведенных до лечения и через 3 недели после каждого курса ХТ. Полный морфологический регресс подтвержден гистологически.
Статистическая обработка данных выполнена с использованием пакета программ SPSS Statistics 17.0 (США).
Проведение данного исследования одобрено этическим комитетом НИИ онкологии Томского НИМЦ РАН.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Разработка алгоритма персонализированного назначения НАХТ
Персонализированный подход к назначению НАХТ может быть представлен в виде двухуровневой структуры. На первом этапе необходимо определиться в отношении целесообразности проведения предоперационного лечения, на втором в случае положительного ответа осуществить адекватный выбор препаратов и схемы. Для этого до начала лечения в ткани опухоли проведена идентификация хромосомных аберраций числа копий (CNA), ассоциированных с высокой эффективностью НАХТ (делеция генов АВСВ1-7q21.1, АВСB3-6p21.32, ABCC1-6p13.1, ABCG2-4q22.1, АВСС5-3q27, АВСВ7-Xq13.3, делеция регионов 18р11.1–32; 11q21–25 и амплификация 1q21–44 региона), наличие которых рассматривалось в качестве показаний к назначению предоперационной химиотерапии [9, 12]. Достаточным условием служило наличие в ткани опухоли хотя бы одной из указанных мутаций. В случае их отсутствия лечение больных начиналось с хирургического вмешательства.
При положительном решении в отношении проведения НАХТ следующим этапом был выбор препаратов и схем для лечения. Так, показанием к применению антрациклинов служили наличие в опухолевой ткани амплификации локуса гена Тор2а, а также высокий уровень его экспрессии – более 4,1.
Вопрос о целесообразности назначения капецитабина возникал в том случае, когда были показаны препараты антрациклинового ряда и осуществлялся выбор между использованием 5-фторурацила и капецитабина, т.е. между назначением схемы FAC или САХ. Основным критерием, подтверждающим необходимость применения капецитабина, был высокий уровень экспрессии TYMS ≥2,1.
Делеция гена BRCA1 в опухолевой ткани, при которой резко снижается экспрессия и возникает его дефицит в опухоли (как и при гетерозиготной наследственной мутации), была определена в качестве показания к назначению схем с включением препаратов платины и рассматривалась как противопоказание к назначению таксанов.
В качестве предикторного фактора для назначения таксанов использован низкий уровень экспрессии TUBB3.
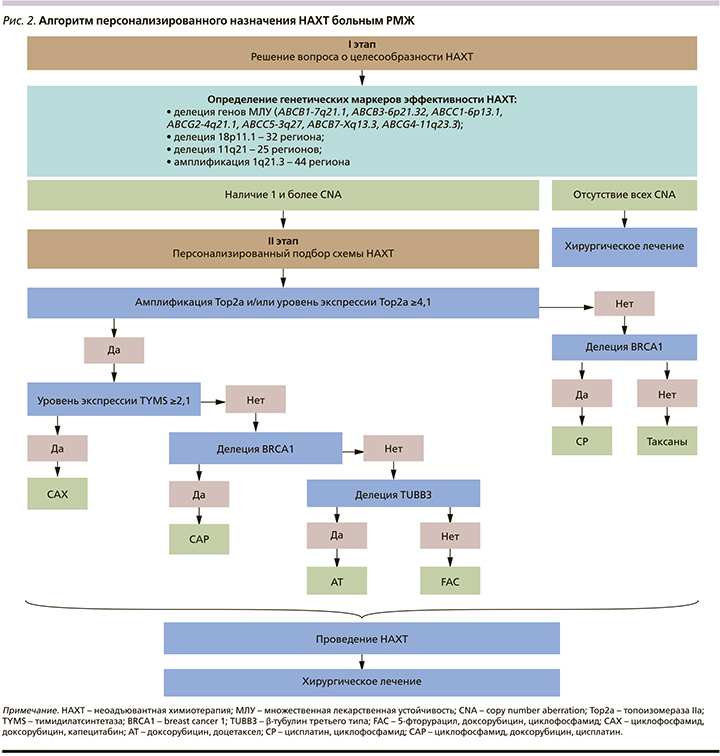
С учетом разной предсказательной значимости представленных маркеров персонализированный выбор схемы НАХТ может иметь, на наш взгляд, следующую иерархическую организацию: ведущую роль играет определение показаний к назначению антрациклинов, а именно – амплификация гена Тор2а и/или уровень его экспрессии ≥4,1. Это определяет возможность использования таких схем, как FAC, CAX, CAP и AT. Затем решается вопрос о целесообразности использования капецитабина. Схема САХ назначается при высоком уровне экспрессии в опухолевой ткани гена TYMS, при низком определяющим в выборе схемы становится состояние локуса гена BRCA1. При делеции данного гена рекомендуется использование препаратов платины. Если есть показания к назначению антрациклинов и платины, целесообразно использование схемы САР. Наименьшую предиктивную значимость имела делеция TUBB3, поэтому при ее обнаружении у пациентов, которым были рекомендованы антрациклины, использовалась схема АТ. При наличии показаний только к назначению препаратов антрациклинового ряда рекомендована схема FАС.
В отсутствие показаний к назначению антрациклинов определяющим стало состояние локуса гена BRCA1. Его делеция определяет целесообразность применения препаратов платины и одновременно служит противопоказанием к использованию таксанов – схема СР. В условиях отсутствия амплификации Тор2а, низком уровне его экспрессии и отсутствия делеции BRCA1 были рекомендованы таксаны в монорежиме.
На основании представленных данных был сформирован двухуровневый алгоритм персонализированного назначения НАХТ больным РМЖ (рис. 2).
Валидация разработанного алгоритма
Разработанный алгоритм был положен в основу определения тактики лечения 37 больных первично-операбельным люминальным В РМЖ (исследовательская группа). Для решения вопроса о целесообразности назначения НАХТ в опухолевой ткани каждой пациентки определены ранее обозначенные CNA: делеции АВСВ1, АВСВ3, АВСС5, АВСС1, АВСВ7, АВСG2, 11q21-25, 18p32-11.1 регионов, амплификация 1q21.3-44. Наличие хотя бы одного из этих маркеров зарегистрировано у 26 (70,3%) пациенток. В качестве первого этапа лечения им было рекомендовано проведение НАХТ. Остальным 11 (29,7%) пациенткам лечение начали с операции.
В случае утвердительного ответа в отношении целесообразности проведения НАХТ следующим этапом был индивидуальный подбор схемы ХТ. Для этого в опухолевой ткани определены амплификация гена Тор2а, уровень его экспрессии, уровень экспрессии TYMS, делеция гена BRCA1, делеция гена TUBB3. Частота назначения схем НАХТ представлена в таблице.
При оценке эффективности предоперационного лечения оказалось, что ПМР опухоли была достигнута 5 (19,2%) из 26 больных, непосредственная (по сумме полных и частичных регрессий) – 23 (88,5%) из 26, тогда как стабилизация наблюдалась только у 3 (11,5%) больных. Случаев прогрессирования заболевания отмечено не было.
В контрольной группе назначение ХТ в предоперационном периоде проведено по стандартным показаниям и без учета молекулярно-генетических особенностей опухоли. ПМР у этих пациенток была отмечена только в 5 (7%) из 71 наблюдения, что было практически в 3 раза реже, чем в исследуемой группе. Однако статистической значимости выявленные различия не имеют (р=0,08 по критерию Фишера), что, наиболее вероятно, обусловлено малым числом выборки. Иная картина наблюдалась в отношении непосредственной эффективности – в контрольной группе она была достигнута 38 (53,5%) из 71 больной и значимо ниже, чем у пациенток 1-й группы (р=0,002 по критерию Фишера). Прогрессирование заболевания на фоне НАХТ отмечено у 9 (12,7%) больных контрольной группы.
Следует отметить, что при персонализированном подходе к назначению НАХТ у 65,4% больных наблюдалось выраженное (более чем на 80% от первоначального размера) уменьшение объема опухоли, тогда как в контрольной группе этот показатель был значимо ниже и составил всего 24% (р=0,0002 по критерию Фишера).
ОБСУЖДЕНИЕ
На основе собственных результатов ранее проведенных исследований [9, 10, 12] и литературных данных разработан двухуровневый алгоритм персонализированного назначения НАХТ больным РМЖ. На первом уровне, учитывая наличие маркеров неспецифической резистентности – копийности генов АВС и копийности регионов 18р11.1 – 32; 11q21 – 25 и 1q21.3-44, определена целесообразность проведения предоперационного лечения. При наличии в опухоли хотя бы одного из них прогнозировалась высокая эффективность предоперационного лечения и рекомендовалось его проведение. Схема ХТ назначалась по результатам определения в опухоли маркеров копийности и экспрессии генов чувствительности. Проспективная клиническая валидация алгоритма с участием 37 больных люминальным В HER2(-)-РМЖ показала, что непосредственная эффективность лечения для пациенток с персонализированным назначением НАХТ составила 88,5 против 53,5% (р=0,002) в группе исторического контроля, где ХТ назначалась по стандартным показаниям независимо от молекулярно-генетических характеристик опухолевой ткани.
Обсуждение основных результатов исследования
В настоящем исследовании впервые разработан и проспективно валидирован алгоритм персонализированного назначения НАХТ больным РМЖ на основе комплекса молекулярно-генетических параметров опухоли пациентки, включая маркеры неспецифической резистентности и мишени действия ряда химиопрепаратов. В мировой литературе представлены данные о предсказательной значимости отдельных параметров. В частности, одним из наиболее изученных предикторов чувствительности при РМЖ является амплификация локуса гена топоизомеразы IIа (Тор2а) (17q12-21) и его высокая экспрессия. Продукт этого гена – белок ТорIIа – служит мишенью действия антрациклинов, и его высокую экспрессию связывают с чувствительностью опухоли к этим препаратам [13, 14]. Ранее в наших исследованиях было показано, что амплификация гена топоизомеразы и уровень его экспрессии более чем 4,1 сопряжены с высокой эффективностью НАХТ антрациклинами [12].
При лечении больных РМЖ нередко используют капецитабин, который по своей сути является активным предшественником 5-фторурацила [15]. Согласно данным литературы, наиболее вероятным кандидатом на роль молекулярного предиктора эффективности этих препаратов может быть уровень экспрессии тимидилатсинтетазы (TYMS) – мишени действия фторурацила [16]. Наши результаты свидетельствуют о том, что пороговый уровень экспрессии гена TYMS, определяющий целесообразность использования капецитабина, равен 2,1.
Активно обсуждается корреляция между наличием герминальной мутации гена BRCA1, приводящей к снижению активности системы гомологичной репарации, и высокой чувствительностью опухоли к препаратам платины [17]. Присутствие этой мутации сопряжено также с низкой эффективностью препаратов таксанового ряда у больных РМЖ [18].
В качестве предиктора для назначения таксанов рассматриваются уровень экспрессии β-тубулина третьего типа и мутация в локусе этого гена [19]. В ранее проведенных нами исследованиях определить пороговый уровень экспрессии TUBB3 не представилось возможным, т.к. он был практически одинаковым при различных эффектах НАХТ, поэтому в последующем он не учитывался при выборе схемы ХТ. Тем не менее, принимая во внимание тот факт, что низкий уровень экспрессии гена зачастую сопряжен с делецией его локуса, сама делеция TUBB3 (16q24.3) была предложена нами в качестве показания к назначению таксанов.
При этом необходимо понимать, что даже при наличии показаний к использованию того или иного препарата далеко не во всех случаях будет достигнут ожидаемый результат, поскольку основной причиной неспецифической резистентности к ХТ (75–85%) является МЛУ, обусловленная работой продуктов генов АВС-транспортеров [8]. С этих позиций представлялось необходимым сначала определить, является ли опухоль в целом чувствительной к ХТ. Было очевидно, что для ответа на этот вопрос целесообразно изучение генов МЛУ как маркеров неспецифической резистентности. В более ранних исследованиях на ретроспективном материале нами было показано, что делеция ряда этих генов, а именно АВСВ1, АВСВ3, АВСС5, АВСС1, АВСG2, в опухолевой ткани ассоциируется с выраженным эффектом на проведение ХТ при использовании стандартных схем [9]. Кроме того, известно, что CNA некоторых хромосомных регионов, не являющихся генами МЛУ, также ассоциированы с химиорезистентностью опухолевых клеток [20]. Согласно нашим данным, высокий непосредственный эффект на предоперационную химиотерапию наблюдается при амплификации 1q21.3-44, делеции 11q21-25 и делеции 18p32-11.1. На ретроспективной группе показано, что если в опухоли есть хотя бы один из маркеров (делеции генов АВС и/или маркеры копийности регионов 1q21.3-44, 11q21-25 и 18p32-11.1), опухоль оказывалась чувствительной к НАХТ [10].
Ограничения исследования
Основным ограничением разработанного алгоритма служит отсутствие статистически значимых различий по частоте достижения ПМР в изучаемых группах. На наш взгляд, в значительной мере это обусловлено малочисленностью выборки, поскольку по частоте выраженного (>80%) частичного регресса опухоли между группами получены достоверные различия (р=0,0002).
Проведенное исследование свидетельствует о высокой предсказательной значимости разработанного алгоритма. Однако полученные на настоящий момент данные не позволяют определить его прогностическое значение. Только анализ отдаленных результатов лечения позволит сделать окончательные выводы.
Валидация разработанного алгоритма проведена только больным люминальным В HER 2(-)-РМЖ. Представляется целесообразным проведение аналогичных проспективных исследований и для других молекулярных подтипов РМЖ, что позволит говорить об универсальности предложенного алгоритма.
ЗАКЛЮЧЕНИЕ
Результаты исследования свидетельствуют об определении новых информативных предсказательных критериев, использование которых существенно повысило эффективность НАХТ по сравнению со стандартным подходом. Разработанный и проспективно клинически апробированный двухуровневый алгоритм позволяет персонализированно подходить к решению вопроса о целесообразности назначения предоперационной ХТ и в случае положительного ответа определиться с выбором схемы. Такой подход обеспечил не только высокую эффективность НАХТ больным люминальным В HER2 (-)-РМЖ, но и позволил в отсутствие показаний к ее проведению и ожидаемой низкой эффективности избавить ряд пациенток от необоснованной токсичности, связанной с воздействием химиопрепаратов.



