Обсуждается роль расстройств тканевого метаболизма, возникающих у пациентов с язвенной болезнью желудка или двенадцатиперстной кишки, осложненной кровотечением прежде всего на фоне сосудистой и легочной патологий, при которых сочетанное воздействие факторов ишемии и гипоксии быстро приводит к нарастанию явлений оксидативного стресса. Данные, полученные авторами в представленных в статье исследованиях, послужили основанием для рекомендации максимально рано включать в комплекс лечебных мероприятий препараты с антигипоксическим действием, в частности Актовегин.
Кровотечения из верхних отделов желудочно-кишечного тракта (ЖКТ) являются общей медицинской проблемой с уровнем встречаемости от 50 до 150 случаев на 100 тыс. человек в год. Среди всех пациентов, обращающихся за медицинской помощью в связи с развитием желудочно-кишечных кровотечений, около 50–70 % составляют пациенты с язвенной болезнью (ЯБ), осложненной кровотечением. С появлением Н2-блокаторов, ингибиторов протонной помпы и селективных ингибиторов циклооксигеназы-2, методики антихеликобактерной терапии отмечено снижение риска осложнений ЯБ. Так, в течение 1980-х гг., по данным S. Gustavsson и O. Nyren [16], на фоне широкого применения Н2-блокаторов частота плановых хирургических вмешательств снизилась на 85 %. А внедрение в широкую клиническую практику ингибиторов протонной помпы оказало более выраженный положительный эффект в лечении язвенных дефектов. Практически полностью исчезла также и плановая хирургия ЯБ. Сочетание эндоскопического гемостаза и антисекреторной терапии снижает уровень хирургической активности, оставляя ей место только в случае неэффективности консервативной тактики. Число пациентов, нуждающихся в проведении хирургических вмешательств
по поводу язвенных кровотечений, составляет 3–15 %.
Однако надеждам на то, что проблема ЯБ уже решена, не суждено было сбыться. Наряду с уменьшением общего числа больных количество ургентных осложнений, таких как перфорации и кровотечения, выросло в несколько раз. Отмечено также повышение частоты язвенных кровотечений, особенно у пожилых пациентов. Если проблему перфорации сегодня большинство хирургов решают путем ушивания прободной язвы, то язвы, осложненные кровотечением, по-прежнему вызывают много споров. Несмотря на значительные успехи в диагностике, эндоскопическом гемостазе, развитии малоинвазивных вмешательств и фармакотерапии язвенных кровотечений, уровень летальности все еще остается высоким, достигнув 10–15 % и практически не изменившиеся за последние двадцать лет. Особого внимания требуют пациенты с выраженной сопутствующей патологией, полиорганной недостаточностью и онкологическими заболеваниями, которые составляют
группу высокого риска и имеют высокую летальность при язвенных кровотечениях. Оптимизация диагностических и лечебных мероприятий могла бы снизить уровень летальности при язвенных кровотечениях и определить пути улучшения результатов консервативной терапии.
Имеющаяся на сегодняшний день неоднозначность тактики при данной патологии существует прежде всего потому, что больные, поступающие в стационар, представляют собой довольно разнородную группу как по возрасту, так и по клиническим проявлениям пептической язвы. В многопрофильном стационаре при квартальном анализе характера язвенных кровотечений обнаруживается, что более половины кровотечений развивается в результате острых, а не хронических язв. В попытке определить патофизиологические особенности развития язвы, осложненной кровотечением, был проведен многофакторный анализ, включивший данные периферической компьютерной электрогастроэнтерографии, импедансографии, оценку состояния свободнорадикальных процессов. Представленная статья касается оценки уровня секреции и его влияния на выбор метода лечения.
Целью настоящей работы являлось изучение желудочной секреции с помощью многоканальной внутрижелудочной рН-метрии у пациентов с верифицированным диагнозом язвы желудка или двенадцатиперстной кишки, осложненной кровотечением. В большинстве случаев острые язвы и язвенные кровотечения возникали у больных без язвенного анамнеза, но с наличием комплексной сосудистой патологии.
Материал и методы
Все пациенты поступили в ГКБ № 15 им. О.М. Филатова Москвы за 6 месяцев 2009 г. В исследование были включены 147 больных, у 53 (36 %) из которых в анамнезе была ЯБ. Эти 53 пациента имели типичную клиническую картину и ранее регулярно или нерегулярно получали лекарственную терапию по поводу язвы. Пациентов с острыми язвами было почти в два раза больше (94 человека). У этих больных, никогда не имевших в анамнезе ЯБ и поступивших в стационар по поводу тех или иных сосудистых заболеваний, острые язвы ЖКТ, осложненные кровотечениями различной степени тяжести, были диагностированы в процессе лечения основной патологии по клинической симптоматике, а затем верифицированы эндоскопически. Возраст больных, включенных в исследование, варьировался от 23 до 94 лет (средний возраст составил 57,37 ± 2,36 года, медиана – 58 лет). В исследование были включены 57 мужчин в возрасте от 27 до 77 лет и 90 женщин в возрасте от 23 до 94 лет.
В исследование не включили пациентов с тяжелыми профузными кровотечениями из хронических язв, которые были оперированы по экстренным показаниям в течение суток с момента возникновения кровотечения или в связи с высоким риском развития рецидива кровотечения.
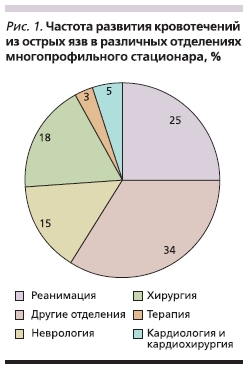
В зависимости от основного диагноза больные были госпитализированы в различные отделения многопрофильного стационара. Наличие клинических признаков желудочно-кишечного кровотечения служило основанием для проведения экстренной эзофагогастро-дуоденоскопии и последующего перевода пациента в хирургическое или реа-нимационное отделения. Как видно из рис. 1, абсолютное большинство пациентов с острыми язвами находились в отделениях нехирургического профиля, где больные получали различные виды лечения в сроки от 5 до 43 дней. В хирургических отделениях преимущественно находились пациенты с хронической язвой желудка или двенадцатиперстной кишки. В группе пациентов с острыми язвами отмечена высокая частота полиморбидности, лишь 15 % больных имели одно, а 85 % – сочетание двух и более заболеваний. Самыми частыми патологическими процессами у больных острыми язвами, осложненными кровотечениями, были сердечно-сосудистые расстройства (ишемическая болезнь сердца – ИБС, инфаркт, инсульт), сочетавшиеся с хронической патологией легких (хроническое неспецифическое заболевание легких, хроническая обструктивная болезнь легких), что имело место у 72 (67,7 %) пациентов. У 12 % больных острые язвы возникли после различных хирургических операций (нейро-, кардио-, общехирургического и травматологического профилей). Все острые язвы осложнялись кровотечением на 7–9-е сутки после операции.
Всем больным проведен комплексный клинико-лабораторный общепринятый мониторинг, включивший стандартные скрининговые показатели, которые используются для оценки состояния больных в отделениях интенсивной терапии (параметры соматического статуса, уровень сознания, гастродуоде-
носкопию в динамике; анализы крови, мочи, биохимические анализы, параметры кислотно-основного состояния крови – КОС, коагулограмму, уровень малонового диальдегида – МДА). Для оценки секреторной функции желудка использована многоканальная внутрижелудочная рН-метрия. Регистрация внутрипросветного рН проведена с помощью разработанного совместно с НПО “Исток-Система” компьютерного программно-аппаратного комплекса “Гастроскан”.
Результаты и обсуждение
Результаты проведенного исследования позволили выявить достоверную разницу в уровнях секреции у пациентов с хроническими и острыми язвами ЖКТ. Гиперацидность с рН < 2,0 отмечена у 49 (92,45 %) из 53 пациентов с хронической язвой. У пациентов с острыми язвами гиперацидность была зарегистрирована только у 5 (5,3 %) человек, но и у этих больных интенсивность кислотопродукции была низкой (щелочное время – более 20 минут). Динамическое наблюдение показало хороший эффект от проводимой антисекреторной терапии у всех пациентов с гиперсекрецией уже к концу 1-й недели от момента возникновения кровотечения. Это подтверждено данными контрольной эндоскопии, зарегистрировавшими уменьшение размеров язв.
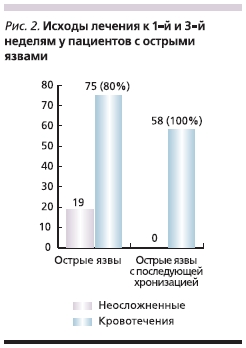
Принципиально иная картина отмечена у пациентов с острыми язвами (рис. 2). В течение 1-й недели 80 %пациентов с острыми язвами дали рецидивы кровотечения, что потребовало повторных многократных лечебных эндоскопий. Из оставшихся в живых к концу 3-й недели 58 (61,7 %) пациентов имели рецидивы кровотечений разной интенсивности. Визуально (по данным эндоскопии) характер язв также изменился. Отдельные язвы сливались в большой язвенный дефект или становились глубже. Такая отрицательная динамика имела место, несмотря на то что все пациенты с кровоточащими язвами в дополнение к базовой терапии по поводу основного заболевания (проводившейся согласно стандартам оказания медицинской помощи больным в стационаре в Москве) немедленно после эндоскопической остановки кровотечения вне зависимости от характера язвы начинали парентерально получать антисекреторные препараты в стандартных дозах. Объем и состав стандартной терапии у всех пациентов соответствовали общепринятым алгоритмам лечения больных, перенесших кровотечение из верхних отделов пищеварительного тракта. Поскольку тяжесть кровопотери у всех больных, включенных в исследование, соответствовала при остром развитии кровотечения 10 баллам по Горбашко, а при рецидиве – 13 баллам, всем больным потребовалась массивная инфузионная терапия как коллоидными – гидрок-сиэтилкрахмалом (Гемохесом 6 %, Венофундином, Инфуколом ГЭК), объем которых составлял от 2800 до 3500 л/сут, так и кристаллоидными растворами – физиологическим раствором, Ацесолем, 5 %-ной дексторозой (Глюкозой) в объеме не менее 2000 л/сут. Практически всем больным проводилась заместительная терапия свежезамороженной плазмой в объеме от 300 до 600 мл/сут. В отделениях интенсивной терапии в качестве антисекреторной терапии все больные получали ранитидин (Ацилок) или эзомепразол (Нексиум) внутривенно.
Подобные результаты подтвердили наши сомнения в отношении ведущей роли кислотно-пептического фактора в развитии острых язв у этой категории пациентов. Дополнительный анализ состояния КОС крови пациентов с кровотечениями из острых язв и уровня МДА показал, что у пациентов с гипоксическо-ишемическими синдромами, которые проявлялись тканевой гипоксемией со снижением РО2 и нарастанием уровня лактата, выяв-лена активация липидной составляющей оксидативного стресса, проявлявшаяся нарастанием уровня МДА. Эти расстройства тканевого метаболизма развивались у пациентов прежде всего на фоне сосудистой и легочной патологий, при которых сочетанное воздействие факторов ишемии и гипоксии быстро приводило к нарастанию явлений оксидативного стресса.
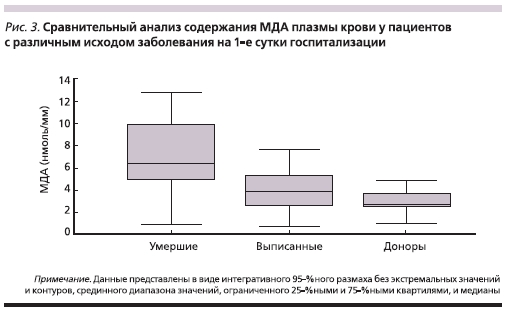
В частности, у пациентов с острыми язвами, осложненными кровотечением, было отмечено достоверное нарастание уровня МДА (рис. 3), что отражает гиперактивацию процессов перекисного окисления липидов (ПОЛ). В результате этого процесса повреждаются структуры клеточных мембран, в т. ч. клеток в тканях с высоким метаболизмом и/или в агрессивной среде. Именно это сочетание имеет место в верхних отделах пищеварительной трубки. Достоверность полученных данных была высокой при (р < 0,001), которые уже в первые сутки тесно коррелировали с исходом заболевания (рис. 3), что свидетельствует о прогностическом значении данного маркера у пациентов с острыми язвами, осложненными кровотечениями.
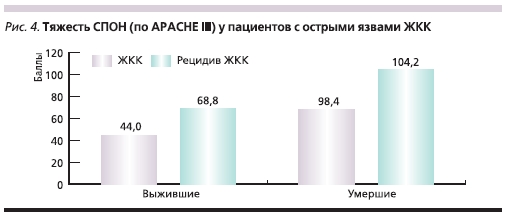
Рецидивы кровотечения во всех случаях коррелировали с тяжестью синдрома полиорганной недостаточности (СПОН), нарастание тяжести которой явилось причиной летального исхода у 50 % пациентов (рис. 4). Так, при интегративной тяжести СПОН, имеющей при оценке по шкале поли-
органной дисфункции APACHE III (Acute Physiology And Chronic Health Evaluation) более 90 баллов, у больных с максимально высоким уровнем МДА летальность составила 95 %. Кроме того, тяжесть состояния больных оценивали по физиологическому индексу тяжести Possum, составившему в обследованной группе в среднем не менее 25 баллов. Рост летальности коррелировал с уровнем этого индекса, составившим у больных с неблагоприятным исходом более 35 баллов.
Данные проведенного комплексного анализа фоновой клинической картины заболевания, его течения, особенностей состояния секреции и некоторых параметров свободнорадикальных процессов у пациентов с язвенными желудочно-кишечными кровотечениями выявили роль расстройств тканевого метаболизма, которые в наивысшей степени были выражены у наиболее тяжелых больных с острыми язвами и определяли неблагоприятный прогноз.
Нарастание тяжести расстройств тканевого метаболизма (о чем свидетельствует повышение уровня вторичного продукта ПОЛ – МДА, отражающего выраженность нарастания липидного дисбаланса и липидной пероксидации) может лежать в основе неблагоприятного течения данного патологического процесса (отсутствие репарации язв, рецидивы кровотечений, утяжеление СПОН). Наряду с недостаточной эффективностью стандартной антисекреторной терапии полученные данные послужили обоснованием для изменения тактики терапии с максимально ранним включением в комплекс лечебных мероприятий препаратов с антигипоксическим действием.
Речь идет об антигипоксантах, поскольку сегодня фундаментальной наукой достаточно подробно изучены дисбалансы тканевого метаболизма, обусловленные синдромами тканевой ишемии и гипоксии. Кинетику патохимических реакций этих дисбалансов можно замедлять или частично блокировать именно противогипоксическими средствами.
В настоящее время наиболее изучены следующие гипоксические дисбалансы (аутокоидозы):
• а) метаболический аутокоидоз: разрушает промежуточный обмен веществ (гликолиз); проявляется дефицитом энергии, ацидозом, лактатацидозом, разобщением окисления и фосфорилирования, развитием эндогенной интоксикации, образованием реактивных радикалов;
• б) оксидативный актокоидоз: разрушает мембраны клеток; проявляется образованием гидроперекисей липидов, окислением мембранных белков, разрывами нуклеиновых кислот в ядре;
• в) лиганд-рецепторный аутокоидоз: разрушает сигнальные и транспортные системы мембран (синтезы и рецепторы сигнальных молекул), проявляется эксайтотоксичностью (поступлением глутамата, кальция и натрия в клетки), “потерей кальциевого гомеостаза” клеток, дефицитом трофотропной (гиперполяризующей) регуляции функции биологических мембран органов и тканей;
• г) цитокиновый (адгезивно-воспалительный) аутокоидоз: разрушает гистогематические барьеры
и клеточные контакты; проявляется лейкоцитарной инфильтрацией места повреждения, увеличени-
ем активности провоспалительной цитокинергической системы, развитием адгезивно-воспалительных
реакций в зоне ишемического повреждения;
• д) апоптозный аутокоидоз: разрушает пораженный ишемией клеточный кластер; проявляется апоптозом, гипоксическим некробиозом, гибелью клеток.
Современный антигипоксант должен представлять собой рецептуру, компоненты которой направлены на основные типы дисбалансов, возникающих при гипоксии. К препаратам, действие которых направлено на коррекцию сразу нескольких патологических звеньев расстройств тканевого метаболизма, относится известный на российском фармакологическом рынке антигипоксант – Актовегин. Выбор данного лекарственного средства базировался на результатах экспериментального исследования T. Brzozowski и соавт., в котором была показана высокая эффективность
его применения в лечении животных с моделями острой желудочной язвы. Гастропротективные свойства Актовегина связаны с синтезом простагландинов, которые, как известно, участвуют в поддержании микроциркуляции в слизистой оболочке желуд-ка, а также с комплексным метаболотропным и рецепторотропным действиями, влиянием на промежуточный обмен веществ, трофотропную регу-ляцию и апоптозный дисбаланс. Эти влияния присущи Актовегину за счет содержащихся в нем предшественников многих химических синтезов, таких как таурин, глицин и аденозин, которые выполняют функции нейротрансмиттеров, противодействующих эксайтотоксичности. Более того, при применении Актовегина активируется негексокиназный транспорт глюкозы в клетки. Даже в условиях гипоксии недостаток кислорода “не мешает” клеткам использовать глюкозу для синтеза АТФ. Осуществление гликолиза в ишемизированных тканях обеспечивает работу других метаболических шунтов, в частности аланинового и орнитинового. Эти и другие аминокислоты также входят в состав Актовегина, что обеспечивает ему свойства многокомпонентной и высокоэффективной лекарственной комбинации. За счет своего состава Актовегин может выполнять роль “метаболической основы” для раскрытия действия прямых конкурентных агонистов трофотропных систем: холин-, пурин-, пептидергических и других веществ, действующих через Gi-белки (В.А. Ступин, 2005; С.А. Румянцева, В.А. Ступин, В.В. Афанасьев и соавт., 2010).
Широта терапевтического действия Актовегина очень велика, что позволяет применять его в больших дозах (до 2000 мг при внутривенном медленном введении на протяжении 2–3 часов) при минимальных побочных эффектах, поэтому препарат может использоваться длительно. Для того чтобы оказать реальное противоишемическое энергокорригирующее влияние на энергетический баланс организма, доза Актовегина должна соответствовать энергетическим потребностям ишемизированных тканей.
Эффективность препарата в лечении язвенных дефектов слизистой оболочки ЖКТ была показана и в исследованиях А.В. Смолянинова и соавт. (2006), когда в группах пациентов с разнотипными язвами, в т. ч. труднорубцующимися, при применении Актовегина был получен хороший терапевтический результат по сравнению со стандартной терапией. Препарат был использован в комплексной терапии у 15 больных с острыми язвами желудка, осложненными кровотечением, в дозе 1000 мг 2 раза/сут внутривенно, медленно, капельно в течение 10 суток. Затем терапия была продолжена препаратом в таблетированной форме в дозе 200 мг 3 раза/сут до момента выписки из стационара. Длительность
терапии, таким образом, составила от 21 до 30 суток (в среднем 25,5 суток). Во всех случаях острые язвы развились у пациентов с сочетанной сосудистой патологией (ИБС и инфаркт миокарда в анамнезе + цереброваскулярная болезнь: острый инсульт имел место у 6 больных, III стадия хронической ишемии головного мозга – у 4, у 5 больных поводом для госпитализации стали транзиторные ишемические атаки). Тяжесть состояния больных в этой группе достоверно не отличалась от группы пациентов, не получавших антиоксидантной терапии, которые рассматривались в качестве группы сравнения, и имела по шкале APACHE III 48 баллов. У всех больных, как получавших стандартную терапию, так и дополнительно принимавших антигипоксант Актовегин, риск рецидива кровотечения был достаточно высок, составив по Блечфорду около 12 баллов. И тем не менее в группе больных, получавших в комплексной терапии Актовегин, рецидив кровотечения возник у 4 (26,4 %) пациентов в отличие от группы пациентов с острыми метаболотропными язвами, которые получали только антисекреторную терапию, и где частота рецидивов достигала 80 %. Все рецидивы кровотечений возникали у больных в течение первых трех суток от момента начала терапии Актовегином. Хронизация язв, но без рецидива была зафиксирована всего у 5 (33,3 %) больных, что в три раза меньше, чем в группе сравнения. По данным фиброэндоскопического контроля, закрытие язв у всех больных произошло в сроки, не превысившие 21 день.
Таким образом, использование терапии антигипоксантом Актовегином достоверно улучшает результаты лечения пациентов с кровоточащими острыми язвами желудка и двенадцатиперстной кишки на фоне комплексной тяжелой сосудистой патологии. Полученные результаты подтверждают данные литературы о высокой эффективности применения такого вида терапии у пациентов с хроническими язвами желудка и двенадцатиперстной кишки. Накопленный опыт сравнительно мал, но полученные результаты убедили авторов в необходимости продолжения дальнейших клинических исследований в этом направлении.
1. Белоусов Ю.Б., Моисеев В.C., Лепахин В.К. Клиническая фармакология и фармакотерапия. М., 1993. C. 394.
2. Белялов Ф.И. Лечение сочетанных расстройств. М., Н. Новгород, 2000. C. 350.
3. Биленко М.В. Ишемические и реперфузионные повреждения органов: молекулярные механизмы, пути предупреждения и лечения. М., 2002. C. 368.
4. Болдина И.Г., Миловский В.Г. Перспективы использования антигипоксантов при коррекции нарушения энергооброзования при эндогенной интоксикации. Антигипоксанты и антиоксиданты. Итоги и перспективы. СПб.,1999. С. 19.
5. Владимиров Ю.А., Арчаков А.К. Перекисное окисление липидов в биологических мембранах. М., 1972. C. 252.
6. Гельфанд Е.Б., Гологорский В.А., Гельфанд Б.Р.Абдоминальный сепсис: интегральная оценка тяжести состояния больных и полиорганной дисфункции // Анестезиология и реаниматология 2000. № 3. С. 29–34.
7. Гринберг А.А. Неотложная абдоминальная хирургия. М., 2000. C. 496.8. Лукьянова Л.Д. Фармакологические аспекты биоэнергетики клетки при гипоксии. В сб. трудов НИИ фармакологии АМН СССР. М., 1990. С. 184–217.
9. Мороз В.В. Пути коррекции гипоксии при критических состояниях. Дис. д-ра мед. наук. М., 1994.
10. Николаенко Э.М., Фигурова Л.М., Волкова М.И. Клинико-физиологические эффекты использования актовегина в комплексе интенсивной терапии. Актовегин: новые аспекты применения в клинической практике. М., 1997. С. 28–37.
11. Румянцева С.А., Ступин В.А., Афанасьев В.В., Критические состояния в клинической практике. М., 2010. C. 640.
12. Спиридонов С.В. Оптимизация интенсивной терапии острых язвенных гастродуоденальных кровотечений. Автореферат на соискание ученой степени кандидата медицинских наук. СПб., 2008.
13. Ступин В.А., Румянцева С.А. Критические состояния в хирургии. М., 2005. C. 306.
14. Non-variceal upper gastrointestinal haemorrhage: guidelines. Gut 2002;51(4):1–6.
15. Longstreth GF. Epidemiology of hospitalization for acute upper gastrointestinal haemorrhage: a population-based study. Am J Gastroenterol 1995;90:206–10.
16. Gustavsson S, Nyren O. Time trends in peptic ulcer surgery, 1956 to 1986. A nationwide survey in Sweden. Ann Surg 1989; 210:704–09.
17. Sach G. Proton pump inhibitors and acid-related diseases. Pharmacotherapy 1997;17:22–37.
18. Yuan Y, Padol IT, Hunt RH. Peptic Ulcer Disease Today. Nat Clin Pract Gastroenterol Hepatol 2006;3(2):80–89.
19. Clason EE, McLeod DAD, Elton RA. Clinical factors in prediction of further haemorrage or mortality in acute upper gastrointestinal haemorrage. Br J Surgery 1986;73:985–87.
20. Fallah MA, Prakash C, Edmundowicz S. Acute gastrointestinal bleeding. Med Clin North Am 2000;84(5):1183–208.
21. Peter DJ, Dougherty JM. Evaluation of the patient with gastrointestinal bleeding: an evidence based approach. Emerg Med Clin North Am 1999;17(1):239–61.
22. Barkun A, Sabbah S, Enns R, et al. The Canadian Registry on Nonvariceal Upper Gastrointestinal Bleeding and Endoscopy (RUGBE): endoscopic hemostasis and proton pump inhibition are associated with improved outcomes in a reallife setting. Am J Gastroenterol 2004;99: 1238–46.
23. Hussain H, Lapin S, Capell MS. Clinical scoring systems for determining the prognosis of gastrointestinal bleeding. Gastroenterol Clin North Am 2000;29:2.
24. Forrest JA, Finlayson ND, Shearman DJ. Endoscopy in gastrointestinal bleeding. Lancet 1974;2:394–7.
25. Sung JJ, Tsoi KK, Ma TK, et al. Causes of mortality in patients with peptic ulcer bleeding: a prospective cohort study of 10,428 cases. Am J Gastroenterol 2009;15.
26. Sung J. Current Management of Peptic Ulcer Bleeding. Nat Clin Pract Gastroenterol Hepatol 2006;3(1):24–32.
27. Sanders DS, Carter MJ, Goodchap RJ, et al. Prospective Validation of the Rockall Risk scoring system for upper GI hemorrhage in subgroups of patients with varices and peptic ulcers. Am J Gastroenterol. 2002;97:3.
28. Rockall TA, et al. Incidence of and mortality from acute upper gastrointestinal haemorrhage in the United Kingdom. Steering committee and members of the National Audit of Acute Upper Gastrointestinal Haemorrhage. BMJ 1995;38:222–26.
29. Rockall TA, Logan RF, Devlin HB, et al. Risk assessment after acute upper gastrointestinal haemorrage. Gut 1996;38(3):316–21.
30. Blatchford O, et al. A risk score to predict need for treatment for upper-gastrointestinal haemorrhage. Lancet 2000;356:1318–21.
31. Fook-Hong Ng, Siu-Yin Wong, Kwok-Fai Lam, et al. Famotidine is Inferior to Pantoprazole in Preventing Recurrence of Aspirin-Related Peptic Ulcers or Erosions. Gastroenterology 2010;138(1):82–88.







