Проблема остеоартроза (ОА) занимает одно из ведущих мест в современной ревматологии, поскольку ОА – это самое частое заболевание среди всех ревматических болезней: на его долю приходится 60–70% [1]. Помимо высокой распространенности ОА характеризуется прогрессирующим течением, приводящим к преждевременной потере трудоспособности. Среди всех причин инвалидности ОА находится на 6-м месте, а в долгосрочной перспективе (к 2020 г.) прогнозируют, что ОА переместится в этом списке на 4-е место [2].
По влиянию на состояние здоровья ОА занимает 4-е место среди женщин и 8-е – среди мужчин среди всех заболеваний. В США ОА страдают 13,2 млн человек, в Европе – 14,5 млн, в Японии – 6,6 млн. В России ОА выявлен у 15 млн человек, причем распространенность этого заболевания за последние годы возросла на 35% [3]. По последним данным ФГБНУ НИИР им. В.А. Насоновой, распространенность ОА среди населения России составила 13% (13 тыс. больных на 100 тыс. населения), что значительно выше результатов официальной статистики, где зарегистрировано в 5 раз меньше больных ОА (2720 на 100 тыс. населения) [4].
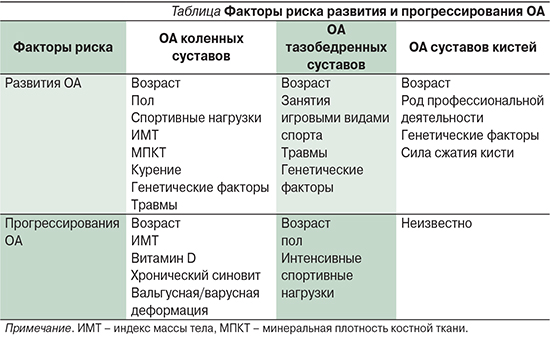
ОА рассматривается как заболевание, затрагивающее все элементы сустава, в первую очередь хрящ, а также субхондральную кость, синовиальную оболочку, связки, капсулу, околосуставные мышцы. Однако, несмотря на массу исследований, этиология ОА до конца не установлена [5]. Полагают, что ОА представляет собой многофакторное заболевание с определенными фенотипами, на развитие и прогрессирование которого влияет множество факторов [6] (см. таблицу).
В настоящее время представление об ОА как исключительно дегенеративном поражении хрящевой ткани ушло в прошлое, данные последних лет свидетельствуют о главенствующей роли воспаления в патогенезе ОА [7]. В связи с этим изменилось и определение ОА, которое подчеркивает, что развитие болезни обусловлено клеточным стрессом и деградацией экстрацеллюлярного матрикса, которые возникают при макро- или микроповреждениях, и при этом активируются ненормальные адаптивные восстановительные ответы, включая провоспалительные пути иммунной системы, костное ремоделирование и образование остеофитов.
Анализ постоянно растущего числа работ свидетельствует об особой роли цитокинов в патогенезе ОА, синтез которых может изменяться в зависимости от продолжительности и тяжести заболевания [10].
Среди многих представителей цитокинов наибольшее значение имеют интерлейкин-1β (ИЛ-1β), фактор некроза опухоли α (ФНО-α), ИЛ-6, -15, -17 и -18. Одним из ключевых цитокинов в патогенезе ОА считается ИЛ-1β: он вызывает воспалительные реакции и катаболические процессы как самостоятельно, так в сочетании с другими цитокинами [8]. При стимуляции ИЛ-1β хондроциты синтезируют протеолитические ферменты (матриксные металлопротеиназы – ММР), вызывающие деградацию коллагена и протеогликана хряща [7]. Кроме того, ИЛ-1β стимулирует выработку активных форм кислорода, которые генерируют образование пероксидов и гидроксилированных радикалов, способных непосредственно повреждать суставной хрящ [9]. У больных ОА высокие уровни ИЛ-1β обнаруживаются как в синовиальной жидкости, так и в синовиальной оболочке, хрящах, а также в субхондральном слое кости [10].
ФНО-α, так же как и ИЛ-1β, считается одним из ключевых воспалительных цитокинов, участвующих в патофизиологических процессах, протекающих при ОА. ФНО-α влияет на блокирование синтеза хондроцитами протеогликанов, белков, связывающих протеогликаны, и коллаген II типа [11]. Сами хондроциты начинают продуцировать «неполноценные» низкомолекулярные белки матрикса хряща вследствие нарушения равновесия между катаболическими и анаболическими процессами, что приводит к снижению амортизационных свойств хряща и его деградации [12].
Интересно, что в мета-воспалении при ОА участвует и жировая ткань. Хорошо известно, что избыточная масса тела служит фактором риска не только развития, но и прогрессирования ОА, и здесь как принимается во внимание избыточная нагрузка на суставы при ожирении, так и подчеркивается роль жировой ткани как метаболического органа, т.е. существует взаимосвязь ОА с метаболическими изменениями, происходящими при ожирении. При одном и другом состоянии наблюдается повышенная циркуляция системных воспалительных маркеров, например, таких как С-реактивный белок, ИЛ-1β и ФНО-α [13]. Кроме того, лептин, провоспалительный гормон, вырабатываемый макрофагами жировой ткани, является ключевым медиатором метаболических нарушений при ОА. Недавние исследования показали, что лептин способен вызывать синтез ММП, участвующих в повреждении хряща при ОА [14]. При ОА различные ММП, в т.ч. коллагеназа, стромелизин, желатиназа, мембранные протеиназы и металлоэластазы, обнаруживаются в хряще в повышенных концентрациях по сравнению с нормой, причем степень повышения активности этих ферментов, как правило, коррелирует со степенью повреждения хрящевой ткани [7].
Установлено, что ожирение часто предшествует развитию ОА коленных суставов и увеличивает риск прогрессирования рентгенологических изменений в коленных суставах [15]. По данным мета-анализа, проведенного L. Jiang и соавт., увеличение ИМТ на каждые 5 единиц вызывает увеличение риска развития ОА коленных суставов на 35% [16].
В большом исследовании, проводимом в Канаде в течение 22 лет, показано, что риск развития ОА коленных суставов у лиц с ИМТ>30 кг/м² был в 7 раз выше, чем при ИМТ<25 кг/м² [17].
Наблюдая 3585 человек в возрасте старше 55 лет в течение 6 лет, M. Reijman и соавт. обнаружили, что ИМТ>27 кг/м² достоверно связан с прогрессированием рентгенологических проявлений гонартроза: сужением суставной щели и увеличением стадии ОА по Kellgren–Lawrence [18].
Исследования, проведенные в Великобритании, показали тесную связь между ожирением (ИМТ>30 кг/м²) и рентгенологическими проявлениями ОА коленных суставов. Были изучены рентгенограммы коленных суставов 785 пар женщин-близнецов (средний возраст – 54,5±7,8 года). Тибиофеморальный ОА рентгенологически оценивался по классификации Kellgren–Lawrence. Обнаружена положительная связь между высоким ИМТ и ОА коленных суставов [19].
Кроме того, в ряде работ продемонстрировано влияние ожирения на ОА тазобедренных суставов. Норвежские исследователи изучали связь ожирения (ИМТ>30 кг/м²) с ОА тазобедренных суставов в общей популяции в течение 10 лет и установили, что при ожирении частота развития коксартроза на 5,8% выше, чем у лиц с нормальной массой тела [20]. Систематический обзор, включивший 12 исследований, выявил ассоциацию ожирения с ОА тазобедренных суставов, причем сильнее эта зависимость проявлялась среди больных с наличием клинических и рентгенологических признаков коксартроза [21].
Пациенты с избыточной массой тела и ожирением имеют высокий риск развития ОА суставов кистей. В Норвегии в 10-летнем исследовании пациентов с высоким ИМТ заболеваемость ОА суставов кистей была на 5,6% выше, чем при нормальных его значениях, причем женщины заболевали достоверно чаще, чем мужчины. Показано, что ожирение – это значимый независимый предиктор развития ОА суставов кистей [21]. В Мичигане при обследовании 1276 человек в возрасте от 50 до 74 лет в течение 23 лет было обнаружено, что ожирение в значительной степени связано как с заболеваемостью ОА суставов кистей, так и с его тяжестью [22].
Ожирение само по себе связано не только с развитием ОА, но и с другими тяжелыми сопутствующими заболеваниями, к которым относятся сахарный диабет 2 типа (СД2), артериальная гипертензия (АГ), дислипидемия, атеросклероз и связанные с ним заболевания, гиперурикемия и др. Среди больных ОА в свою очередь наблюдается высокий уровень коморбидности по сравнению с другими ревматическими заболеваниями.
Попытка выделить определенные фенотипы ОА привела к понятию «метаболический ОА», который связан не только с ожирением, но и с т.н. метаболическим синдромом (МС) или с его отдельными компонентами [23].
Согласно данным Международной диабетической федерации IDF (International Diabetes Federation), МС характеризуется увеличением массы висцерального жира и снижением чувствительности периферических тканей к инсулину [24].
Основной признак МС – центральный (абдоминальный) тип ожирения, который характеризуется увеличением окружности талии (ОТ) более 80 см у женщин и более 94 см у мужчин. К дополнительным критериям МС относятся АГ (артериальное давление АД≥130/85 мм рт.ст.), повышение уровня триглицеридов (≥1,7 ммоль/л), снижение уровня липопротеидов высокой плотности (<1,0 ммоль/л у мужчин; <1,2 ммоль/л у женщин), повышение уровня липопротеидов низкой плотности >3,0 ммоль/л, гипергликемия натощак (глюкоза в плазме крови натощак ≥6,1 ммоль/л), нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 часа после нагрузки глюкозой в пределах ≥7,8 и ≤11,1 ммоль/л). Наличие у пациента центрального ожирения и двух дополнительных критериев служит основанием для диагностики МС [24].
Основное звено в патогенезе МС – инсулинорезистентность, возникающая, когда клетки в организме (печени, скелетных мышцах и жировой ткани) становятся менее чувствительными и в конечном итоге устойчивыми к инсулину, гормону, который производится β-клетками в поджелудочной железе, чтобы облегчить поглощение глюкозы. Вследствие инсулинорезистентности глюкоза больше не поглощается клетками тканей и остается в крови, вызывая повышенную продукцию инсулина (гиперинсулинемия). В дальнейшем клетки поджелудочной железы вследствие апоптоза или истощения перестают вырабатывать инсулин, в результате чего развивается гипергликемия [24].
Изучение частоты МС в США показало: МС и его компоненты встречались значительно чаще среди больных ОА по сравнению с лицами без ОА (59 и 23% соответственно) [25]. АГ была выявлена у 75% пациентов с ОА и у 38% без ОА, абдоминальное ожирение (63 против 38% соответственно), гипергликемия (30 против 13% соответственно), повышение уровня триглицеридов (47 против 32% соответственно), снижение уровня липопротеидов высокой плотности (44 против 38% соответственно).
В Японии при исследовании 1690 человек (596 мужчин, 1094 женщины) в течение 3 лет было отмечено, что частота ОА коленных суставов и степень прогрессирования значительно возрастают с увеличением компонентов МС [26].
Так, C.A. Karvonen-Gutierrez, обследовав 482 женщины среднего возраста (47 лет), установил, что распространенность ОА у женщин без ожирения (ИМТ<30кг/м²) и без компонентов МС составила 4,7%, у женщин с ожирением (ИМТ>30кг/м²), но без компонентов МС – 12,8%, а при ожирении в совокупности с компонентами МС распространенность ОА составила 23,2%. Кроме того, среди этих пациентов наблюдалась выраженная интенсивность болей в коленных суставах и более тяжелое нарушение функции сустава [27].
Гипергликемия и ОА взаимодействуют как на локальном, так и на системном уровнях; локальные эффекты окислительного стресса и гликирования конечных продуктов усугубляют поражение хрящевой ткани, а накопление токсичных продуктов гликолиза может способствовать прогрессированию ОА [26]. S. Dahaghin и соавт. выявили ассоциацию СД с ОА суставов кистей у людей в возрасте 55–62 лет, причем более высокая частота ОА суставов кистей была отмечена в подгруппе пациентов с сочетанием избыточной массы тела, СД и АГ [28]. СД2 утяжеляет деструктивные процессы в тканях коленных суставов. В исследовании, проведенном в Ярославле, изучались 2 группы пациентов: с ОА (n=224) и c ОА и СД2 (n=162). Оказалось, что при наличии СД2 в 2 раза чаще выявляется III стадия ОА (р=0,001), в 1,4 раза более выражен остеофитоз в латеральном (р<0,001) отделе тибиофеморального сочленения [29].
АГ служит одним из дополнительных критериев МС. Анализ публикаций в Medline с 1966 по 2004 г. показал, что у 48–65% больных ОА сочетается с АГ, а у пациентов с ОА старше 80 лет, нуждающихся в артропластике коленных суставов, она встречается в 65% случаев [30]. В исследование, проведенное Л.Н. Денисовым и В.А. Насоновой в 2010 г., были включены 298 пациентов с манифестным ОА коленных и тазобедренных суставов. Изучалась связь между ожирением и частотой развития других заболеваний, а также прогрессированием ОА различных локализаций. Выявлено увеличение распространенности сердечно-сосудистых заболеваний и СД по мере увеличения ИМТ. В группе с ожирением (ИМТ>30 кг/м²) преобладал ОА II–III стадий (у 97%), у 80% пациентов с ИМТ>40 кг/м² установлены III–IV стадии ОА [31].
Кроме того, существуют данные о влиянии гиперхолестеринемии и гипертриглицеридемии на риск возникновения и прогрессирования ОА. Есть несколько механизмов, с помощью которых сосудистая патология может способствовать развитию ОА. Дистальные отделы костей особенно восприимчивы к сосудистой патологии. Венозная окклюзия в результате застоя крови в мелких сосудах, лежащих в основе пластины хряща, совместно с АГ, повышенной свертываемостью крови и/или микроэмболией может приводить к ишемии субхондральной кости, что в свою очередь способствует резорбции субхондральной кости и повреждению хряща [32].
В ряде недавних исследований установлены гендерные различия в патогенезе ОА и МС. Как правило, инсулинорезистентность в большей степени связана с висцеральным типом ожирения – одним из ключевых сердечно-сосудистых факторов риска для мужчин. Кроме того, первичная инсулинорезистентность ассоциируется с высоким риском возникновения [33] и прогрессирования ОА коленных суставов у мужчин [34]. СД способствует прогрессированию ОА коленных суставов у мужчин [34]. У женщин, страдающих ожирением, увеличение на 5 мкг/л лептина в 1,28 раза увеличивает тяжесть прогрессирования ОА по рентгенологическим признакам [33].
Все вышесказанное подчеркивает необходимость включения в план ведения больного ОА мероприятий, направленных не только на снижение массы тела, но и на основные патогенетические звенья МС [35], результатом которых будет уменьшение симптоматики ОА.
Немедикаментозное лечение ОА, диета и физические упражнения должны быть направлены на снижение массы тела.
Национальный институт здоровья (NIH – National Institutes of Health) США опубликовал клинические рекомендации по лечению избыточной массы тела у взрослых, основной принцип которых заключается в необходимости уменьшения массы тела на 10% по сравнению с исходной [36].
Как правило, при соблюдении диеты и выполнении физических упражнений масса тела снижается только на 5% от первоначального, но полученный результат большинству людей не удается сохранить в течение длительного времени [37].
Добавление медикаментозной терапии к гипокалорийной диете не только облегчает потерю массы тела, но и может предотвратить ее повторное увеличение, которое наблюдается при использовании только гипокалорийной диеты [38]. Согласно Европейским [39] и Российским [40] клиническим рекомендациям по лечению ожирения, назначение медикаментозных препаратов целесообразно тем пациентам с ожирением (ИМТ>30 кг/м²), которые не могут достичь или удержать клинически значимую степень снижения массы тела при использовании диеты и физических нагрузок, включая пациентов с факторами риска развития СД2. Среди препаратов, зарегистрированных в РФ в качестве лекарственного средства для лечения ожирения, рекомендуется орлистат [39]. Механизм действия орлистата основан на подавлении активности желудочно-кишечных липаз, что приводит к уменьшению всасывания жира в кишечнике, а в сочетании с гипокалорийной диетой вызывает значимое снижение массы тела [38].
В ФГБНУ НИИ ревматологии им. В.А. Насоновой подтверждена эффективность орлистата в отношении снижения массы тела у пациентов с ОА коленных суставов. В исследовании участвовали 50 женщин в возрасте 45–65 лет с ОА коленных суставов II–III стадий по Kellgren–Lawrence и ожирением (ИМТ>30 кг/см²), рандомизированных в 2 группы: 1-я группа (25 больных) принимала препарат орлистат в дозе 120 мг (1 капсула) 3 раза в сутки в течение 6 месяцев в комплексе с гипокалорийной диетой и физической активностью; 2-я группа (25 больных) находилась на немедикаментозной терапии ожирения (гипокалорийная диета и физическая активность).
Через 6 месяцев наблюдения снижение массы тела оказалось более выраженным в 1-й группе и составило 10,07% (в среднем на 10,5 кг) по сравнению с больными, которые находились только на гипокалорийной диете, у которых масса снизилась на 0,88% (в среднем на 1 кг). Было отмечено достоверное снижение параметров индекса WOMAC (Western Ontario and McMaster Universities Arthritis Index): уменьшение боли, скованности и улучшение функциональных способностей коленных суставов у больных, находившихся на терапии орлистатом. Кроме того, у этих пациентов отмечено значимое улучшение качества жизни по сравнению с больными с меньшей потерей массы тела (р<0,001).
Таким образом, результаты нашего исследования продемонстрировали, что снижение массы тела, особенно при приеме препаратов, способствующих уменьшению массы тела, у пациентов с ожирением и ОА коленных суставов ведет к уменьшению клинических проявлений гонартроза: уменьшению боли и улучшению функционального состояния. Снижение массы тела и уменьшение клинических проявлений ОА коленных суставов благоприятно влияют на показатели качества жизни пациентов, в связи с чем препараты, способствующие снижению массы тела, необходимо включать в схему лечения пациентов с ОА и ожирением.



