Заболеваемость колоректальным раком (КРР) и обусловленная им смертность как в Российской Федерации, так и во всем мире характеризуются постоянным ростом. Это одно из наиболее распространенных онкологических заболеваний, прочно занимающее третье место в структуре смертности, за последнее десятилетие прирост смертности от рака ободочной кишки составил 10,51%, рака прямой кишки – 0,36% [1, 2].
У 20–34% больных КРР на момент постановки диагноза имеются синхронные метастазы в печени, в целом на том или ином этапе заболевания метастазы в печени определяются среди 50–60% пациентов [3,4]. При этом в 80–90% случаев метастазы в печени нерезектабельны. Стандартом лечения пациентов с резектабельными метастазами в печени является их хирургическое удаление. Роль и место периоперационной химиотерапии (ХТ) в этой группе остаются дискутабельными, и мультидисциплинарная команда врачей должна тщательно оценивать характеристики болезни перед применением ХТ.
В мета-анализ D. Сilliberto и соавт. [5] было включено три рандомизированных клинических исследования, сравнивавших оперативное лечение с комбинацией хирургического и химиотерапевтических методов (n=642). Показано преимущество комбинированного лечения по безрецидивной выживаемости и времени без прогрессирования (ВБП). У больных КРР с резектабельными метастазами в печени различий в общей выживаемости в изученных группах не отмечено.
Основной целью при потенциально резектабельной ситуации служит выполнение на фоне лекарственной терапии радикального хирургического вмешательства на печени. При выявлении регрессии очагов в печени, достаточной для их радикального удаления (R0), хирургический этап должен выполняться максимально быстро. Обсуждение этой возможности на фоне проведения ХТ целесообразно проводить каждые 2 месяца.
При ретроспективном анализе, проведенном R. Adam и соавт. [6] у 1104 больных КРР с исходно нерезектабельными метастазами в печени на фоне ХТ (в 70% случаев режимы на основе оксалиплатина), установлено, что 138 (12,5%) пациентам удалось выполнить R0-резекции очагов в печени. Десятилетняя выживаемость составила 23% в группе больных с исходно нерезектабельными метастазами в печени и 30% у пациентов с исходно резектабельной болезнью. Пятилетняя выживаемость у больных, не имевших значимого ответа на лекарственную терапию, составила 8%. Среди пациентов, достигших объективного эффекта от лекарственного лечения, позволившего выполнить резекцию печени, 5-летняя выживаемость составила 37%.
В другом исследовании использование оксалиплатин-содержащих режимов ХТ позволило выполнить R0-резекцию 24 больным КРР с исходно нерезектабельными метастазами в печени. Медиана выживаемости составила 42,4 месяца [7].
Таким образом, больным КРР с потенциально резектабельными метастазами в печени необходимо назначение максимально эффективной лекарственной терапии с регулярным контролем эффекта и своевременным выполнением хирургического этапа. Подобный подход способствует достижению высокой выживаемости в данной группе пациентов.
Материал и методы
В ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России в проспективное исследование были включены 60 больных КРР с потенциально резектабельными метастазами в печени. При отборе больных ориентировались на следующие критерии резектабельности метастазов в печени: сохранение не менее 25% паренхимы печени, сформированной минимум двумя смежными сегментами, с адекватными желчеотведением и сосудистым кровоснабжением. Данные параметры соответствовали современным мировым рекомендациям [8, 9]. Все больные имели морфологически верифицированный диагноз аденокарциномы толстой кишки после удаления первичной опухоли и ранее по поводу диссеминированной болезни лекарственного лечения не получали.
В рамках комбинированного лечения всем больным были проведены предоперационная ХТ в среднем в течение 3,6±0,11 месяца и хирургическое лечение. У 54 из 60 (90 %) пациентов, включенных в исследование, проведена предоперационная ХТ с включением фторпиримидинов и оксалиплатина (XELOX, CAPOX, FOLFOX); остальные 6 (10%) больных получили режим FOLFIRI. Кроме того, у 7 (11,7%) из 60 больных к двухкомпонентным режимам ХТ добавлен бевацизумаб по 5,0–7,5 мг/кг внутривенно каждые 2–3 недели. После завершения лекарственной терапии всем 60 пациентам выполнена резекция печени различного объема.
Тактика послеоперационного ведения разрабатывалась в зависимости от первичной распространенности болезни, непосредственного ответа на ХТ, степени выраженности лечебного патоморфоза. Большинство (76,7%) больных в послеоперационном периоде получили профилактическую ХТ в среднем в течение 2,98±0,16 месяца.
Результаты и обсуждение
Предложенный алгоритм лечения позволил достичь высоких показателей выживаемости в изученной группе больных. Медиана общей выживаемости составила 49,1 месяца (95% доверительный интервал [ДИ] – 36,4–61,8). Однолетняя, трех- и пятилетняя общая выживаемость достигла 100%, 70,4% (95% ДИ – 58,6–82,2) и 48% (95% ДИ – 33,9–62,1) соответственно. Медиана ВБП составила 28,8 месяца (95% ДИ – 17,2–40,4), одно- и трехлетняя ВБП – 84,1 (95% ДИ – 74,6–93,6) и 46,7% (95% ДИ – 32,4–61,0) соответственно. Полученные показатели оказались несколько выше представленных в литературе [10–12].
Для выявления больных, которым применение двухкомпонентных режимов ХТ обеспечит наибольшую выгоду, целесообразно определение факторов прогноза. В нашей работе оценено прогностическое значение 32 клинико-морфологических характеристик. При однофакторном анализе потенциальное отрицательное влияние на прогноз имели локализация первичной опухоли в прямой кишке; метастазы в регионарных лимфоузлах на момент диагноза (N+); билобарные метастазы в печени; повышенный после завершения предоперационной ХТ уровень раково-эмбрионального антигена (РЭА; >5 нг/мл); отсутствие объективного эффекта; отсутствие или минимальный патоморфологический ответ (0, I, II степени). Эти результаты нашли подтверждение в ряде исследований [12, 13].
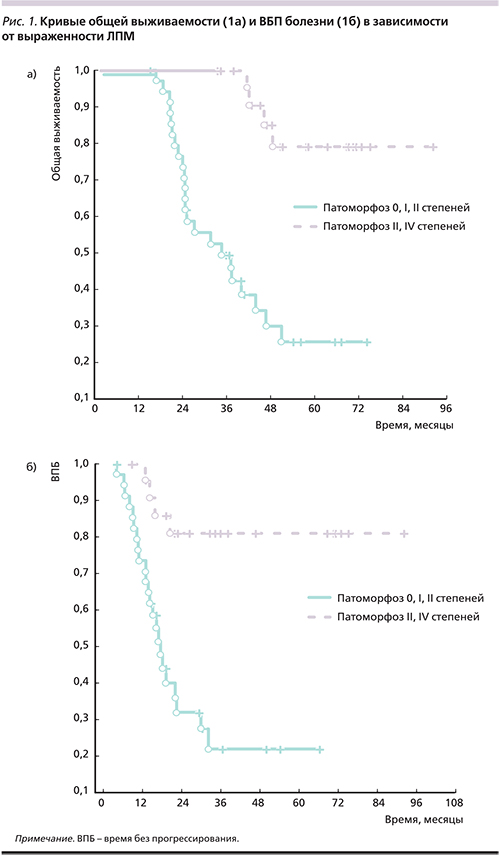
При этом значимое влияние на выживаемость больных оказала выраженность лечебного патоморфоза. Достижение лечебного патоморфоза III–IV степеней в метастазах печени достоверно улучшило выживаемость больных (p=0,005; рис. 1а).
При этом полная регрессия всех опухолевых очагов в печени был достигнута 4 пациентами, живущими более трех лет при среднем сроке наблюдения 42,3±2,6 месяца. Показатели 3- и 5-летней общей выживаемости достигли при лечебном патоморфозе III–IV степеней соответственно 100 и 78,9% (95% ДИ – 62,6–95,2) по сравнению с 52,7% (95% ДИ – 36,3–69,1) и 25,1% (95% ДИ – 10,8–39,4) при лечебном патоморфозе 0–II степеней. Сравнение кривых ВБП выявило аналогичные закономерности (p=0,006; рис. 1б).
Для выявления наиболее значимых факторов, влияющих на выживаемость больных КРР с метастазами в печени, проведен многофакторный анализ по 32 признакам. За основу мы выбрали 3-летний срок, поскольку средняя продолжительность наблюдения за пациентами составила 43,6 месяца и использование бóльших значений было бы некорректно. На первом этапе для всей группы больных определена значимость изучаемых параметров.
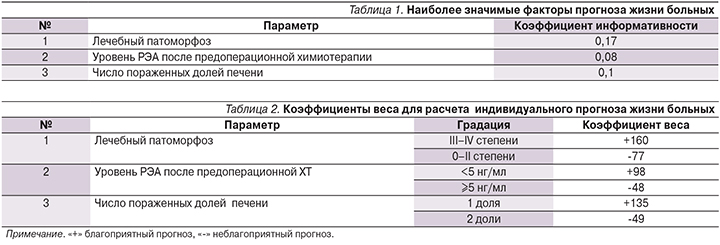
С учетом коэффициента информативности отобраны наиболее значимые из них (табл. 1).
Для каждого признака были рассчитаны коэффициенты веса, позволившие определить индивидуальный прогноз для больного. Точность трехлетнего прогноза жизни по 3 признакам составила 90% (95% ДИ – 63,4–99,3). Для оценки точности решающего правила была произвольно выбрана «экзаменационная» группа из 20 (33,3%) больных, подтвердившая высокую точность прогноза. Коэффициенты веса решающего правила представлены в табл. 2.
Проведенный многофакторный анализ определил следующие факторы благоприятного прогноза: достижение лечебного патоморфоза III–IV степеней, наличие нормального уровня РЭА после проведения предоперационной ХТ и исходная распространенность метастазов в пределах одной доли печени.
Среди неблагоприятных прогностических факторов были отсутствие или минимальные признаки лечебного патоморфоза, повышенный более 5 нг/мл уровень РЭА перед планируемой резекцией печени, билобарное метастатическое поражение печени.
Для определения индивидуального прогноза жизни больного суммируются коэффициенты веса каждого признака с учетом знака. При положительной сумме коэффициентов вероятность благоприятного прогноза составляет 90,9% (95% ДИ – 51,9–99,9); при отрицательной вероятность неблагоприятного прогноза составляет 88,9% (95% ДИ – 44,4–99,9).
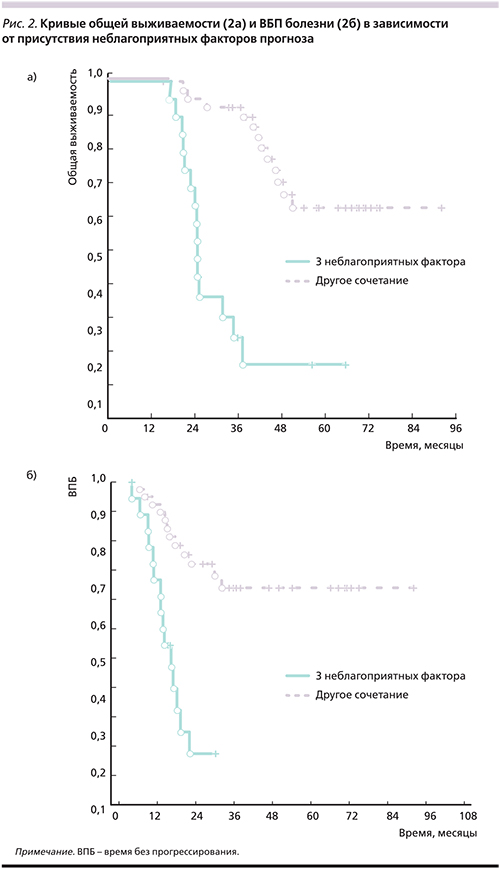
Одновременное сочетание трех неблагоприятных прогностических факторов значимо ухудшило выживаемость больных (рис. 2). Медиана общей выживаемости пациентов с метастазами в обеих долях печени, невыраженным лечебным эффектом на предоперационную ХТ (РЭА перед резекцией печени >5 нг/мл; лечебный патоморфоз 0–II степеней) составила 24,4 месяца (95% ДИ – 21,8–26,9). В группе сравнения медиана общей выживаемости не достигнута при среднем сроке наблюдения 50,5±4,7 месяца. Разница статистически достоверна (p=0,00004).
В первые 2 года после резекции печени у всех 19 пациентов неблагоприятной группы установлено прогрессирование болезни. Медиана ВБП составила 13,7 месяца (95% ДИ – 9,6–17,8). В отсутствие факторов неблагоприятного прогноза медиана ВБП не достигнута при среднем сроке наблюдения 33,6±2,4 месяца. Разница статистически достоверна (p=0,0002).
По нашим данным, у больных КРР с метастазами в печени после комбинированного лечения наибольшее прогностическое значение имеют следующие факторы: лечебный патоморфоз, уровень РЭА перед хирургическим лечением и число пораженных долей печени. При многофакторном анализе установлено, что при исходной распространенности метастазов в одной доле печени и выраженном лечебном эффекте на предоперационную ХТ (лечебный патоморфоз III–IV степеней, РЭА перед резекцией печени <5 нг/мл) ожидаемая продолжительность жизни больных превышает 3 года.
Таким образом, высокие лечебные результаты, в т.ч. у больных КРР с множественными метастазами в обеих долях печени, свидетельствуют об онкологической оправданности комбинированного лечения, сочетающего хирургическое вмешательство с предоперационной ХТ. При планировании операции основной целью является достижение R0-резекции метастазов. Наибольшее прогностическое значение имеют выраженность лечебного патоморфоза, уровень РЭА перед хирургическим лечением и число пораженных долей печени, что способствует индивидуализации прогноза жизни больных.



