Введение
Желчекаменную болезнь (ЖКБ) справедливо считают “болезнью века”,“болезнью благополучия и цивилизации”, связывая ее развитие с изменившимся характером питания. В настоящее время распространенность ЖКБ среди взрослого населения достигает 10–15 %; выявляется отчетливая тенденция к ее увеличению. Отмечается рост заболеваемости и среди детей. Все это вполне обоснованно предполагает увеличение числа оперативных вмешательств по поводу холецистолитиаза.
Длительное латентное течение ЖКБ приводит к тому, что у подавляющего большинства больных заболевание выявляется на стадии сформировавшихся желчных камней, когда, по сути, единственным методом лечения этой патологии остается оперативный [1].
В настоящее время холецистэктомия стала наиболее частым оперативным вмешательством на органах брюшной полости. В хирургических стационарах среди больных хроническими заболеваниями органов брюшной полости больные ЖКБ занимают первое место. Считается, что “выполненная по пока-
заниям своевременная плановая холецистэктомия в условиях высококвалифицированного хирургического стационара приводит к полному выздоровлению и полному восстановлению трудоспособности и качества жизни большинства пациентов” [2]. В качестве “золотого стандарта” оперативно-го лечения при ЖКБ признается лапароскопическая холецистэктомия [3].
Однако, несмотря на внедрение в клиническую практику даже менее инвазивных по сравнению с полостной холецистэктомией технологий, у части пациентов возникают т. н. постхолецистэктомические расстройства, обозначаемые как постхолецистэктомический синдром (ПХЭС) [4].
В последние годы в связи с резко увеличившейся хирургической активностью по поводу холецистолитиаза отмечен рост числа больных, поступающих в хирургические и терапевтические стационары с абдоминальным дискомфортом (болями в правом подреберье и эпигастрии, рецидивами
желчной колики, диспепсическими расстройствами и другими жалобами). По разным оценкам, частота ПХЭС достигает 5–40 % и более. По нашим данным, частота ПХЭС составляет 48,7 % [5].
Что такое ПХЭС?
Термин “постхолецистэктомический синдром” впервые появился в американской литературе еще в 1930-х гг. и с тех пор прочно занял свое место в медицинской терминологии. ПХЭС включен в Международную классификацию болезней 10-го пересмотра (шифр К 91.5). Однако едва ли в
медицине можно найти еще какойлибо синдром, который столь долго и вполне заслуженно подвергается критике как слишком общий и неконкретный, тем не менее сохраняет свою жизнеспособность и до настоящего времени [6].
Начиная с первой холецистэктомии трактовка причин болей и диспепсических расстройств, возникших
после операции, постоянно менялась. Вначале их объясняли техническими погрешностями во время операции и развитием спаечного процесса в зоне операции, что обусловило появление термина “истинный ПХЭС”. Определение охватило только рецидивы печеночной колики вследствие неполноценно произведенной холецистэктомии (посттравматическая рубцовая стриктура общего желчного протока, оставленная часть желчного пузыря, патологически длинная культя пузырного протока, резидуальные камни желчных протоков и др.).
В то же время ряд исследователей считают, что истинного ПХЭС не существует, а жалобы больных после операции связаны с заболеваниями, нераспознанными до холецистэктомии, или с неполным обследованием больного во время операции, а также недостаточной технической подготов-
кой хирурга.
В последующем основное внимание в развитии ПХЭС стали придавать выпадению функций желчного пузыря (ЖП) и его регулирующей роли на сфинктерный аппарат желчных путей. Не внесло ясности и определение ПХЭС, опубликованное в стандартах диагностики и лечения болезней органов пищеварения МЗ РФ за 1998 г. [7], трактующего его как “условное обозначение различных наруше-
ний, рецидивирующих болей и диспепсических проявлений, возникающих у больных после холецистэктомии”. Подобное определение вряд ли можно считать удачным и оказывающим помощь врачу как в формулировке диагноза, так и в понимании причинно-следственных нарушений, произошедших после операции.
Перед врачом, который сталкивается с пациентом, предъявляющим жалобы на боли после холецистэктомии, возникает абсолютная необходимость выявить истинную причину заболевания, конкретное нарушение, а не довольствоваться эфемерным понятием “постхолецистэктомический синдром” [8].
Согласно Римскому консенсусу по функциональным расстройствам органов пищеварения (1999, 2006), термином ПХЭС принято обозначать дисфункцию сфинктера Одди, обусловленную нарушением его сократительной функции, что препятствует нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку в отсутствие органических препятствий [9]. Это определение ПХЭС вошло и в новые стандарты диагностики и лечения лиц с заболеваниями органов пищеварения [10]. Подобное определение вряд ли можно считать удачным и оказывающим помощь врачу как в формулировке диагноза, так и в понимании причинно-следственных нарушений, произошедших после
операции.
Таким образом, точного понимания сути ПХЭС нет и до настоящего времени. Большинство авторов считают этот термин собирательным понятием, объединяющим многие патологические состояния, которые могут манифестировать в различные сроки после холецистэктомии.
Анализируя характер патологических изменений в организме, возникших после холецистэктомии, можно заключить, что более или менее выраженный симптомокомплекс, развивающийся после удаления ЖП, может быть обусловлен по меньшей мере группой причин, среди которых, на наш взгляд, целесообразно выделить следующие:
• диагностические ошибки, допущенные на дооперационном этапе во время обследования больного и/или во время операции;
• технические погрешности и тактические ошибки, допущенные при проведении операции;
• функциональные нарушения, связанные с удалением ЖП;
• обострение или прогрессирование существовавших до операции заболеваний гепатопанкреатобилиарной зоны.
Таким образом, конкретизировав основные причины развития ПХЭС, можно дать следующее его определение: постхолецистэктомический синдром – это совокупность функциональных и/или органических изменений, связанных с патологией ЖП или протоковой системы, возникших после холецистэктомии или усугубленных ею, или развившихся самостоятельно в результате технических погрешностей ее выполнения. Подобное определение позволяет шире рассматривать проблему ПХЭС,
нацеливает врача на более тщательное обследование больных перед операцией с целью выявления различной сопутствующей патологии органов пищеварения, позволяет понять патогенетическую связь между оперативным вмешательством и развившейся клинической симптоматикой после холецистэктомии. Именно с этих позиций с учетом всего комплекса патологических состояний,
развивающихся после холецистэктомии, рекомендует рассматривать проблему ПХЭС и V съезд Научного общества гастроэнтерологов России [11].
Патофизиологическое обоснование выделения ПХЭС
Для понимания характера патологических процессов, развивающихся после холецистэктомии, необходимо помнить об основных функциях билиарной системы.
Функции ЖП:
1. Эвакуаторная (в ответ на стимуляцию холецистокинином происходит сокращения ЖП и одновременное расслабление сфинктера Одди) – в пищеварительный период обеспечивается выброс необходимого количества желчи в двенадцатиперстную кишку.
2. Концентрационная (по сравнению с печеночной желчью ЖП за счет всасывания воды концентрирует желчь до 10-кратной величины) – обеспечивает качественный липолиз и бак-
терицидные свойства желчи [12].
3. Резервуарная – в межпищеварительный период обеспечивает депонирование желчи, несмотря на постоянную ее секрецию печенью (в период функционального покоя в ЖП депонируется практически весь пул желчных кислот).
4. Поддержание гидростатического давления в желчных путях – предохраняет развитие патологических панкреатобилиарных и дуоденохо-ледохеальных рефлюксов.
5. Абсорбционная – поглощение отдельных компонентов желчи как компенсаторная реакция при их
избытке в желчи.
6. Секреторная – секреция слизи железами шеечного отдела, что облегчает поступление желчи в ЖП и эвакуацию желчи из него.
7. Гормональная – выделение стенками ЖП антагониста холецистокинина – актихолецистокинина.
8. Модулирующее влияние на сфинктер Одди.
Функции сфинктера Одди:
1. Регулирует отток желчи и панкреатического сока в двенадцатиперстную кишку.
2. Предотвращает рефлюкс содержимого двенадцатиперстной кишки в холедох и главный панкреатический проток.
3. Обеспечивает накопление желчи в ЖП в период между приемами пищи, т. к. способен преодолевать секреторное давление печени (у здоровых людей базальное давление сфинктера Одди составляет 100–150 мм водн. ст., при дисфункции сфинктера Одди колеблется от 180 до 300
мм водн. ст. и выше).
4. Синхронизированно работает с ЖП.
Исходя из изложенного становится ясно, что утрата ЖП и его функций приводит к снижению качества и количества оттекающей желчи в двенадцатиперстную кишку и не всегда может быть полноценно компенсировано работой других органов пищеварения. В связи с этим создаются реальные условия для развития различных патологических состояний, снижающих качество пищеварения. Следует учитывать и тот факт, что течение хронических заболеваний ЖП, которые в конечном итоге приводят к холецистэктомии, часто сопровождается другими сопутствующими заболеваниями органов пищеварения. В первую очередь это касается заболеваний гепатопанкреатобилиарной зоны, что также отражается на качестве пищеварительных процессов. Например, при ЖКБ частота таких заболеваний достигает 60–80 % и более.
Различают следующие последствия удаления ЖП:
• выпадение эвакуаторной функции сопровождается нарушением адекватного желчеоттока, необходимого для полноценного пищеварения;
• выпадение концентрационной функции сопровождается нарушением процессов липолиза в тонкой
кишке, обусловленных снижением активизации панкреатической липазы; уменьшаются бактерицидные свойства желчи, что способствует развитию синдрома избыточного бактериального роста в тонкой кишке;
• утрата модулирующего эффекта ЖП на сфинктер Одди способствует развитию гипертонуса сфинктера Одди;
• выпадение резервуарной функции ЖП сопровождается постоянным желчеистечением, что не обеспечивает полноценного пищеварения в пищеварительный период, способствует формированию билиарных рефлюксов (дуоденогастрального, дуоденогастроэзофагеального), рефлюктат которых содержит детергентные желчные кислоты, способные повреждать слизистые оболочки;
• накапливаются сведения, что холецистэктомия повышает риск развития аденоматозных полипов и рака толстой кишки [13–15].
Таким образом, полученные данные позволяют заключить, что выпадение физиологической роли ЖП, в первую очередь его концентрационной функции, нарушение адекватного оттока желчи в двенадцатиперстную кишку в пищеварительный период сопровождаются нарушением пассажа желчи
в кишечник и как следствие – расстройством пищеварения. Снижение дебита желчных кислот, нерегулярное их поступление в двенадцатиперстную кишку нарушают переваривание и всасывание жиров, уменьшают бактерицидность дуоденального содержимого, приводят к дисбиозу тонкой кишки,
расстройству энтерогепатической циркуляции желчных кислот. Под влиянием измененной микрофлоры тонкой кишки желчные кислоты подвергаются преждевременной деконъюгации, что сопровождается повреждением слизистой оболочки с развитием дуоденита, рефлюкс-гастрита, рефлюксэзофагита. В свою очередь дуоденит сопровождается дуоденальной гипертензией и дискинезией двенадцатиперстной кишки, что способствует развитию патологических рефлюксов – забросу дуоденального содержимого в общий желчный и панкреатический протоки. В связи с этим развивается дискинезия как общего сфинктера печеночно-поджелудочной ампулы (сфинктера Одди), так и его составляющих — сфинктеров желчного и панкреатического протоков, что сопровождается билиарной и панкреатической гипертензией.
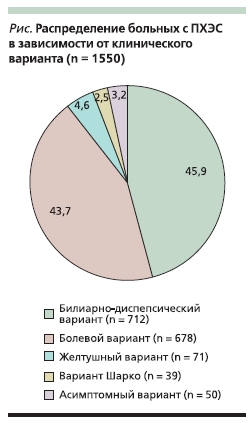
Поэтому, несмотря на то что холецистэктомия “убирает” больной орган, эта операция не всегда приводит к полному выздоровлению и у части пациентов сохраняются или появляются жалобы, которые в настоящее время классифицируют в виде различных вариантов ПХЭС (см. рисунок). Исследования показывают, что наиболее часто встречаются диспепсический и болевой варианты ПХЭС [16].
Болевой синдром после холецистэктомии является основной причиной, снижающей качество жизни больных после операции, и представляет серьезную клиническую проблему для врача. В большинстве (74,8 %) случаев болевой синдром обусловлен функциональными нарушениями, в частности спазмом сфинктера Одди [16]. Боли чаще развиваются после удаления функционирующего ЖП [17]. В связи с выпадением модулирующего влияния ЖП на сфинктер Одди у таких больных компенсаторно повышается уровень холецистокинина, что позволяет преодолевать его гипертонус [18]. Вследствие нарушения моторной функции сфинктера Одди изменяется индекс двигательной активности, который определяется умножением частоты его сокращений на амплитуду.
Спазм сфинктера Одди сопровождается билиарной гипертензией, что также может вызывать болевые ощущения. Хроническая билиарная гипертензия проявляется дилатацией желчных путей. При давлении 250–300 мм водн. ст. появляется боль, а в крови в результате расширения желчных канальцев и проникновения желчи в пространства Диссе, а оттуда и в синусоиды повышаются уровни выделившихся с желчью ферментов – щелочной фосфатазы и лейцинаминопептидазы. Кроме того, при удалении ЖП нарушается его регулирующее влияние на деятельность поджелудочной железы, что проявляется условной липазной недостаточностью и в результате – нарушением процессов пищеварения.
Таким образом, холецистэктомия далеко не всегда приводит к полному излечению. Удаление ЖП не компенсирует сложных патофизиологических нарушений, имеющих место при ЖКБ. После операции патологические процессы, характерные для этого заболевания, протекают в новых анатомо-физиологических условиях, характеризующихся выпадением физиологической роли ЖП, нарушением работы сфинктерного аппарата билиарного тракта, расстройством нейрогуморальной регуляции процессов желчеобразования и желчевыделения [19]. Совокупность патологических состояний, развивающихся после холецистэктомии, и как следствие – разнообразная клиническая симптоматика,
снижающие качество жизни больных, дают убедительные аргументы для существования ПХЭС и обосновывают выделение различных его клинических вариантов.
Диагностика
Исходя из изложенной концепции развития ПХЭС строится алгоритм диагностики. Диагноз устанавливается на основании клинических симптомов, данных лабораторных и инструментальных методов исследования. Для диагностики ПХЭС применяют методы, позволяющие выявлять функциональные и структурные нарушения билиарного тракта, протекающие как самостоятельно,
так и в ассоциации с другими заболеваниями органов пищеварения. В качестве скрининговых используют лабораторные (определение уровней γ-глютамилтранспептидазы, щелочной фосфатазы, билирубина, аспартатаминотрансферазы, аланинаминотрансферазы, амилазы) и инструментальные методы диагностики (ультразвуковое исследование, эзофагогастродуоденоскопия). В качестве дополнительных методов применяют эндоскопическую ретроградную холангиопанкреатикографию, эндоскопическую манометрию сфинктера Одди, динамическую холесцинтиграфию, магнитно-резонансную холангиографию, эндоскопическую ультрасонографию, этапное хроматическое дуоденальное зондирование и другие методы [20, 21].
Тщательное обследование больных ПХЭС с использованием высокоинформативных методов диагностики позволяет проводить своевременную и адекватную коррекцию анатомофункциональных нарушений, развившихся после удаления ЖП или усугубленных холецистэктомией.
Клиника
Клиническая картина при ПХЭС разнообразна. Чаще преобладают жалобы на боли различного характера и диспепсические расстройства, реже встречаются желтуха и лихорадка.
При дисфункции сфинктера Одди в зависимости от клинической симптоматики выделяют билиарный, панкреатический и смешанный типы. При изолированной дисфункции сфинктера холедоха возникают билиарные боли, при преимущественном поражении сфинктера панкреатического протока — панкреатические боли, а при патологии общего сфинктера — сочетанные билиарно-панкреатические
боли. При билиарном типе боль локализуется в эпигастральной области или правом подреберье с иррадиацией в спину и правую лопатку, при панкреатическом типе — в левом подреберье с иррадиацией в спину, при сочетанном типе характерна опоясывающая боль.
Лечение
Большое значение при ПХЭС имеет лечебное питание. Диетические рекомендации заключаются в частом (до 6 раз в день) и дробном питании. Необходимо ограничение жиров до 60–70 г в сутки. С целью скорейшей функциональной адаптации органов пищеварения к выпадению функций ЖП целесообразно как можно более раннее (в зависимости от сопутствующих заболеваний) расширение диеты. Основные принципы консервативной терапии при ПХЭС заключаются в восстановлении нормального биохимического состава желчи, оттока желчи и панкреатического секрета в двенадцатиперстную кишку, а также в лечении заболеваний, ассоциированных с патологией билиарного тракта.
При наличии хронической билиарной недостаточности необходима заместительная терапия препаратами урсодеоксихолевой кислоты (УДХК) [22]. Наш опыт показывает, что применение УДХК в средней суточной дозе 10–15 мг на 1 кг массы тела эффективно уменьшает степень билиарной недостаточности и выраженность дисхолии. Доза и длительность лечения УДХК определяются степенью билиарной недостаточности и динамикой изменения холатохолестеринового коэффициента на фоне терапии.
При наличии синдрома избыточного бактериального роста (СИБР) показаны антибактериальные препараты: ко-тримоксазол, Интетрикс, фуразолидон, нифуроксацид, ципрофлоксацин, эритромицин, кларитромицин, которые назначают в общепринятых дозах. Курс лечения – 7 дней. При необходимости проводится несколько курсов антибактериальной терапии со сменой препаратов в очередном курсе.
Весьма перспективными в лечении СИБР могут стать невсасывающиеся антибиотики. Первые опыты применения рифаксимина в клинике показывают, что препарат нормализует бактериальную микрофлору, уменьшает симптомы дуоденальной гипертензии, что имеет большое значение и для
больных ПХЭС [23].
После антибактериального курса показаны пробиотики (Бифиформ, Бифидумбактерин, Споробактерин и др.), пребиотики – Хилак форте, который нормализует кишечную микрофлору, стимулирует регенерацию поврежденных деконьюгированными желчными кислотами эпителиоцитов кишечной стенки.
Для связывания избытка желчных и других органических кислот, особенно при наличии холагенной диареи, показано применение алюминийсодержащих антацидов по 10–15 мл (1 пакетик) 3–4 раза в сутки через 1–2 часа после еды в течение 7–14 дней. По показаниям возможно применение ферментных препаратов (панкреатина и др.).
Симптоматическую терапию при ПХЭС назначают в зависимости от клинического варианта [24]. Однако основной задачей в лечении больных ПХЭС является восстановление оттока желчи и панкреатического сока, необходимых для полноценного пищеварения. После холецистэктомии развивается гипертонус сфинктера Одди. Механизм развития гипертонуса сфинктера Одди связан с выключением регулирующей роли сфинктера Люткенса и мышечной активности ЖП, т. к.
тонус сфинктера Одди рефлекторно понижается во время сокращения ЖП. Экспериментально установлено
уменьшение реакции сфинктера Одди в ответ на холецистокинин после холецистэктомии. Дисфункция сфинктера Одди является одной из причин формирования острой или хронической абдоминальной боли и диспепсического синдрома в послеоперационном периоде. Для купирования гипертонуса сфинктера Одди больные после удаления ЖП применяют лекарственные средства преимущественно двух групп: антихолинергические и миотропные спазмолитики. М-холиноблокаторы как антиспастические препараты не нашли широкого применения в связи с отсутствием селективности, что обусловливает многочисленные побочные эффекты (ухудшение зрения, сухость во рту, тахикардии, задержку мочи, слабость и др.). Поэтому в клинической практике в качестве антиспастических препаратов чаще применяют миотропные спазмолитики.
В идеале миотропный спазмолитик должен соответствовать следующим требованиям:
• обладать высокой эффективностью;
• оказывать длительное действие;
• выпускаться в форме, удобной для приема, в т. ч. и при амбулаторном лечении;
• не иметь серьезных побочных эффектов.
Одним из таких препаратов является мебеверин (Дюспаталин®). Механизм его действия основан на прямом блокирующем действии на натриевые каналы, что предотвращает приток натрия в клетку и останавливает последовательность событий, приводящих к мышечному спазму. Преимуществом
Дюспаталина перед другими спазмолитическими препаратами является не только купирование мышечного спазма, но и отсутствие развития гипотонии гладкой мускулатуры.
Дюспаталин® в гастроэнтерологической практике применяется с 1965 г. и хорошо себя зарекомендовал при синдроме раздраженного кишечника (СРК), т. к. наряду со спазмолитическим действием оказывает и прокинетический эффект. Несколько лет назад этот препарат стал применяться пациентами с ПХЭС. Было показано, что Дюспаталин® оказывает спазмолитический эффект при гипертонусе сфинктера Одди и купирует боли [25, 26].
В исследовании М.А. McNally и G.R. Locke было установлено, что у 17 % пациентов ПХЭС сочетается с СРК [27]. В 20–25 % случаев течение ПХЭС сопровождается дуоденогастральным рефлюксом. Дюспаталин®, обладающий спазмолитическими и прокинетическими свойствами, в этих случаях позволяет в определенной степени избавлять больного от таких диспепсических расстройств, как горечь во рту, вздутие и урчание в животе, спастические боли, а также опосредованно – через снижение моторики – уменьшать частоту стула. При этом чрезвычайно удобна пролонгированная
форма Дюспаталина, позволяющая принимать его всего дважды в сутки (по 1 капсуле 200 мг 2 раза в сутки за 30 минут до еды).
Следует отметить, что лечение пациентов с билиарной патологией в амбулаторных условиях имеет ряд особенностей:
• для профилактики рецидивов болей купирование их должно быть эффективным и продолжительным по времени, что позволяет избегать дополнительного применения лекарственных средств;
• терапия должна купировать не только абдоминальные боли, но и сопровождающие их диспепсические расстройства;
• терапия должна быть удобной в амбулаторном лечении (минимум лекарственных препаратов, желательно в таблетированной форме).
Дюспаталин® соответствует подобным требованиям, что обеспечивает более высокую приверженность больного указаниям врача и делает удобным прием препарата при амбулаторном лечении [28].
Как известно, постхолецистэктомические расстройства сохраняются длительно, что обосновывает необходимость продолжительных курсов терапии. Дюспаталин® хорошо переносится и не имеет серьезных побочных эффектов, поэтому он может применяться курсами по 1–3 месяца, при необходимости можно назначать повторные курсы. По нашим данным, переносимость Дюспаталина была оценена больными при амбулаторном лечении как отличная в 51 % случаев и как хорошая – в 46 %, что делает его препаратом выбора применения в амбулаторной практике [28].
В большинстве случаев консервативное лечение позволяет проводить коррекцию основных патофизиологических нарушений при ПХЭС, однако в различные сроки после холецистэктомии могут появляться показания и к оперативному лечению (холедохолитиаз, стриктуры холедоха, стенозирующий папиллит и др.).
Заключение
Исходя из тесной взаимосвязи билиарной системы с другими органами пищеварения, обусловливающей
вовлечение этих органов в патологический процесс, целесообразна более широкая трактовка понятия ПХЭС. Такой подход обосновывает необходимость тщательного обследования больных терапевтом и хирургом на дооперационном этапе с целью своевременного выявления патологии и проведения патогенетически обоснованного лечения. Возможность развития постхолецистэктомических расстройств предполагает более скоординированную деятельность терапевта и хирурга в ранней реабилитации больных в постоперационном периоде [11]. Преемственность в работе между хирургами и терапевтами поможет решать многие клинические вопросы, возникающие при лечении больных ПХЭС, улучшать качество их жизни.



