Введение
Синдром раздраженного кишечника (СРК) – функциональное (не связанное с органическим поражением кишечника) кишечное расстройство с началом проявлений не менее чем за 6 месяцев до диагностики, сопровождающееся наличием на протяжении не менее 3 последних месяцев абдоминальной боли или дискомфорта, ассоциирующихся с дефекацией или расстройствами дефекации. Распространенность СРК в большинстве стран мира колеблется в пределах 10–22 % [1–4], варьируясь в зависимости от социальных, экономических и культурных особенностей конкретного государства. Обращаемость по поводу СРК максимальна в США и странах Западной Европы. СРК значительно реже встречается у занятых физическим трудом сельских жителей, в рационе которых превалирует богатая клетчаткой растительная пища, по сравнению с городским населением. Пик заболеваемости приходится на молодой возраст (30–40 лет). Соотношение мужчин и женщин составляет примерно 1 : 2 [1, 2].
Диагностические критерии СРК определены III Римским консенсусом (2006) [5] и, как указано выше, имеют в своей основе субъективные симптомы абдоминальной боли или дискомфорта: рецидивирующая боль или дискомфорт 1 в животе не менее 3 дней в месяц (обычно не реже 2 дней в неделю) в последние 3 месяца за последние полгода, связанные с двумя или более из нижеперечисленных признаков: боль и дискомфорт ослабевают (проходят) после дефекации;появление боли и дискомфорта по времени совпало с изменением частоты стула; появление боли и дискомфорта по времени совпало с изменением формы (внешнего вида) стула.
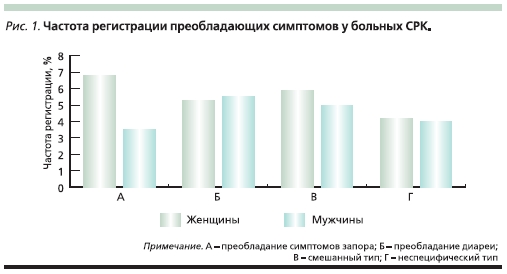
В зависимости от ведущего симптома III Римским консенсусом предложено выделять четыре клинических подтипа СРК: с запором (твердый или шероховатый стул в 2 % случаев и более); с диареей (кашицеобразный или водянистый стул в 25 % и более дефекаций); смешанный и неспецифический подтипы СРК, последний характеризуется недостаточно выраженными нарушениями консистенции стула для определения того или иного конкретного подтипа. Процентное соотношение больных СРК с преобладающими симптомами представлено на рис. 1.
Патогенетические механизмы СРК
На современном этапе сформировалось представление об СРК как о полиэтиологическом заболевании, в развитии которого играют роль психофизиологические феномены, особенности питания (непереносимость отдельных продуктов или пищевая аллергия), расстройства моторики, сенсорно-моторная дисфункция и перенесенные кишечные инфекции.
На сегодняшний день факторы патогенеза СРК окончательно не определены, но представляются в следующей последовательности [6]:
• гиперсенситивность;
• нарушение моторики;
• индивидуальные особенности организма;
• последствия воспаления;
• постинфекционный процесс;
• аллергия;
• неизвестный фактор.
Кроме того, обсуждается влияние микрофлоры толстого и тонкого кишечника [7], а также генетической предрасположенности [8].
Важную роль в возникновении нарушений гиперсенситивности и моторики у больных СРК играют психоэмоциональные факторы [9]. Отмечается четкая связь между возникновением первых симптомов и обострениями заболевания, а также психотравмирующими ситуациями. Считают, что СРК во многих случаях является своеобразной формой невроза, при которой ведущими клиническими симптомами становятся кишечные расстройства.
На заинтересованность центральной нервной системы (ЦНС) в патогенезе СРК указывают приведенные ниже факторы:
• при СРК, особенно при вариантах с ригидной абдоминальной болью, наблюдается ответ на лекарственные препараты центрального действия (антидепрессанты), а также психотерапевтические методы лечения (психотерапию, гипноз);
• симптомы отсутствуют во время сна, при минимальной активности ЦНС;
• частая встречаемость у пациентов с СРК других функциональных и психосоматических расстройств, в развитии которых участвует ЦНС.
Предполагается, что в условиях невроза нарушается деятельность центральной и вегетативной нервных систем, выражающаяся в нарушениях баланса катехоламинов, биогенных кининов, кишечных гормонов (мотилина), эндогенных опиоидов. Все это может приводить к дизрегуляции деятельности кишечника, главным образом его моторики (первичной дискинезии толстой кишки). Однако до сих пор не совсем ясна связь двигательных расстройств толстой кишки со стрессовыми реакциями. Следует сказать, что моторные нарушения при СРК не являются строго специфичными дискинетическими нарушениями для разбираемой патологии толстой кишки и могут наблюдаться вторично при большинстве органической патологии кишечника. Нарушения моторики, по-видимому, являются универсальной реакцией нервно-мышечного аппарата на воздействие тех или иных этиологических факторов, например перенесенную кишечную инфекцию, какие-либо компоненты пищи, недостаток пищевых волокон в рационе, гиподинамию, подавление естественных позывов на дефекацию.
Повышение сократительной активности мышечного слоя стенки кишечника (спастическая активность) является основной причиной возникновения болей в животе у пациентов с СРК. Она связана с висцеральной гиперчувствительностью рецепторного аппарата [10], которая проявляется снижением порога чувствительности рецепторного аппарата кишки, более интенсивным восприятием боли, болевым и/или моторным ответом на воздействие обычных, нечрезмерных импульсов (например, расширение кишки газом).
Считается, что причина сниженного порога чувствительности кроется главным образом в психоэмоциональных особенностях больного. Основанием для данного утверждения является то, что психика и функция желудочно-кишечного тракта (ЖКТ) тесно связаны между собой. Известно, что кора головного мозга может существенно активизировать или тормозить ряд процессов, а некоторые физиологические акты (мозговая фаза пищеварения, рефлекторная рвота, акт дефекации) выполняются при ее непосредственном участии. Интенсивность стимулов может быть увеличена или уменьшена на спинальном уровне в зависимости от активирующих или тормозящих влияний головного мозга. Подобное увеличение интенсивности стимулов часто наблюдается у больных СРК. Так, при раздражении давлением (баллонной пробе) или с помощью электростимуляции выявляется, что порог болезненного ощущения у больных СРК значительно снжен, а пациенты склонны давать ощущению более негативную эмоциональную окраску, чем здоровые обследуемые. Повышение чувствительности приводит к тому, что и физиологические процессы, в норме не ощущаемые человеком, при висцеральной гиперсенситивности становятся доступными для ощущений. В ряде случаев указанные ощущения носят выраженный болевой характер (аллодиния).
Установлено, что существует два вида висцеральной гиперчувствительности:
• снижение порога восприятия боли;
• более интенсивное восприятие боли при нормальном пороге восприятия.
Особенно ярко данная ситуация представляется при исследовании чувствительности прямой кишки у больных СРК (переносимости увеличения внутрипросветного давления при раздувании баллона). В отличие от пациентов с функциональным запором у больных СРК наблюдается значительное снижение порога дискомфорта или боли при внутриректальном повышении давления (рис. 2).
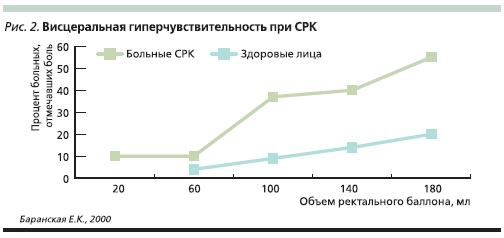
Обсуждаются и другие возможные причины формирования висцеральной гиперчувствительности, в частности перенесенная острая кишечная инфекция (шигеллез, сальмонеллез и др.), приблизительно у четверти пациентов впоследствии вызывающая появление симптомов СРК, что подтверждается и результатами мета-анализов [5, 6, 11–13]. Характерно, что в стенке кишки больных СРК, в непосредственной близости от нервных окончаний, обнаруживают увеличенное число тучных клеток, интраэпителиальных Т-лимфоцитов [14–17] и провоспалительных цитокинов, которые совместно с бактериальными антигенами влияют на рецепторный аппарат кишки и могут быть триггерами ее гиперчувствительности [5, 18–20]. Косвенно о влиянии микрофлоры на выраженность болевого и диспепсического синдромов у больных СРК говорят результаты положительного применения некоторых пробиотиков у данных больных [21, 22]. При СРК висцеральная гиперальгезия носит диффузный характер, специфична на 95 %, легко воспроизводима и в настоящее время используется как маркер
данной функциональной патологии кишечника, в т. ч. для оценки эффективности применения лекарственных препаратов.
Немаловажное значение в формировании гиперчувствительности, абдоминального болевого синдрома и расстройстве моторной функции кишки при СРК имеет обмен серотонина и норадреналина [23, 24]. Известно, что в структурах ЦНС находится большое количество серотонинергических и норадреналинергических рецепторов с соответствующими нисходящими проводящими путями, контролирующими болевые ощущения. Уменьшение уровня серотонина приводит к снижению порога болевых ощущений и усилению боли. Норадреналин опосредует увеличение активности противоболевых систем. Серотониновый механизм вносит свой вклад в восприятие боли нервными структурами кишечной стенки уже на уровне энтеральной, автономной нервной системы кишечника в норме и патологии. Так, активизация эндокриноцитов кишечника, вырабатывающих серотонин, происходит при повышении давления в просвете кишки или изменении качественного состава ее содержимого. При СРК плотность энтерохромаффинных клеток в слизистой оболочке кишечника обычно выше средних значений у здоровых, а повышенный синтез или нарушение обратного захвата серотонина может повлиять на появление симптомов СРК.
В конечном результате при СРК возникает дискинезия (гиперсегментарный гиперкинез, антиперистальтический гиперкинез или дискоординация тонического и пропульсивного компонентов моторики кишки, реже – дистонический гипо- или акинез или нарушение имеет смешанный характер). Дискинезия в данном случае является следствием несостоятельности регуляторных взаимоотношений между ЦНС, вегетативной нервной системой, нейроэндокринным аппаратом и ЖКТ [25, 26].
Дисмоторика может давать тот или иной висцеральный болевой синдром (спастический или атонический за счет перерастяжения органа повышенным внутрипросветным давлением), а также приводить к появлению других симптомов (запору, диарее, метеоризму и их сочетанию, чередованию в различных комбинациях), что и имеет место при различных классификационных формах СРК.
Указанные диспепсические явления в свою очередь могут вызывать или усугублять болевой синдром при СРК, а также другой функциональной патологии ЖКТ, например при дисфункции желчного пузыря и сфинктерного аппарата желчевыводящих путей. С другой стороны, обнаружено, что при СРК имеет место патологическая чувствительность желчного пузыря к холецистокинину, что подчеркивает генерализованный характер патологии ЖКТ при данном страдании.
Следует также учитывать, что у 2 % пациентов болевой синдром при функциональной патологии ЖКТ не связан с моторными или другими нарушениями функций органов ЖКТ и выделяется в отдельную категорию [27].
Клиническая симптоматика СРК
Клинический вариант СРК (см. выше) определяет диагностическую и лечебную тактику, однако для СРК характерны многообразие, мозаичность и изменчивость жалоб. Диарейный синдром у пациентов с СРК имеет свои особенности. Диарея отсутствует в ночное время и часто возникает утром – после завтрака. Позывы на дефекацию часто носят императивный характер (“синдром утреннего натиска”), возникают три-четыре раза в течение короткого периода времени. Причем при первом утреннем акте дефекации стул нередко бывает оформленным, а затем сменяется на кашицеобразный или жидкий, но полифекалии не наблюдается. Диарейный синдром может сопровождаться болями спастического характера, локализованными, главным образом в области сигмовидной кишки.
Запоры при СРК чаще носят постоянный характер, но могут возникать и периодически, а также чередоваться с диареей. Из-за нарушения двигательной активности сигмовидной кишки стул может приобретать форму “ленты”, “карандаша” или комков. Пациентов с СРК также беспокоят
необходимость натуживания и ощущение неполного опорожнения кишечника. Для данной формы СРК характерно и наличие висцерального спастического болевого абдоминального синдрома, в основном связанного с гиперсегментирующими сокращениями сигмовидной кишки. При смешанном и неспецифическом подтипах СРК отмечается сочетание различных симптомов, чередование запоров и поносов, явлений метеоризма и болевого синдрома и/или дискомфорта.
Объективная симптоматика при СРК достаточно скудная. Визуально может определяться умеренное вздутие живота, при пальпации можно выявить спазм различных отделов кишечника (чаще сигмовидной кишки). Рентгенологические, эндоскопические и гистологические изменения невыраженные и непостоянные. Патологи говорят: “Часто трудно решить, является ли экземпляр биопсии при СРК образцом верхней границы нормы или нижним пределом патологии, и во многих отношениях – это субъективная оценка” [28].
У пациентов с СРК можно выявить множество внекишечных симптомов вегетативной природы. К ним относятся частые приступы мигрени, ощущение кома в горле при глотании или нехватки воздуха, дискомфорт в обла-сти сердца, вазоспастические реакции. В 25 % случаев СРК сочетается с синдромом функциональной диспепсии, в 30 % – синдромом раздраженного мочевого пузыря.
Все вышеперечисленное приводит к тому, что у пациентов с СРК значительно страдает качество жизни, фиксируемое многочисленными исследованиями [29].
Диагностика СРК
Диагноз СРК требует в первую очередь исключения органических заболеваний. В связи с этим диагностический поиск включает несколько последовательных этапов. Сначала производят оценку жалоб больного и определение клинического варианта заболевания. Следующим этапом является исключение органической патологии на основании клинического и биохимического анализов крови, анализа кала на скрытую кровь, наличие бактерий кишечной группы и яйца паразитов, проведения эзофагогастродуоденоскопии, сигмо- или колоноскопии. Необходимо также выполнять обзорную рентгенографию органов брюшной полости, ультразвуковое исследование органов брюшной полости и малого таза у женщин.
Существует ряд симптомов (симптомов тревоги), исключающих наличие СРК. К ним относятся манифестация заболевания в пожилом возрасте, лихорадка, примесь крови в кале, возникновение кишечных расстройств в ночное время, немотивированная потеря веса, прогрессирование заболевания, наличие анемии, лейкоцитоза, увеличения СОЭ, стеатореи и полифекалии. После исключения органического заболевания проводят первичный курс лечения СРК продолжительностью не менее 3 недель. При неэффективности лечения необходимо расширение диагностических мероприятий для пересмотра диагноза.
Дифференциальный диагноз СРК следует проводить с многочисленными заболеваниями и состояниями, такими как реакции на кофеин, алкоголь, пищевые продукты, лекарственные средства, воспалительные заболевания кишечника, инфекционные и паразитарные поражения, рак, дивертикулярная болезнь, полипоз толстой кишки, синдром избыточного бактериального роста в тонкой кишке, эндокринные заболевания, синдром мальабсорбции, нейроэндокринные опухоли, гинекологические заболевания.
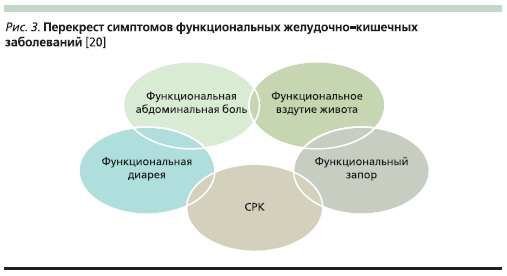
Следует также иметь в виду, что со многими функциональными заболеваниями кишечника СРК имеет сходные симптомы (“перекрест” симптомов, рис. 3) [20]. В целом диагноз СРК не является легким и всегда должен бази-роваться на критериях, закрепленных III Римским консенсусом.
Лечение СРК
Лечение СРК включает налаживание доверительного контакта с пациентом, рекомендации по питанию, назначение лекарственных средств и применение (при необходимости) различных методов психотерапии.
Рекомендации по питанию дают с четом преобладающих клинических симптомов. При склонности к диарее ограничивают поступление с пищей грубых пищевых волокон, исключают из рациона фруктозу, кофе, алкоголь и газированные напитки. При метеоризме рекомендуется избегать употребления продуктов, повышающих газообразование в кишечнике (молока, капусты, бобовых). При запорах назначают диету с высоким содержанием пищевых волокон (пищевые отруби по 1 столовой ложке 2–3 раза в сутки в кефире, йогурте, соке), однако многие пациенты жалуются на усиление болевых ощущений и выраженный метеоризм при включении в рацион отрубей. Если снижение дозы не дает эффекта, препараты, содержащие пищевые волокна, отменяют.
Лекарственную терапию также назначают с учетом клиники СРК. Для купирования болевого синдрома независимо от его подтипа наиболее эффективны лекарственные средства, обладающие спазмолитической активностью (пинаверия бромид, мебеверин, дротаверин, папаверин, гиосцина бутилбромид и др.), т. к. они воздействуют на главный, конечный, механизм возникновения боли при СРК – спазм гладкой мускулатуры, и их успех в случае правильности диагноза практически гарантирован.
Многочисленные исследования, данные мета-анализов показали высокую и достоверную по сравнению с плацебо эффективность спазмолитиков при СРК [30–32]. В настоящее время в клинической практике препаратами выбора для лечения боли при СРК всех подтипов являются миотропные спазмолитики, селективно действующие на гладкую мускулатуру кишечника, лишенные побочных эффектов холинолитиков и системного вазоактивного действия неселективных спазмолитиков (папаверина, дротаверина). Перечисленные побочные эффекты холинолитиков и неселективных спазмолитиков не дают возможности длительно применять адекватные дозы препаратов, что снижает эффективность их применения при СРК. Сфера применения неселективных спазмолитиков и холинолитических препаратов – купирование острых состояний, сопровождающихся спазмом гладкой мускулатуры (желчной, почечной колик, острого панкреатита и пр.).
К селективным миотропным спазмолитикам относятся: пинаверия бромид (Дицетел), отилония бромид (Спазмомен), являющиеся селективными блокаторами кальциевых каналов мускулатуры органов пищеварения, и мебеверин (Дюспаталин), селективный блокатор натриевых каналов гладких мышц ЖКТ.
Среди селективных миотропных спазмолитиков при СРК очевидным преимуществом за счет быстроты купирования боли обладает Дицетел. Высокая антиангинальная эффективность при СРК этого миотропного спазмолитика со свойствами блокатора кальциевых каналов объясняется тем, что развитие мышечного спазма напрямую зависит от внутриклеточной концентрации ионов кальция. Ионы кальция поступают в гладкую мышечную клетку кишки через кальциевые каналы, располагающиеся на клеточной мембране миоцита. Блокировка указанных каналов приводит к сни-
жению внутриклеточной концентрации кальция и купированию мышечного спазма. Кроме того, у препарата Дицетел имеется и второй механизм купирования боли за счет уменьшения висцеральной гиперчувствительности, приводящий к спазмофилии. Снижение чувствительности слизистой оболочки на фоне приема Дицетела связано с тем, что препарат, как и кальциевые каналы миоцитов, блокирует и кальциевые каналы рецепторов, расположенных в слизистой оболочке. Об эффективности применения Дицетела у больных СРК всех субтипов свидетельствует масса исследований как в нашей стране, так и за рубежом. В частности, большинство исследователей фиксируют частоту хороших и очень хороших результатов по полному купированию и уменьшению интенсивности боли при СРК на фоне приема Дицетела в качестве монотерапии в стандартной дозировке на уровне 60–64 %. Причем у части больных СРК с запором (преимущественно пациентов с легким и умеренно выраженным болевым синдромом) на фоне приема Дицетела и купирования боли появлялся самостоятельный стул. Наблюдается и уменьшение времени кишечного транзита, в основном за счет ускорения скорости транзита по дистальным отделам кишечника. В случаях с ригидным запором Дицетел дает хороший эффект в составе комбинированной терапии с препаратами лактулозы или макрогола. Так, сочетание Дицетела с макроголом 4000 приводит к нормализации стула и снятию болевого синдрома в течение 2–5 суток от начала лечения. Механизм действия этих препаратов заключается в увеличении объема кишечного содержимого, что приводит к усилению перистальтики. Следует помнить, что применение осмотических слабительных, равно как и пищевых отрубей, всегда требует введения адекватного количества жидкости (не менее 1,5–2,0 л в сутки). Лактулозу назначают по 20–60 мл/сут внутрь, макрогол 4000 по 10–20 г/сут. Стимулирующие слабительные не показаны, т. к. за счет раздражающего действия могут вызывать усиление симптомов заболевания.
При СРК с диареей и болевым синдромом применение Дицетела дает хороший эффект в случае его комбинации с лоперамидом, обволакивающими препаратами, сорбентами – диосмектитом (Смектой, Неосмектином), бифидобактериями бифидум (Пробифором) и пробиотиками. Для уменьшения выраженности метеоризма наиболее эффективно и применение препаратов, содержащих симетикон или диметикон (Эспумизан по 2 капсулы 3 раза в сутки). Следует отметить, что Дицетел несколько снижает секрецию соляной кислоты главными железами желудка, не влияя на объем желудочной секреции, и одновременно ускоряет моторно-эвакуаторную функцию ЖКТ. В связи с этим его с успехом можно назначать пациентам и с функциональной патологией верхних отделов ЖКТ, в первую очередь с сопутствующими СРК явлениями функциональной диспепсии, что бывает нередко. Причем положительный эффект можно прогнозировать как у больных функциональной диспепсией с эпигастральной болью, так и при постпрандиальном дискомфорте. Это особенно важно для пациентов, т. к. уменьшает число принимаемых препаратов, что улучшает показатели приверженности назначаемому лечению. Дицетел в основном действует на уровне толстой кишки, в меньшей степени (5–10 % от эффекта на толстую кишку) влияет на двенадцатиперстную кишку, а также билиарный тракт и имеет опосредованные эффекты, связанные с уменьшением внутрипросветного давления, что облегчает пассаж желчи. Это косвенно влияет на моторную активность кишечника, стимулируя ее при запорах функционального характера, в т. ч. и при СРК с явлениями запора.
Дицетел в остром периоде (3–6 дней) назначают по 100 мг 3–4 раза в сутки во время еды. После стихания обострения поддерживающей дозировкой препарата является стандартная доза 50 мг 3–4 раза в сутки, назначаемая на курс от 2 до 6 недель и более. Действуя на кишечник селективно, Дицетел не имеет побочных антихолинергических эффектов, поэтому его можно без опасений назначать пациентам с глаукомой и гипертрофией предстательной железы.
При СРК с явлениями запора, гипермоторной дискинезии любого генеза, спастических явлениях, хроническом запоре в сочетании с дисфункцией сфинктера Одди, дисфункцией желчного пузыря по гиперкинетическо-гипертоническому типу особо пока-зано применение селективного миотропного спазмолитика мебеверина (Дюспаталин). Селективно релаксирующий гладкую мускулатуру органов ЖКТ препарат Дюспаталин безусловно является препаратом, которому следует отдавать предпочтение при патогенетической терапии пациентов с заболеваниями кишечника и патологией билиарного тракта. Достоинством Дюспаталина (мебеверина) является релаксирующая селективность в отношении сфинктера Одди, в 20–40 раз превышающая эффект от папаверина. При этом Дюспаталин обладает нормализующим влиянием на мускулатуру кишечника, устраняя функциональный дуоденостаз, гиперперистальтику, спазмофилию, при этом он не вызывает нежелательной гипотонии.
Таким образом, Дюспаталин является не только препаратом патогенетического действия при патологии кишечника и билиарного тракта, но и средством, поддерживающим саногенез, нормализирующим нарушенные функциональные механизмы. Данный эффект Дюспаталина возможен благодаря двойному механизму действия препарата: снижению проницаемости клеток гладкой мускулатуры для Na+, вызывающему антиспастический эффект, и предотвращению развития гипотонии за счет уменьшения оттока К+ из клетки. Кроме того, Дюспаталин не действует на холинергическую систему, в результате чего не возникают соответствующие побочные эффекты. Эффект от применения Дюспаталина возникает быстро (через 20–30 минут) и продолжается в пределах 12 часов, что делает возможным его двукратный прием в сутки (пролонгированная форма). Выпускается Дюспаталин в капсулах, содержащих 200 мг мебеверина гидрохлорида в виде микросфер, покрытых кислотоустойчивой оболочкой.
Дюспаталин активно метаболизируется при прохождении через печень, и все метаболиты быстро выводятся с мочой, а полная его экстракция происходит в течение 24 часов после приема однократной дозы. В результате Дюспаталин не накапливается в организме, поэтому даже для пожилых пациентов не требуется коррекции доз и препарат можно применять длительно, что особенно важно для пациентов с хроническим запором, дисфункцией сфинктера Одди после перенесенной холецистэктомии.
В целом препарат Дюспаталин обладает следующими преимуществами:
• статистически достоверно уменьшает абдоминальную боль, метеоризм, запор и диарейный синдром;
• устраняет спазм и не вызывает атонии кишечника;
• избирательно действует на кишечник и билиарный тракт;
• имеет современную лекарственную форму – кислотоустойчивые капсулы, позволяющие постепенно высвобождаться действующему началу препарата;
• при приеме Дюспаталина отсутствуют системные эффекты: вся вводимая доза полностью метаболизируется при прохождении через стенку кишечника и печень до неактивных метаболитов, в результате чего мебеверин не обнаруживается в плазме крови и поэтому не вызывает таких системных побочных эффектов, как сухость во рту, нарушение зрения, тахикардия, задержка мочи, запор и слабость;
• имеет большой клинический опыт применения: в мире ежегодно препарат назначают 6,5 млн пациентов.
Дюспаталин назначают по 1 капсуле (200 мг) 2 раза в сутки. Его лучше принимать за 20 минут до еды. Оптимальным сроком применения Дюспаталина считается двухнедельный курс, однако и после месячного курса терапии больных СРК с явлениями запора, дискинезиями желчевыводящих путей, в т. ч. и пациентов с гипокинезом желчного пузыря, бескаменным холециститом, мы не обнаружили развития явлений гипотонии кишечника.
Эффективной у пациентов с СРК с явлениями запора является комбинация лактулозы (Дюфалака) по 30 мл/сут однократно и мебеверина (Дюспаталина) по 200 мг 2 раза в сутки в течение месяца, приводящая в 93,3 % случаев к уменьшению клинической симптоматики, исчезновению боли, нормализации стула, исчезновению или уменьшению необходимости в сильных потугах при акте дефекации [33]. Примечательно, что у трети пациентов с СРК с явлениями запора применение монотерапии препаратом Дюспаталин также приводит к нормализации стула и уменьшению интенсивности натуживания при опорожнении кишечника.
Эффективно применение Дюспаталина и при спастических явлениях, сопровождающихся запором у детей. Препарат в капсулированной форме назначают детям старшего возраста (с 12 лет) в тех же дозировках, что и взрослым (по 200 мг 2 раза в сутки за 20 минут до еды на срок до двух недель). В Европе Дюспаталин выпускается и в виде суспензии, назначаемой детям с 3-летнего возраста в суточной дозе 7,5 мл. В возрасте 4–8 лет Дюспаталин применяется в суточной дозе 15 мл, в возрасте 9–10 лет – 30 мл, у детей старше 10 лет – 45 мл [34].
В целом применение мебеверина у больных СРК приводит к достоверной коррекции основных клинических проявлений заболевания, в первую очередь болевого синдрома, что достоверно коррелирует с улучшением основных показателей качества жизни этих больных [29]. При выявлении симптомов тревожной депрессии у больных СРК используют амитриптилин в комбинации с феназепамом. Рекомендуемая первоначальная доза амитриптилина – четверть таблетки перед сном. Суточную дозу амитриптилина увеличивают постепенно, каждые 5 дней на четверть таблетки
до устранения симптомов тревожной депрессии. Через 2 недели начинают постепенное снижение доз препаратов. При неэффективности трициклических антидепрессантов, ригидности болевого синдрома показано применение ингибиторов обратного захвата серотонина и норадреналина. Следует отметить, что коррекцию психоэмоциональной сферы целесообразно проводить совместно с клиническим психологом или психоневрологом. После проведения начальной терапии через некоторое время необхо-димо проконтролировать состояние пациента, в т. ч. чтобы убедиться, что при первичном обследовании не было пропущено заболевание органической природы. Необходимо также убедиться в том, что проводимое лечение обеспечивает адекватное качество жизни, а пациент способен ограничивать воздействие стрессовых факторов на свою психику.
В целом лечение СРК эффективно у 30 % пациентов, а применение спазмолитиков – более чем у 50 % больных, что зафиксировано на последнем Пан-Европейском совещании по проблеме СРК в Вене в декабре 2010 г. Указанная высокая эффективность спазмолитиков при купировании абдоминальной боли регистрируется во многих регионах мира [10].
В плане прогноза следует сказать, что СРК, как правило, не прогрессирует. Худшие показатели качества жизни имеют женщины и лица пожилого возраста с длительным анамнезом заболевания, при этом риск развития органических поражений ЖКТ, в т. ч. колоректального рака, равен общему риску в популяции.



