Хронический панкреатит (ХП) – это длительное воспалительное заболевание поджелудочной железы (ПЖ), проявляющееся необратимыми морфологическими изменениями, которые вызывают боль и/или стойкое снижение функции органа. При ХП морфологические изменения ПЖ сохраняются после прекращения воздействия этиологического агента.
В развитых странах заболеваемость ХП составляет 5–10 случаев на 100 тыс. населения, в мире в целом она колеблется от 1,6 до 23,0 на 100 тыс. Средний возраст на момент установления диагноза составляет 35–55 лет. За последние 40 лет наблюдается примерно двукратный прирост заболеваемости, что связывают с возрастающим потреблением алкоголя и действием агрессивных факторов окружающей среды. Соотношение больных мужского и женского пола значительно варьируется в различных исследованиях, однако в большинстве наблюдений преобладают мужчины: от 3/1 до 5/1.
В патогенезе ХП играют роль несколько факторов. Вероятно, наиболее полное представление о причинах и факторах риска развития ХП дает классификация TIGAR-O, выделяющая в качестве основных этиологических вариантов заболевания токсико-метаболический (T), идиопатический (I), наследственный (G), аутоиммунный (A), связанный с рецидивирующим тяжелым острым панкреатитом (R), а также обструктивный (O). Эта классификация, название которой состоит из первых букв
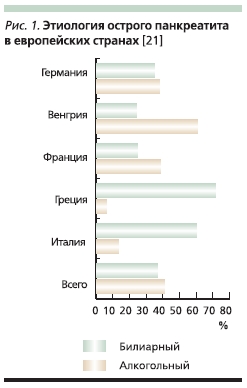
английских названий вариантов ХП, была предложена известным исследователем наследственного панкреатита D.C. Whitcomb в соавторстве с B. Etemad в 2001 г. Следует отметит, что с точки зрения эпидемиологии существенных изменений в причинах панкреатита за последние полвека не произошло: по-прежнему наиболее частыми вариантами являются токсический (прежде всего алкогольный) и обструктивный (рис. 1). При злоупотреблении алкоголем происходит повышение содержания белка в панкреатическом секрете, что приводит к возникновению белковых пробок и
обструкции мелких протоков ПЖ.
Обструкция главного панкреатического протока конкрементами чаще всего вызывает развитие острого панкреатита. Одной из теорий, объясняющих формирование обструктивного панкреатита, является теория общего канала, сформулированная Opie еще в 1901 г. По этой теории наличие обшей
ампулы, в которой происходит слияние общего желчного и панкреатического протоков, приводит к забрасыванию желчи в проток ПЖ. При этом повышается давление в панкреатическом протоке и запускается внутрипротоковая активация панкреатических ферментов. Из макрофагов выделяются
лизосомальные ферменты, которые подобно энтерокиназе тонкой кишки активируют трипсиноген и переводят его в трипсин, давая начало процессу аутоактивации ферментов и аутолизу железы.
К причинам обструктивного ХПотносят:
• дисфункцию сфинктера Одди (СО; стеноз или дискинезия), в т. ч. при желчно-каменной болезни (т. н. билиарный панкреатит);
• врожденные анатомические аномалии ПЖ (pancreas divisum и др.);
• обструкцию панкреатического протока (например, опухолью Фатерова соска или самой ПЖ);
• периампулярные кисты двенадцатиперстной кишки;
• посттравматические рубцы панкреатических протоков.
Длительное нарушение оттока секрета ПЖ у больных желчекаменной болезнью или кальцифицирующим панкреатитом, при воспалительном стенозе, опухолях, дискинезии СО вызывает внутрипротоковую гипертензию, рефлюкс дуоденального содержимого и внутрипротоковую активацию панкреатических ферментов.
Одновременно необходимо помнить, что обструкция при желчекаменной болезни обычно бывает острой, вызывая отдельный изолированный эпизод боли на фоне относительного благополучия или развернутую клиническую картину острого панкреатита. Понимание того, что хроническая боль лишь в отдельных случаях может быть связанной с обструктивным механизмом, приводит к постепенному снижению доли обструктивной, прежде всего билиарной, этиологии в спектре причин ХП в ведущих странах мира. В Китае, как и в СССР, и в России, имелась тенденция к гипердиагностике билиарного ХП, однако прогресс в диагностике существенно снизил его долю среди прочих причин (табл. 1).
![Этиологический спектр ХП в КНР в 1990–2010 гг. [22]](https://lib.medvestnik.ru/apps/lib/assets/uploads/pharmateca/2012/11/pharm-11-2012-pic-3.jpg)
Для верификации обструкции, которая может стать причиной панкреатита, существует, по сути, лишь один прямой метод – измерение давления в ампуле Фатерова соска на уровне сфинктера с помощью катетера, который устанавливают эндоскопическим методом.
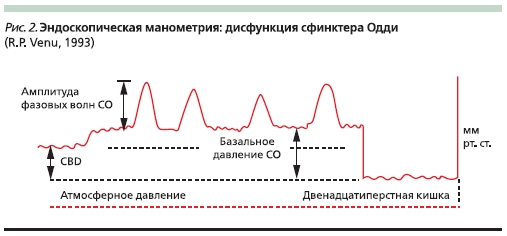
По данным манометрии признаками дисфункции СО являются (рис. 2):
• базальное давление > 40 мм рт. ст.;
• увеличение амплитуды и частоты фазовых сокращений (тахиоддия);
• увеличение частоты ретроградных сокращений;
• парадоксальный ответ на введение холецистокинина и его аналогов.
Различия стеноза и дисфункции СО представлены в табл. 2.

Выделяют следующие типы дисфункции СО (его панкреатической части):
• I тип (определенный) клинически проявляется идиопатическим рецидивирующим панкреатитом и/
или типичными панкреатическими болями в сочетании с повышением активности амилазы/липазы крови ≥ 2 раз, расширением вирсунгова протока более 5 мм, увеличением времени поступления секрета по протоку в просвет двенадцатиперстной кишки более 10 минут.
• II тип (предположительный) устанавливают, если у пациента есть типичные панкреатические боли +
1 или 2 критерия типа I.
• III тип (возможный, или вирсунго-дискинезия) устанавливается, если в клинической картине присутствуют только типичные панкреатические боли, но нет ни одного из признаков типа I.
Тип I соответствует структурным нарушениям (стенозу) и требует решения вопроса о проведении эндоскопического хирургического вмешательства; II тип может означать как структурные, так и лишь функциональные нарушения; III (дискинезия) – означает, что у пациента имеются только функциональные нарушения.
К сожалению, исследование давления в Фатеровом соске – надежный, но не лишенный недостатков метод. Он сложен в выполнении – даже в крупных специализированных центрах редко есть технические возможности и еще реже специалисты, способные выполнить это исследование. Однако
основная проблема заключается в том, что даже правильно выполненная манипуляция очень часто заканчивается обострением или возникновением панкреатита. Поэтому в настоящее время манометрия СО не расценивается как метод, пригодный к использованию в повседневной клинической практике. Если у пациента есть билиарная или панкреатическая боль, в основном следует ориентироваться на состояние ОЖП и вирсунгова протока – если они расширены, у пациента есть признаки холестаза, повышения активности панкреатических ферментов в крови и моче, его следует
направить к эндоскопическому хирургу. Если таких изменений нет, как и убедительных причин для поражения ПЖ, пациента следует расценивать как имеющего только спазм, т. е. функциональное расстройство.
Одним из наиболее важных симптомов ХП является боль. У большинства пациентов боль – это первый симптом заболевания (60–100 % по разным данным), который остается основной проблемой на протяжении всей жизни. Типичный приступ ХП проявляется болями в верхней половине живота после приема пищи, иррадиирущими в спину, которые могут продолжаться в течение многих часов или нескольких суток. Нередко наблюдается тошнота, рвота. Поскольку боль связана с приемом пищи, многие пациенты вынуждены резко сокращать ее количество вплоть до полного голодания, у 30–52 % пациентов обострение заболевания сопровождается похуданием. В то же время отсутствует зависимость интенсивности жалоб пациента, прежде всего на боль, и структурных изменений ПЖ: нередко очень интенсивные боли не сопровождаются скольлибо существенными отклонениями при инструментальных исследованиях, а грубые изменения ПЖ, особенно при алкогольном кальцифицирующем панкреатите, могут не проявляться клинически.
При длительном течении заболевания, уменьшении объема функционирующей паренхимы ПЖ до 5–10 % от нормы у пациентов возникают признаки панкреатической мальдигестии и мальабсорбции (полифекалия, жирный стул, прогрессирующее похудание). Интенсивная боль в животе, поносы, прогрессирующее снижение массы тела вызывают существенное снижение качества жизни, особенно
молодых больных.
Несмотря на обилие и разнообразие симптомов ХП, именно боль находится в центре внимания и пациента, и врача, существенно снижая качество жизни больного, требуя повторных, часто безрезультатных, госпитализаций в различные клиники. Согласно классификации Amman и Muellhaupt
(1999), можно выделить два основных варианта боли при алкогольном ХП [3]. Тип А (характерен для билиарной этиологии) напоминает острый рецидивирующий панкреатит: наблюдаются короткие обострения продолжительностью не более 10 дней с безболевыми промежутками от нескольких месяцев до года. Высокая интенсивность боли у таких пациентов всегда требует госпитализации в период обострений. Для типа Б (обычно наблюдается среди пациентов, злоупотребляющих алкоголем) характерна постоянная боль или непрерывно-рецидивирующее течение заболевания, нередко возникают местные осложнения: псевдокисты, холестаз, панкреатическая внутрипротоковая гипертензия. Пациенты испытывают боль по меньшей мере 2 дня в неделю в течение 2 месяцев и часто настаивают на проведении хирургических вмешательств для купирования
боли.
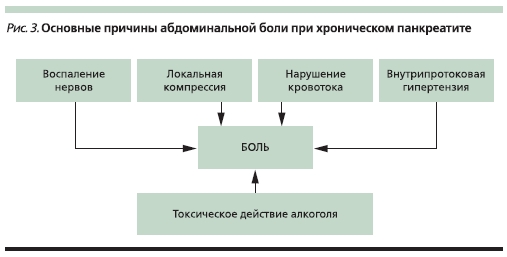
Возникновение интенсивной боли в животе при ХП связывают с сочетанным действием различных механизмов (рис. 3). Наиболее важным из них многие считают развитие внутрипротоковой гипертензии как результат формирования белковых пробок, конкрементов или стриктур, вследствие чего повышается давление в паренхиме ПЖ, что приводит к нарушению перфузии по капиллярам [13]. Эта точка зрения подтверждается результатами исследований, при которых во время различных хирургических вмешательств (в т. ч. эндоскопических) было обнаружено высокое давление в протоках. Однако результаты недавнего исследования [12] показывают, что не существует какой-либо связи между обструкцией общего желчного протока и интенсивностью боли у пациентов с ХП, равно как и успешное эндоскопическое дренирование желчных протоков не оказывает какого-либо влияния на характер боли. Другой причиной боли считают прямое действие алкоголя на нервные окончания в ткани ПЖ.
Повреждение ПЖ и интенсивная боль могут быть связаны с нарушением баланса между образованием и утилизацией активных форм кислорода. Согласно этой теории, под действием алкоголя, курения и других токсичных факторов происходит высвобождение массы свободных радикалов кислорода, способных инициировать аутолиз ПЖ [14]. Строгое ограничение диеты при тяжелом панкреатите может приводить к дефициту микроэлементов, обладающих антиоксидантными свойствами (витамин E, рибофлавин, холин, магний, марганец, медь) [15].
Боль при панкреатите может также быть вызвана повреждением нервных окончаний в ПЖ. При ХП обнаружена инфильтрация ткани преимущественно эозинофилами, которые могут выделять медиаторы боли. Были выявлены увеличение толщины нервов, их инвазия воспалительными клетками,
а также лимфоцитарная инфильтрация. Все это может свидетельствовать о наличии т. н. панкреатического неврита. Интересно, что была обнаружена взаимосвязь между экспрессией белка
GAP-43 (growth-associated protein 43), степенью инфильтрации воспалительными клетками и интенсивностью боли [16]. Кроме того, показана зависимость между концентрациями фактора роста нервов и рецептора к тирозинкиназе А (TrkA) и интенсивностью боли [17]. Обнаружена зависимость
между экспрессией нейротрофического фактора головного мозга (BDNF, brain-derived neurotrophic factor) и интенсивностью, а также частотой приступов боли.
Повреждение нервных рецепторов и волокон само по себе может способствовать появлению длительной боли, которая не купируется назначением препаратов, влияющих на состояние ПЖ или желудочно-кишечного тракта. Интенсивная ноцицептивная афферентация вызывает повышение
чувствительности центральной нервной системы к болевым импульсам, активирует нисходящую стимуляцию задних рогов спинного мозга. Таким образом, функционирование ноцицептивной системы может быть нарушено на всех уровнях и болевые импульсы могут автономно циркулировать между
различными отделами нервной системы. Показано, что при ХП у больных формируется устойчивое состояние генерализованной гиперальгезии [19]. Недостаточная эффективность процедур денервации ПЖ у многих больных также косвенно подтверждает тот факт, что центральная гиперальгезия при ХП становится не зависимой от периферических стимулов [20].
Разрушение экзокринной части ПЖ вызывает прогрессирующее снижение секреции бикарбонатов и ферментов, однако клинические проявления нарушения переваривания пищи развиваются лишь при деструкции более 90 % паренхимы органа. В первую очередь возникают проявления недостаточности липазы: нарушение всасывания жиров, жирорастворимых витаминов.
Терапия панкреатита проводится по нескольким направлениям: предотвращение дальнейшего повреждения ПЖ (отказ от употребления алкоголя – это достоверно повышает выживаемость больных с тяжелым панкреатитом; соблюдение диеты); купирование боли; заместительная терапия при
экзокринной и эндокринной недостаточности.
При билиарном обструктивном панкреатите, если у больного выявляют признаки стеноза Фатерова соска – панкреатической или билиарной гипертензии, должна быть проведена своевременная эндоскопическая декомпрессия. Больному выполняют папиллосфинктеротомию, дилатацию или стентирование протоков. Если у пациента есть признаки спазма СО, назначают спазмолитические препараты.
Для купирования приступа боли, связанной со спазмом СО, – билиарной или панкреатической колики,
широкое распространение получили М-холинолитики (атропин, платифиллин, препараты красавки и др.), которые блокируют мускариновые рецепторы клеточной мембраны, в результате снижается внутриклеточная концентрация кальция, что приводит к быстрому расслаблению мышечной клетки. Наступающий эффект непродолжителен, поэтому такие препараты не пригодны для курсового применения или поддерживающей терапии. Существенным недостатком при применении антихолинэргических препаратов являются и известные побочные эффекты – тахикардия, запоры, повышение внутриглазного давления, нарушение зрения, задержка мочеиспускания, сухость во рту, сонливость и др.
К сожалению, и у многих других средств, действующих на СО, существуют серьезные побочные эффекты, существенно ограничивающие их применение: миотропные спазмолитики (дротаверин, бенциклан, альверина цитрат и др.) действуют неселективно, могут усиливать дуоденостаз, имеют
существенные различия в эффективности лечения дисфункции СО у разных больных; нитраты – дают выраженные кардиоваскулярные эффекты, развитие привыкания; у неселективных блокаторов кальциевых каналов (верапамил, нифедипин, дилтиазем) – выраженные кардиоваскулярные эффекты.
Поэтому препаратом выбора восстановления проходимости СО и нормализации оттока панкреатического сока и желчи является селективный спазмолитик мебеверин (Дюспаталин).
Особенностью мебеверина является его двойное действие. С одной стороны, он блокирует быстрые Na+-каналы, препятствуя деполяризации мембраны мышечной клетки и развитию спазма, при этом нарушая передачу импульса от холинергических рецепторов. С другой стороны, мебеверин блокирует наполнение Сa2+-депо, истощая их и тем самым ограничивая выход К+ из клетки, что препятствует развитию гипотонии сфинктера, что могло бы создавать риск прогрессирования панкреатита. За счет этого также существенно снижается вероятность развития побочных эффектов и со стороны желудочно-кишечного тракта, прежде всего – гипотонии двенадцатиперстной кишки, еще одного механизма поражения ПЖ.
Применение мебеверина эффективно для больных с постхолецистэктомическим синдромом [24]: в течение первой недели лечения интенсивность болей в правом подреберье снизилась у 13 (65 %), а через 14 дней боли полностью исчезли у 8 (40 %), значительно уменьшились по интенсивности и продолжительности у 10 (50 %). По данным ультразвукового исследования (УЗИ), у 5 из 11 пациентов с постхолецистэктомическим синдромом, исходно имевших расширенный от 9 до 14 мм общий желчный проток, через 2 недели лечения Дюспаталином зарегистрированы нормальные показатели ширины общего желчного протока, а у 4 пациентов наметилась тенденция к уменьшению его просвета. Важно отметить, что на фоне применения мебеверина, который является спазмолитиком, не только не усиливался, но в 70 % случаев исчезал выявленный дуоденогастральный рефлюкс. Таким образом, мебеверин обладает модулирующим действием на сфинктеры органов пищеварения, при котором
возможно не только снятие спазма, но и предотвращение избыточной релаксации. Побочных эффектов при применении Дюспаталина не отмечено ни у одного пациента.
Особенностью Дюспаталина является форма выпуска в виде микрогранул, покрытых рН-чувствительной оболочкой; сами микрогранулы при этом заключены в капсулу. Таким образом достигается пролонгированность действия препарата во времени и на протяжении всего желудочно-кишечного
тракта. Постепенно высвобождающийся из гранул препарат обеспечивает равномерное действие в течение 12–13 часов.
Для поддерживающей терапии его используют в стандартной дозе: по 200 мг за 20 минут до еды 2 раза в сутки курсами по 1–3 месяца; в периоды обострения дозу удваивают.
Пациентам с дисфункцией СО необходимо назначать антацидные препараты, нередко – и антисекреторные средства: ингибиторы протонной помпы, Н2-блокаторы. При наличии желчного сладжа и/или мелких холестериновых камней в желчном пузыре нередко встает вопрос о назначении препаратов урсодеоксихолевой кислоты. Эти препараты безусловно эффективны как литолитическая терапия, однако следует помнить, что они существенно повышают объем секреции как панкреатического сока, так и желчи, поэтому панкреатит является противопоказанием к их назначению. Кроме того, прекращение их приема в большинстве случаев приводит к рецидиву холелитиаза.
Купирование интенсивных болевых приступов – основная задача фармакотерапии ХП. В первую очередь необходимо быть уверенным в отсутствии у больного других заболеваний, способных маскировать обострение ХП и осложнений, которые могут быть скорректированы хирургическим путем
(например, псевдокисты, внутрипротоковая обструкция или компрессия соседних органов). Назначают диету с ограничением жира (до 50–75 г/сут) и белка (для уменьшения стимуляции ПЖ) частыми приемами небольших количеств пищи (суточный рацион разбивают на 5–6 приемов). При развитии мальдигестии для снижения выраженности боли некоторое значение имеет проведение терапии витаминами, препаратами кальция.
Препараты пищеварительных ферментов можно использовать как в разгар заболевания с целью подавления панкреатической секреции, так и в период выздоровления при восстановлении нормального приема пищи. Попадание ферментов ПЖ (протеаз, прежде всего трипсина) в тонкую
кишку по механизму отрицательной обратной связи вызывает снижение панкреатической секреции, снижение внутрипротокового давления и уменьшает боль. Традиционно для этой цели использовались порошок или таблетированные препараты панкреатина. Однако последние работы отечественных и зарубежных авторов показывают, что назначение панкреатина в капсулах не только более удобно (за счет более высокого содержания протеаз в одной капсуле), но и более эффективно, чем в таблетках в тех же дозах.
Способность ферментного препарата сохранять устойчивость в кислой среде желудка и активироваться только в щелочной среде – очень важное свойство, которое резко повышает эффективность капсулированных ферментов, т. к. после приема обычного панкреатина на уровне трейтцеровой связки сохраняется лишь 22 % от исходной активности трипсина и 8 % – липазы. Однако при ХП происходит значительное снижение продукции бикарбонатов, что приводит к нарушению защелачивания в двенадцатиперстной кишке. Это создает несколько проблем. Первая касается нарушения активации частиц ферментного препарата, покрытых энтеросолюбильной оболочкой. Вторая проблема заключается в том, что в кислой среде происходит усиление продукции секретина, который значительно увеличивает объем панкреатической секреции и таким образом может вносить свой вклад в сохранение абдоминальной боли. Поэтому эффективность ферментной терапии
может быть повышена одновременным назначением антисекреторных препаратов (Н2-блокаторы, омепразол). Некоторые пациенты также отмечают улучшение на фоне приема антацидов за 30 минут до и через час после еды, однако препараты, содержащие кальций или магний, ослабляют действие ферментных препаратов. Спазмолитики (в частности, мебеверин), как и средства, снижающие давление в протоках и в паренхиме ПЖ, соответственно, являются необходимым компонентом терапии.
Не следует забывать об анальгетиках – парацетамоле или нестероидных противовоспалительных препаратах (кеторолак), при их неэффективности – трамадоле и аналогичных препаратах. Современные исследования показывают, что при ХП эффективны лишь высокие дозы анальгетических
препаратов: так, трамадол необходимо назначать по 800 мг/сут и выше, что в 2 раза превышает обычную дозу. Часто ненаркотические анальгетики бывают неэффективными, и встает вопрос о
назначении опиатов вплоть до морфина. В западных странах гастроэнтерологи нередко назначают наркотические препараты, что создает проблему развития зависимости для 10–30 % больных. Большое значение имеет одновременное назначение вспомогательных лекарственных средств, таких как антидепрессанты, которые могут оказывать прямое противоболевое действие, способствуют купированию сопутствующей депрессии, а также потенцируют действие анальгетиков.
Если боль резистентна к терапии при расширении главного протока более 8 мм, для 70–80 % больных облегчение может приносить латеральная панкреатоеюностомия. Если панкреатический проток не расширен, показано проведение дистальной панкреатэктомии (при преимущественном поражении хвоста железы) или операция Уиппла (при поражении в основном головки железы).
Значительное снижение качества жизни больного панкреатитом связано с такой частой проблемой, как стойкое вздутие живота. Иногда вздутие не купируется даже при приведении адекватной заместительной терапии ферментными препаратами. В этом случае к проводимому лечению необходимо добавить адсорбенты (симетикон, диметикон) или использовать комбинированные ферментные препараты, содержащие адсорбирующие вещества.
Следует помнить, что дискинезия СО (III тип дисфункции) может быть проявлением функционального заболевания, одним из механизмов развития абдоминального болевого синдрома. Для диагностики такого состояния необходимо тщательное обследование для определения или исключения четких объективных критериев соматических заболеваний (прежде всего панкреатита; см. алгоритм на вклейке). При обследовании таких больных очень важно опираться на конкретные критерии (например, Кембриджскую систему критериев диагностики панкреатита) и определить, когда нужно останавливать бесконечную череду консультаций и обследований пациента (тем более что многие из них достаточно инвазивны и сами по себе могут вызывать ряд новых симптомов). Клиническими особенностями функциональных нарушений является то, что расстройства различных отделов желудочно-кишечного тракта часто сочетаются между собой и с функциональными расстройствами других органов и систем.
У значительной части больных выражены жалобы астенического характера (общая слабость, разбитость, повышенная утомляемость). Симптоматическое лечение обычно не приводит к стабильному улучшению в состоянии пациентов, эффект от приема препаратов оказывается нестойким. Для многих таких больных характерна нестабильность и быстрая динамика жалоб. Существует эффект “ускользания симптома”: назначаемые препараты быстро теряют свою “привлекательность” и эффективность. У больных возникают необычные реакции непереносимости лекарственных средств. Актуальность симптомов может меняться независимо от динамики самого симптома. Интересно, что лишь среди некоторых больных удается проследить связь начала заболевания с психогенными факторами [23].
Основные направления лечения дисфункции CО в рамках функционального расстройства: этиологическая и патогенетическая терапия основного заболевания (консультация психиатра, лечение у психотерапевта, психофармакотерапия); нормализация моторных расстройств органов пищеварения (миотропные спазмолитики, мебеверин); снижение висцеральной чувствительности, коррекция механизмов восприятия болей. Препаратом выбора здесь является пинаверия бромид, который ослабляет гипермоторику гладкой мускулатуры желудочно-кишечного тракта (спазм, ускорение моторики) и при этом устраняет висцеральную гиперчувствительность.
Основная задача ферментной заместительной терапии – не столько купирование симптомов нарушенного переваривания, сколько коррекция трофологической недостаточности. Для предотвращения стеатореи у таких больных ферментный препарат должен обеспечивать по крайней мере 40 тыс МЕ активной липазы в двенадцатиперстной кишке вместе с пищей. Этого можно достичь только назначением современных препаратов в виде микрочастиц с энтеросолюбильной оболочкой.
Имеет значение также и размер микрочастиц. Меньший размер обеспечивает наибольшую удельную поверхность и дисперсию в пищевом болюсе, т. е. эффективное перемешивание ферментов и пищи в двенадцатиперстной кишке. Кроме того, это способствует более быстрому началу переваривания пищи после высвобождения ферментов из энтеросолюбильной оболочки: переваривание начинается уже через 30 минут, тогда как при размерах микрочастиц 1,8–2,0 мм это происходит через 140 минут.
Для максимальной эффективности ферментные препараты нужно принимать вместе с пищей. Эффективность заместительной терапии значительно выше, если препараты принимаются вместе с пищей или сразу после ее приема по сравнению с приемом перед едой. Недавно опубликованное рандомизированное двойное слепое плацебо-контролируемое исследование показало статистически достоверное снижение стеатореи, частоты стула и нормализацию его консистенции на фоне приема энтеросолюбильных панкреатических ферментов по данным теста со смешанными триглицеридами
и количественного определения жира в кале у 49 больных ХП [2]. Несмотря на назначение современных препаратов, примерно половине пациентов не удается нормализовать переваривание
жира. Это может быть связано с недостаточным соблюдением больными назначенной схемы терапии, низкой дозой препаратов, закислением среды в тонкой кишке и появлением синдрома избыточного бактериального роста. За счет снижения панкреатической секреции бикарбонатов нарушаются и буферные свойства кишечного содержимого в проксимальной части тонкой кишки. При рН < 4 происходит инактивация как эндогенной, так и экзогенной липазы; кроме того, начинается преципитация желчных солей, снижающая доступность жира для переваривания. Почти для 40 % больных ХП с экзокринной панкреатической недостаточностью возникает синдром избыточного бактериального роста. Помимо повышения дозы ферментов в этом случае больным также показано назначение абсорбентов (смектит диоктаэдрический, белая глина, алюминия и магния гидроксид)
и спазмолитиков пролонгированного действия – мебеверина; при развернутой картине синдрома избыточного бактериального роста необходимы антибактериальные препараты.
Обычно начальная доза ферментного препарата при клинически выраженной экзокринной недостаточности ПЖ составляет 25–75 тыс. ЕД липазы на прием пищи, что соответствует 10 % от активности нормальной липазы, однако после резекции ПЖ, при нарушении опорожнения желчного пузыря, дуоденостазе, т. е. при нарушении нормальных условий действия как эндогенной, так и экзогенной липазы, может потребоваться 20–100 % от нормальной активности – от 100–500 тыс.
ЕД липазы на прием пищи.
Если не удается устранить стеаторею, показано дополнительное назначение антисекреторных препаратов. Среднецепочечные триглицериды,которые напрямую всасываются слизистой оболочкой тонкой кишки, могут быть полезны как источник калорий при похудании для снижения тяжести стеатореи при недостаточном ответе на ферментную заместительную терапию.
Таким образом, лечение больных ХП требует прежде всего тщательного обследования для верификации структурных изменений ПЖ/желчевыводящих путей, а также осложнений требующих хирургической коррекции. Терапия ХП должна проводиться дифференцированно – в зависимости от ведущего клинического синдрома и стадии заболевания. Заболевание, которое удалось обнаружить на начальной стадии, обычно не требует медикаментозной коррекции, в этом случае обычно достаточно изменения образа жизни и диетотерапии. Лечение ХП с выраженной болью в животе включает
панкреатические ферменты, антисекреторные препараты и селективные спазмолитики. При возникновении стеноза Фатерова соска показано адекватное обследование: эндо-УЗИ и/или эндоскопическая ретроградная холангиопанкреатография и эндоскопическое лечение.
Медикаментозная коррекция функциональных расстройств должна включать назначение спазмолитиков, пищеварительных ферментов, антацидов, нередко – психотропных препаратов. Мебеверин в короткий срок нормализует моторную функцию билиарного тракта, тонус сфинктеров
и купирует симптоматику у больных с дискинезией СО.



