Введение
Рецидивирующая инфекция мочевыводящих путей (РИМП) является краеугольным камнем современной урогинекологии. В руководстве EAU (Европейская ассоциация урологов, 2024) РИМП диагностируется при наличии трех эпизодов инфекций мочевыводящих путей (ИМП) за предыдущие 12 месяцев или 2 эпизода за 6 месяцев, включает неосложненные и осложненные рецидивы ИМП как нижних, так и верхних мочевыводящих путей [1]. РИМП встречаются у женщин в 30 раз чаще, чем у мужчин, в основном из-за анатомических особенностей: более короткой и широкой уретры и близкого ее расположения к влагалищу, гормональных особенностей.
Рецидивы составляют 20% всех ИМП и обусловлены персистенцией или повторным появлением исходного штамма, обычно через 2–3 недели после окончания лечения антибиотиками. Основными причинами рецидивов являются неадекватное лечение антибиотиками, самолечение, наличие основного урологического заболевания, которое способствует персистенции бактерий, а также резистентность к антибактериальным препаратам вследствие их частого бесконтрольного применения [2].
РИМП обусловлены сложным взаимодействием между инфекционным штаммом бактерий (как правило, кишечной палочки) и клетками уроэпителия. К бактериозависимым факторам риска относятся наличие адгезинов, фимбрий P и типа 1 и их способность формировать полимикробные биопленки. К факторам, зависящим от организма, относится наличие защитного слоя слизистой оболочки мочевых путей, состоящего из гликозаминогликанов и протеогликанов, включая белок Тамм-Хорсфолла (содержащий D-маннозу), который играет антиадгезивную роль. При многократном рецидивировании ИМП этот антиадгезивный слой уротелия может быть истощен, что объясняет научные подходы к возможности уменьшения числа рецидивов с помощью длительной профилактики, позволяющей этому слою восстанавливаться и регенерировать [2].
Цель данного обзора: провести обзор литературы и оценить эффективность и переносимость D-маннозы для лечения и профилактики РИМП.
Современные подходы к лечению РИМП, основанные на клинических рекомендациях
В рутинных схемах лечения РИМП в качестве первой линии терапии используют антибактериальные препараты, такие как фосфомицин, нитрофураны, а при их непереносимости как альтернативный вариант цефалоспорины при наличии чувствительности по данным микробиологического исследования мочи [1]. В том числе рекомендуется индивидуальный подход к назначению длительной антибиотикопрофилактики или посткоитальной антибиотикопрофилактики. Однако чрезмерное применение этих препаратов способствует развитию антибиотикорезистентности, развитию аллергических реакций, побочных эффектов, что в конечном итоге ограничивает их эффективность. Кроме того, многократное применение антибиотиков нарушает микробиоту желудочно-кишечного тракта и влагалища (бактериальный вагиноз, аэробный вагинит и др.), приводя к развитию «порочного круга» рецидивирования. Поэтому в настоящее время активно идут поиск и разработка новых альтернативных методов лечения и профилактики РИМП.
Свойства D-маннозы
В последние годы значительное внимание уделяется использованию с лечебной и профилактической целью субстанций с антиадгезивными свойствами, в первую очередь моносахарида D-маннозы [1, 3]. Применение D-маннозы при РИМП изучают уже более 40 лет. В 1979 г. израильскими микробиологами под руководством профессора M. Аронсона установлено, что при высокой концентрации D-маннозы в моче частота возникновения РИМП снижается на 67% [4]. Полученные впоследствии экспериментальные и клинические данные подтвердили наличие антиадгезивного эффекта D-маннозы в отношении Escherichia coli и других уропатогенов.
Термин «манноза» происходит от библейского термина «манна». Название молекулы «D-манноза» происходит от древнееврейского слова «манна». Как известно, манна – та самая спасительная пища, данная израилитянам, ведомым пророком Моисеем, для облегчения их перехода через Синай в Землю Обетованную. В самом деле, D-манноза калорийна, сладковата на вкус, была идентифицирована в ясене манновом (лат. Fraxinus ornus). Выделяясь из листьев Fraxinus ornus, сок растения быстро засыхает, формируя белую мелкую крупку, которую на Ближнем Востоке называют «манной» и до сего времени [5].
D-манноза – природный сахар альдогексоза, отличающийся от глюкозы инверсией одного из четырех хиральных центров молекулы: атома углерода во втором положении. Этот сахар физиологически присутствует в организме человека, участвует в иммунорегуляции и играет другие важные биологические роли, такие как гликозилирование многих белков. Было обнаружено еще одно свойство D-маннозы: она ингибирует бактериальную адгезию к уротелию [5, 6]. Фармакокинетические исследования показали, что по крайней мере 90% принятой внутрь D-маннозы эффективно всасывается в верхних отделах кишечника и быстро выводится из кровотока. Период полувыведения в плазме составляет от 30 минут до нескольких часов. Множество вещества выводится в неизмененном виде с мочой в течение 30–60 минут, остаток выводится в течение следующих 8 часов [5, 6]. За это время не происходит значительного повышения уровня глюкозы в крови, и D-манноза обнаруживается в тканях только в следовых количествах. Обоснование использования D-маннозы для профилактики РИМП основано на ее конкурентном ингибировании прикрепления бактерий к уротелиальным клеткам за счет связывания фимбрий 1-го типа, экспрессируемых на бактериях. Уропатогенная кишечная палочка (UPEC) может адгезироваться и, следовательно, колонизировать уротелий, используя взаимодействие между фимбриями 1-го типа и гликопротеинами, экспрессируемыми эпителиальными клетками. Фимбрии 1-го типа обладают сильным сродством к терминальным эпитопам маннозы уроплакина Ia, высокоманнозилированного мембранного белка, который покрывает поверхностные эпителиальные зонтичные клетки мочевыводящих путей. Фимбрии 1-го типа были обнаружены и у других членов семейства Enterobacteriaceae, включая Klebsiella pneumoniae, Shigella flexneri, Salmonella typhimurium, Serratia marcescens и Enterobacter cloacae. Многие из них являются этиологическим фактором рецидивирующих ИМП. Более того, продемонстрировано, что фимбрии играют ключевую роль и в транслокации E. coli через эпителий кишечника. D-манноза может связывать адгезин FimH, который расположен на кончике фимбрии 1-го типа UPEC и является фактором вирулентности бактерии. «Покрытие» участков связывания FimH адгезина D-маннозой происходит за счет обратимых гидрофобно-гидрофильных взаимодействий (например, водородных связей, сил Ван-дер-Ваальса) без изменения конформации белка. D-манноза может устанавливать до 12 прямых водородных связей с основными и боковыми цепями адгезина FimH. При этом D-манноза не оказывает бактерицидного или бактерио-статического действия, что крайне важно в свете растущей резистентности бактерий, поскольку применение D-маннозы позволяет избегать селекции устойчивых штаммов уропатогенов. У D-маннозы принципиально иной механизм действия: образование комплекса «D-манноза–бактерии» способствует абсорбции и вымыванию микроорганизмов во время мочеиспускания, не позволяя им прикрепляться к уротелию и формировать биопленки. Если моча содержит свободную D-маннозу в достаточной концентрации, то адгезин FimH UPEC блокируется, бактерии не могут эффективно прикрепляться с эпителиальными клетками и вымываются под действием сдвигающих сил из-за потока мочи. Это свойство D-маннозы позволяет рекомендовать ее в качестве неантибактриальных методов профилактики как острых, так и рецидивирующих ИМП [5–13]. Экзогенная D-манноза выводится через мочевыводящие пути в неизменном виде, не превращается в гликоген, следовательно, не накапливается в организме. Исследования in vivo и in vitro продемонстрировали способность маннозоподобных молекул уменьшать бактериальную нагрузку в мочевыводящих путях в 2 раза и более после четырех внутрипузырных инстилляций. Однако дозировка, режим и продолжительность приема в разных клинических исследованиях различались [6–10].
R. Kyriakides et al. [11] провели систематический обзор исследований с участием 695 женщин касательно роли D-маннозы в профилактике РИМП. Авторы сделали следующий вывод: D-манноза значимо снижает частоту рецидивов ИМП, уменьшает симптомы воспаления и обеспечивает более длительный период между эпизодами рецидива ИМП. Данный обзор подтверждает потенциальную роль D-маннозы в качестве альтернативной или дополнительной стратегии лечения РИМП.
Проведенный систематический анализ 33 064 исследований И.Ю. Торшиным и соавт. в 2020 г. [5] показал другие значимые эффекты D-маннозы: ее важность для гликозилирования белков, поддержки иммунной, сердечно-сосудистой, мочевыводящей и других систем организма. Нарушения обмена D-маннозы – неотъемлемый компонент патогенеза аутоиммунных заболеваний (сахарного диабета 1 типа, болезни Крона, ревматоидного артрита и др.). Кроме этого нарушения уровней и активности D-манноза-зависимых белков ассоциированы с повышенным риском бактериального цистита и опухолевых патологий. В анализируемой литературе продемонстрированы также бактериостатические, противовоспалительные и противоопухолевые эффекты D-маннозы, которые усиливаются пребиотиком (метабиотиком) инулином. В сочетании с инулином D-манноза тормозит рост патогенных бактерий и одновременно поддерживает рост полезной микробиоты кишечника.
Эффективность D-маннозы для лечения и профилактики острой ИМП и РИМП
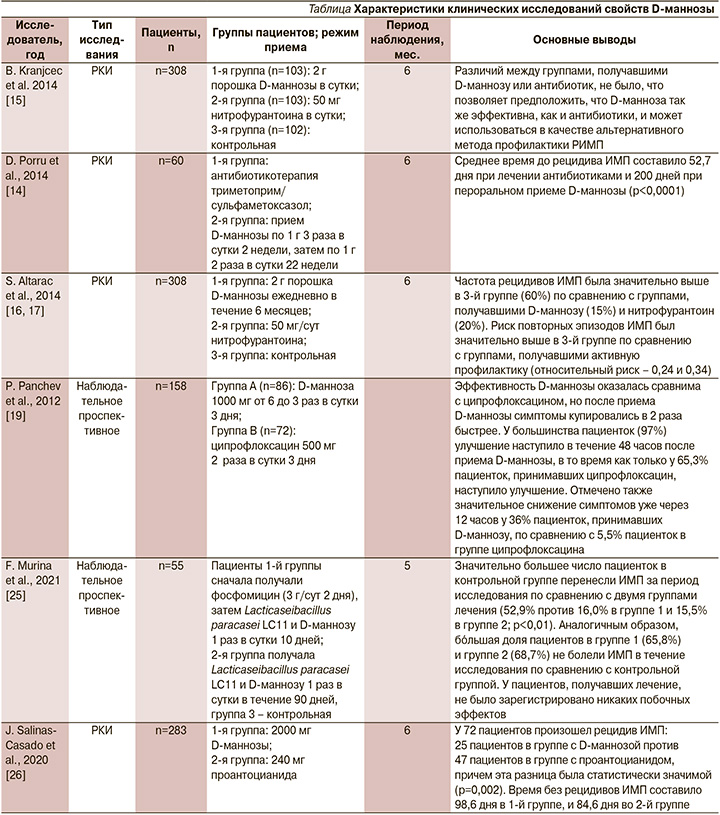
В исследование В. Kranjcec et al. [6] были включены 308 женщин, страдавших РИМП в стадии обострения, которое было купировано антибактериальной терапией. Затем пациентки были рандомизированы в три группы. С целью профилактики рецидива больные 1-й группы получали по 2,0 г D-маннозы ежедневно, 2-й группы – по 50 мг нитрофурантоина ежедневно, а 3-я группы не получала профилактической терапии, группа контроля. Через 6 месяцев было продемонстрировано, что в 1-й группе заболевание рецидивировало в 14,6% случаев, а во 2-й – в 20,4%. В 3-й группе более половины (60,8%) женщин отмечали обострение цистита в течение полугода. Исследование показало неоспоримое преимущество профилактического лечения, причем D-манноза оказалась более эффективной, чем нитрофурантоин. Результаты данного рандомизированного клинического исследования (РКИ) были приняты к рассмотрению и позволили Европейской урологической ассоциации в 2021 г. включить D-маннозу в Клинические рекомендации по инфекциям мочевыводящих путей как рекомендуемый препарат для лечения и профилактики РИМП (степень уровня доказательств – 2) [1]. В ряде других исследований также подтвердилась эффективность D-маннозы при хроническом рецидивирующем цистите.
В исследовании D. Porru et al. [14] в группе пациенток, получавших D-маннозу, значительно снизились ургентность и частота мочеиспусканий (p<0,0001). Кроме того, время до очередного рецидива в группе D-маннозы было дольше (200 дней), чем в группе, принимавшей только антибиотики (52,7 дня). Подобное исследование сравнения эффективности D-маннозы и антибиотикопрофилактики РИМП провели также S. Altarac et al. [15, 16]. После начального лечения острых ИМП антибактериальным препаратом (ципрофлоксацин 500 мг) пациентки были разделены на три группы: 1-я получала профилактику в виде порошка D-маннозы, 2-я – прием нитрофурантоина, 3-я – не получала никакой профилактики (контроль). В течение 6 месяцев 32% пациенток столкнулись с рецидивами ИМП. Частота рецидивов была выше у пациенток 3-й группы (контроль, 60%) по сравнению с группами, получавшими D-маннозу (15%) или нитрофурантоин (20%). Таким образом, число повторных эпизодов ИМП был значительно выше у пациенток без вторичной профилактики. Побочные эффекты были более выражены у пациенток, принимавших нитрофурантоин. В группе женщин, принимавших D-маннозу, у 8% пациенток случались эпизоды диареи, но они не требовали прекращения приема препарата. Приверженность пациенток была высокой в обеих группах. Эффективность в профилактике рецидивов РИМП была сравнимой в группах женщин, получавших D-маннозу или антибиотик (нитрофурантоин), что позволило исследователям сделать вывод о схожем с антибактериальными препаратами эффекте D-маннозы и предложить ее применение в качестве альтернативного метода профилактики РИМП.
Аналогично в исследовании G. Del Popolo et al. [17] применение D-маннозы привело к значительному снижению частоты мочеиспусканий (p=0,001) и эпизодов недержания мочи (p>0,001). Пилотное исследование L. Domenici et al. [18] показало, что D-манноза может использоваться для лечения острой ИМП (13 дней лечения), а также имеет потенциал в качестве профилактики (6 месяцев лечения) у женщин с симптоматической (дизурия, частота, срочность, надлобковая боль, ноктурия и гематурия) или бессимптомной ИМП (диагностированной как ≥103 КОЕ/мл мочи). При этом симптомы ИМП значительно уменьшались по сравнению с контрольной группой пациенток, не получавших D-маннозу. Также была отмечена значимая разница в количестве рецидивов ИМП: 4,5% в исследуемой группе, получавшей D-маннозу, и у каждой третьей пациентки контрольной группы.
Р. Panchev et al. [19] в наблюдательном исследовании с участием 158 женщин оценили эффективность перорального комбинированного препарата, содержавшего D-маннозу, экстракт листьев березы и клюквы, при острых ИМП. Результаты исследования показали, что после 3-дневного приема препарата с D-маннозой клиническое и симптоматическое улучшение наступало быстрее по сравнению с приемом антибактериальных препаратов (среднее время: 24 и 46 часов соответственно). Через 48 часов симптомы нивелировались у 97% пациенток в группе, принимавшей D-маннозу, в то время как в группе антибиотиков – только у 65,3%.
Антиадгезивный эффект D-маннозы
Существует мнение, согласно которому D-манноза потенциально препятствует адгезии кишечной палочки к уротелию и возникновению инфекции. Это т.н. конкурентное ингибирование рассматривается как один из потенциальных механизмов предотвращения развития ИМП [19–26].
E. coli является возбудителем в 85% случаев ИМП. Адгезия E. coli к уро-эпителию в основном основана на маннозочувствительном механизме, когда пили E. coli типа I адгезируются к маннозным структурам на поверхности уроэпителиальных клеток [22]. В двух лабораторных исследованиях оценивался потенциал D-маннозы в блокировании бактериальной адгезии к уроэпителиальным клеткам с целью предотвращения инфекции. Оба пришли к выводу, что потенциал для разработки таких антиадгезивных агентов для предотвращения рецидивирующих инфекций действительно существует. J. Bouckaert et al. [23] обнаружили, что экзогенный бутил α-D-маннозид обладает значительно бόльшим сродством к FimH, чем манноза, и поэтому ингибирует адгезию пили 1-го типа E. coli к уроэпителию.
R. Ala-Jaakkola et al. [24] провели обзор исследований с применением D-маннозы в качестве монотерапии в сочетании с пробиотиками и в комплексной терапии с другими добавками для снижения риска ИМП и их рецидивов. Авторы сделали вывод: D-манноза является многообещающей добавкой для лечения и профилактики ИМП, особенно у женщин. Исследования показывают, что она может улучшать клинические результаты, уменьшать симптомы воспаления и снижать частоту рецидивов ИМП. Тем не менее необходимы дополнительные исследования, чтобы определить оптимальную дозировку, продолжительность лечения и рекомендации по комбинации с другими веществами. Во многих исследованиях показана эффективность доз D-маннозы 2–3 г/сут.
В исследовании F. Murina et al. [25] проводилось контролируемое изучение пациенток с ИМП. После 2-дневного лечения антибиотиками и подтверждения отсутствия симптомов пациенты были разделены на три группы. В 1-й группе пациентки получали Lacticaseibacillus paracasei LC11, клюкву и D-маннозу в течение 10 первых дней, продолжая данное лечение в течение 3 месяцев. Группа 2 получала то же лечение, но один раз в сутки в течение 90 дней. В 3-й группе лечения не проводилось. В результате исследования 87,7% пациенток 1-й группы сообщили об отсутствии рецидивов ИМП до 90-го дня и у 65,8% не было обнаружено ИМП на 150-й день. Во 2-й группе 84,9% пациенток не имели рецидивов на 90-й день и 68,8% на 150-й день, в то время как в 3-й группе ИМП не проявились у 42% на 90-й день и 36,9% на 150-й день. Эти результаты показали, что в обеих группах активного лечения рецидивы ИМП были значительно ниже по сравнению с контрольной группой в течение 150 дней исследования. Не было обнаружено значительной разницы в частоте рецидивов между двумя различными методами лечения. Исследование не выявило различий в эффективности лечения независимо от того, проводилось оно непрерывно или же в течение 10 дней каждого месяца.
Рецидивы ИМП также оценивались в рандомизированном двойном слепом исследовании с участием 150 женщин с РИМП [26]. Исследуемыми продуктами были: 1) пищевая добавка, содержавшая D-маннозу, проантоцианидины, урсоловую кислоту, витамины А, С и Е, цинк; 2) соединение, содержавшее только проантоцианидины (полифенолы). В ходе исследования было установлено, что употребление 1 раз в сутки в течение 24 недель исследуемого продукта, содержавшего D-маннозу, более эффективно снижает риск развития ИМП, чем однократный прием проантоцианидинов. Аналогичное исследование с более крупной популяцией дало схожие результаты [27].
Кроме того, в нескольких исследованиях показан эффект D-маннозы, в т.ч. для профилактики РИМП у женщин в постменопаузе [6, 28, 29]. Миллионы женщин в постменопаузе страдают от симптомов, вызванных резким дефицитом эстрогенов – ГУМС, и не обращаются за необходимым лечением.
В постменопаузе уротелий и его глюкозаминогликановый слой становятся тонкими, более подвержены адгезии микроорганизмов, уретра становится более широкой, ее наружное отверстие опускается, возможен даже выворот эпителия наружу. Все это создает предпосылки к колонизации мочевого пузыря бактериальной флорой и при неблагоприятных условиях может приводить к развитию цистита. Стандарт лечения женщин с ГУМС в постменопаузе включает антибактериальную терапию, иммунопрофилактику (ОМ-89) и локальную заместительную гормонотерапию. Кроме того, проводятся перспективные исследования по возможности снижения ИМП в постоперационном периоде у женщин в постменопаузе с пролапсом гениталий [28, 29]. Прием D-маннозы снижает частоту рецидивирующих ИМП при хроническом воспалении уротелия (Cystitis cystica – СС) у женщин в постменопаузе (13 пациенток с СС, 14 пациенток без СС). До начала приема D-маннозы у пациенток с СС отмечен более высокий уровень заболеваемости ИМП (4,69 рецидива ИМП в год), чем у пациенток без СС (2,93 рецидива/год; р=0,021). На фоне регулярного приема D-маннозы заболеваемость ИМП достоверно снизилась и у пациенток с СС (до 2,23 рецидива/год; р=0,0028), и у пациенток без СС (до 1,64 рецидива/год; р=0,0007) [30].
В настоящее время также продемонстрирован эффект D-маннозы в профилактике рецидивов РИМП у беременных женщин: в 2020–2021 гг. нами впервые было проведено исследование по оценке эффективностиD-маннозы в комплексной терапии беременных с обострением хронического цистита, включившее 40 беременных женщин на сроке до 27 недель. Двадцать пациенток принимали фосфомицина трометамол в дозе 3 г однократно или амоксициллина клавуланат в дозе 875 мг 3 раза в сутки в течение 5 дней и D-маннозу в интермиттирующем режиме по 14 дней в месяц вплоть до родоразрешения, другим 20 беременным проводили только терапию антибактериальным препаратом. У пациенток, получавших D-маннозу, зарегистрировано 6-кратное снижение числа рецидивов по сравнению с группой контроля [31].
Обсуждение и дискуссия
ИМП – распространенная проблема, особенно среди женщин. Дисбаланс урогенитальных бактерий, вызванный частыми половыми контактами или постменопаузальным возрастом, является фактором риска возникновения ИМП. Частые инфекции и использование антибиотиков приводят к изменению урогенитальной микробиоты.
В частности, применение антибиотиков может влиять на преобладание местных лактобактерий и потенциально создавать подходящую среду для размножения уропатогенов.
Хотя антибактериальные препараты по-прежнему являются основным средством лечения острых ИМП и РИМП, их использование в качестве профилактики уже привело к росту резистентности, что ставит под угрозу дальнейшую эффективность лечения.
Согласно многочисленным данным систематических обзоров и анализов литературы, D-манноза может способствовать улучшению качества лечения ИМП, а также использоваться в качестве профилактического средства, снижая риск развития РИМП.
В России зарегистрировано множество биологически активных добавок с D-маннозой, однако целесообразно отметить Цисталис Д Плюс*, который зарекомендовал себя в качестве эффективного средства для профилактики и лечения рецидивов ИМП. Особым преимуществом данной добавки является самая большая доза среди других БАД – 2,5 г D-маннозы в 1 саше, что соответствует результатам многочисленных исследований об эффективных дозах D-маннозы. Благодаря своему инновационному составу и механизму действия он способен значительно снижать вероятность повторных случаев ИМП. Основные выводы исследований представлены в таблице.
Дополнительным компонентом, который может стать хорошей альтернативой антибиотикопрофилактике ИМП, является экстракт виноградных косточек. Входящие в его состав олигомерные проантоцианидины типа В способны связываться с адгезинами и ингибировать бактериальные ИМП. Терапевтическое действие этих субстратов обусловлено как снижением выработки провоспалительных цитокинов, так и наличием антиоксидантного эффекта [32–34].
Состав Цисталиса Д Плюс дополняет экстракт толокнянки, стандартизованный по арбутину. Комиссия Е (комиссия экспертов при Минздраве Германии, являющаяся аналогом американской FDA для фитопрепраратов) одобрила экстракт толокнянки обыкновенной в качестве средства для лечения ИМП. Антимикробная активность содержащегося в толокнянке арбутина обусловлена его трансформацией в организме человека в гидрохинон, который оказывает прямое цитотоксическое действие на бактериальные клетки. Более того, арбутин повышает гидрофобность поверхности микробных клеток и тем самым предотвращает адгезию к клеточным стенкам мочевыводящих путей [32–38].
С целью подкисления мочи и усиления антиоксидантных свойств в Цисталис Д Плюс добавлен витамин С.
В рандомизированных сравнительных исследованиях показано, что применение аскорбиновой кислоты в 2,3 раза снижало риск рецидива ИМП у беременных женщин [39].
Помимо комплекса Цисталис Д Плюс на российском рынке представлены капсулы Цисталис* с меньшим количеством D-маннозы, предназначенные для приема вне обострений ИМП в качестве средства профилактики рецидивов.
В РКИ И.С. Шорманова и соавт. в 2022 г. [40] с участием 60 женщин с рецидивирующим циститом пациентки были разделены на 2 группы по 30 человек в каждой. В 1-й группе применяли стандартную антибактериальную терапию обострения цистита в соответствии с результатами бактериологического исследования мочи с последующим наблюдением в течение 6 месяцев. Пациентки 2-й группы вместо антибактериальной терапии получали биологически активный комплекс Цисталис по одной капсуле (350 мг) 2 раза в сутки в течение 3 месяцев с последующим наблюдением в течение 3 месяцев. На протяжении 6-месячного периода наблюдения у пациенток 2-й группы, принимавших 6 месяцев БАД Цисталис, было зарегистрировано в 4 раза меньше рецидивов ИМП по сравнению с 1-й группой, принимавшей антибактериальные препараты при обострении ИМП без профилактики.
Выводы
Профилактика ИМП эффективными и безопасными средствами (D-манноза, олигомерные проантоцианидины типа В, арбутин) – оптимальная врачебная стратегия для вторичной профилактики РИМП. Блокируя взаимодействие фимбрий уропатогенных бактерий с уротелием, D-манноза и олигомерные проантоцианидины типа В предотвращают колонизацию мочеполового тракта патогенными бактериями и их персистенцию. Клинические исследования подтвердили высокую эффективность и безо-пасность использования D-маннозы для терапии и профилактики ИМП у женщин всех возрастов, в т.ч. во время беременности.
По данным проведенного анализа литературы очевидна эффективность и безопасность лечения и профилактики РИМП препаратами, содержащими D-маннозу. При этом новые БАДы Цисталис и Цисталис Д Плюс, в состав которых входят D-манноза, олигомерные проантоцианидины типа В из экстракта виноградных косточек и арбутин из толокнянки, имеют преимущества за счет повышенной дозы D-маннозы, дополнительного антиадгезивного эффекта олигомерных проантоцианидинов типа В и антимикробного действия арбутина. В проведенном исследовании продемонстрировано отсутствие побочных эффектов при их длительном использовании. Результаты нашего обзора подтверждают, что применение D-маннозы значимо уменьшает частоту рецидивов ИМП, увеличивает интервал между повторными инфекциями, что значительно улучшает качество жизни пациенток.
____________________
* БАД – НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ.



