Cахарный диабет 2 типа (СД2) – одно из самых распространенных хронических заболеваний, приводящее к снижению продолжительности и качества жизни. Заболеваемость СД2 неуклонно растет в связи с увеличением числа больных ожирением, увеличением средней продолжительности жизни. Поскольку начальные нарушения углеводного обмена часто протекают бессимптомно, при выявлении СД2 многие пациенты уже имеют микро- и макрососудистые осложнения. Так, частота сопутствующей сердечно-сосудистой патологии у больных СД2 в 2–4 раза выше, чем у лиц без нарушений углеводного обмена. Лечение, основанное на применении лекарственных средств с высоким антигипергликемическим эффектом, минимальным числом побочных эффектов, а также удобных при постоянном использовании, служит оптимальной тактикой, приводящей к улучшению контроля над диабетом [1].
В основе нарушений углеводного обмена при СД2 лежат инсулинорезистентность (неадекватный биологический ответ клеток на достаточное физиологическое содержание инсулина в крови) и дисфункция β-клеток поджелудочной железы. К главным целям лечения СД2 относятся достижение уровня глюкозы крови, максимально приближенного к нормальному без высокого риска гипогликемий, сохранение функции β-клеток и уменьшение инсулинорезистентности. Национальные и международные программы по терапии СД2 ежегодно обновляются и дополняются с учетом патогенетических подходов к терапии и вновь получаемых данных. Совет экспертов Российской ассоциации эндокринологов (РАЭ) в 2011 г. разработал Консенсус по инициации и интенсификации сахароснижающей терапии СД2 [2]. Международные клинические рекомендации полностью вошли и в 6-е издание алгоритмов специализированной медицинской помощи больным СД в Российской Федерации в рамках федеральной программы «Сахарный диабет» [3].
 В 2012 г. вышли обновленные рекомендации ADA/EASD (American Diabetes Association/European Association for the Study of Diabetes), также принявшие во внимание современные взгляды на лечение больных СД2 [4].
В 2012 г. вышли обновленные рекомендации ADA/EASD (American Diabetes Association/European Association for the Study of Diabetes), также принявшие во внимание современные взгляды на лечение больных СД2 [4].
Согласно последним рекомендациям, индивидуальный подход к больному и, соответственно, определение индивидуального целевого уровня гликированного гемоглобина (HbA1c) должны стать основой выбора стратегии сахароснижающей терапии (ССТ).
Механизмы действия сахароснижающих препаратов различны, но в целом направлены на устранение трех основных метаболических нарушений, приводящих к гипергликемии при СД2: секреции инсулина поджелудочной железой, периферической инсулинорезистентности и избыточной продукции глюкозы печенью.
Первым этапом на пути к лечению СД2 должна быть модификация образа жизни, что обусловлено влиянием положительных эффектов снижения массы тела и увеличения физической активности на углеводный и липидный обмены. Однако лишь небольшому числу пациентов удается поддерживать нормогликемию путем немедикаментозных вмешательств. Поэтому одновременно с модификацией образа жизни целесообразно начинать терапию метформином («золотым» стандартом в лечении СД2) или при его непереносимости – ингибиторами дипептидилпептидазы-4, агонистами рецепторов глюкагоноподобного пептида-1. При неэффективности этого шага, что проявляется сохранением в течение 6 месяцев нецелевого уровня HbA1c или его снижением менее чем на 0,5 %, рекомендован переход к следующему этапу.
Второй этап – это усиление медикаментозной терапии. При этом выбор препарата определяется уровнем HbA1c, а также учитываются особенности течения сахарного диабета (СД), сопутствующая патология, возраст, стаж диабета. Все это в совокупности формирует индивидуальные целевые показатели гликемии. В последних рекомендациях Международной диабетической федерации (IDF – International Diabetes Federation, 2012) [5], ADA (2014) [6], РАЭ (2011) [2], базирующихся на крупномасштабных международных клинических исследованиях (ADVANCE – Action in Diabetes and Vascular Disease-Preterax and Dimicron MR Controlled Evaluation, ACCORD – Action to Control Cardiovascular Risk in Diabetes, VADT – Veteran Affairs Diabetes Trial), большое внимание уделяется гипогликемическим состояниям и их последствиям для здоровья пациентов. Доказано, что сердечно-сосудистые осложнения и смертельный исход чаще встречаются среди пациентов с интенсифицированным снижением уровня гликемии, гипогликемическими эпизодами (особенно тяжелыми гипогликемиями) [7]. Приоритет в этой клинической ситуации должен быть отдан средствам с минимальным риском развития гипогликемий. При исходном уровне HbA1c 6,5–7,5 % средствам выбора первого ряда остается метформин. При HbA1c 7,6–9,0 % уже в дебюте следует сразу начинать с комбинированной тера-пии.
Препараты сульфонилмочевины (ПСМ), как и метформин, имеют полувековой клинический опыт использования. Механизм действия максимально реализуется только при сохраненной функции инсулярного аппарата поджелудочной железы и обусловлен связыванием ПСМ со специфическими рецепторами плазматической мембраны β-клеток, интегрированных в структуру АТФ-зависимых калиевых каналов плазматических мембран. Глимепирид – ПСМ третьего поколения, отличающийся более высокой скоростью ассоциации и диссоциации с рецептором β-клеток (в 2,5–3,0 и 8,0–9,0 раз выше соответственно), чем препараты второй генерации [8]. Этим объясняется лучшее снижение постпрандиальной гликемии (ППГ) и меньший риск возникновения гипогликемических состояний. Кроме того, предотвращается быстрое истощение инсулярного аппарата поджелудочной железы.
Цель исследования
С целью изучения эффективности и безопасности применения комбинированного лечения метформином и ПСМ третьего поколения глимепиридом у пациентов с СД2 в России было инициировано наблюдательное исследование эффективности и безо-пасности применения комбинации глимепирида и метформина пациентами с СД2 с уровнем HbA1c 6,5–7,5 % в соответствии с совместным заключением AAEC/ACE в 2009 г.
Дизайн и методы
 Это наблюдательное проспективное исследование проходило в 90 центрах России и включило 600 пациентов с СД2 и уровнем HbA1c 6,5–7,5 %, не менее 12 недель получавших метформин, которым, по мнению лечащего врача, дополнительно требовался глимепирид (Амарил®). Все участники подписали информированное согласие на участие в исследовании, в которое были включены пациенты в возрасте 18–75 лет (средний возраст – 57,7 ± 9,47 года): 416 (69,3 %) женщин и 184 (30,7 %) мужчины. Средняя продолжительность диабета составила 2,8 ± 3,2 года, средний возраст на момент диагностики СД2 – 54,9 ± 9,5 года. Средняя продолжительность лечения метформином до добавления к лечению глимепирида (период между началом применения метформина и визитом 1) составила 2,0 ± 2,3 года. Перед добавлением к лечению глимепиридом средняя суточная доза метформина достигала 1842 ± 631 мг (медиана = 2000 мг). При этом 86 (14,3 %) пациентов получали 1 дозу метформина в сутки, 429 (71,5 %) – 2 дозы в сутки, а 85 (14,2 %) пациентов – 3 дозы в сутки. Средняя масса тела пациентов составила 90,3 ± 13,1 кг; средний индекс массы тела (ИМТ) – 31,9 ± 4,02 кг/м2.
Это наблюдательное проспективное исследование проходило в 90 центрах России и включило 600 пациентов с СД2 и уровнем HbA1c 6,5–7,5 %, не менее 12 недель получавших метформин, которым, по мнению лечащего врача, дополнительно требовался глимепирид (Амарил®). Все участники подписали информированное согласие на участие в исследовании, в которое были включены пациенты в возрасте 18–75 лет (средний возраст – 57,7 ± 9,47 года): 416 (69,3 %) женщин и 184 (30,7 %) мужчины. Средняя продолжительность диабета составила 2,8 ± 3,2 года, средний возраст на момент диагностики СД2 – 54,9 ± 9,5 года. Средняя продолжительность лечения метформином до добавления к лечению глимепирида (период между началом применения метформина и визитом 1) составила 2,0 ± 2,3 года. Перед добавлением к лечению глимепиридом средняя суточная доза метформина достигала 1842 ± 631 мг (медиана = 2000 мг). При этом 86 (14,3 %) пациентов получали 1 дозу метформина в сутки, 429 (71,5 %) – 2 дозы в сутки, а 85 (14,2 %) пациентов – 3 дозы в сутки. Средняя масса тела пациентов составила 90,3 ± 13,1 кг; средний индекс массы тела (ИМТ) – 31,9 ± 4,02 кг/м2.
Эффективность терапии оценивалась по динамике уровня HbA1c – первичная цель. Оценка глюкозы плазмы натощак (ГПН), ППГ, доли пациентов, достигших уровня HbA1c ≤ 6,5 % через 3 и 6 месяцев после начала терапии и динамики массы тела служила вторичной цели. Безопасность проводимой ССТ оценивалась по количеству гипогликемий (бессимптомных, симтоматических, ночных и тяжелых) и по частоте нежелательных явлений (НЯ).
Результаты
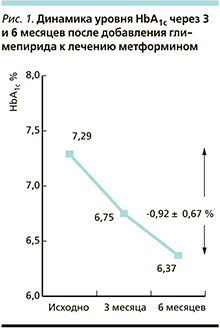
Основным критерием оценки эффективности проводимой терапии был уровень HbA1c, который снизился от исходного значения 7,29 ± 0,68 до 6,75 ± 0,5 % через 3 месяца, а через 6 месяцев после добавления глимепирида на пике эффективности метформина – до 6,37 ± 0,49 % (рис. 1). Среднее абсолютное снижение уровня HbA1c через 3 и 6 месяцев составило 0,54 ± 0,55 % (95 % доверительный интервал [ДИ] – 0,49–0,58 %) и 0,92 ± 0,67 % (95 % ДИ – 0,87–0,97 %). Доля пациентов, которыми было достигнуто абсолютное снижение уровня HbA1c более или равное 0,5 и 1,0 %, составила 88,2 % (529 из 600) и 38,8 % (233 из 600) соответственно. Таким образом, анализ первичной эффективности указывает на значительное снижение среднего уровня HbA1c в течение 3 и 6 месяцев лечения по сравнению с исходным уровнем.
Анализ вторичных целей показал, что через 3 месяца лечения уровень HbA1c менее или равный 6,5 % был достигнут 205 (34,2 %) пациентами, через 6 месяцев лечения – уже 437 (72,8 %) участниками (рис. 2).
В исходном уровне средний уровень ГПН составил 7,57 ± 1,15 ммоль/л. Через 3 месяца лечения средний уровень ГПН существенно снизился – до 6,34 ± 0,86 ммоль/л со средним изменением -1,22 ± 1,0 ммоль/л (p < 0,001). Через 6 месяцев средний уровень ГПН составил 5,88 ± 0,87 ммоль/л со средним изменением -1,69 ± 1,2 ммоль/л относительно исходного уровня (p < 0,001) [рис. 3]. Средний уровень ППГ в начале исследования составил 9,72 ± 2,97 ммоль/л. Через 3 месяца лечения средний уровень ППГ существенно снизился – до 7,93 ± 0,99 ммоль/л – со средним изменением -1,8 ± 2,8 ммоль/л (p < 0,001). Через 6 месяцев средний уровень ППГ составил 7,29 ± 0,92 ммоль/л со средним изменением -2,44 ± 2,9 ммоль/л относительно исходного уровня (p < 0,001) [рис. 3].
Средняя суточная доза метформина перед добавлением глимепирида составила 1842 ± 631 мг (медиана – 2000 мг).
Большинство пациентов получали метформин в суточной дозе 2000 мг 2 раза в сутки. В начале исследования после добавления глимепирида средняя суточная доза метформина изменилась несущественно до 1890 ± 630 мг.
Доза метформина для 506 пациентов после добавления глимепирида не изменилась, для 26 была снижена, а для 68 пациентов повышена. В процессе лечения глимепиридом средняя доза метформина не изменялась у 592 (98,7 %) пациентов. Пациенты, которым дозу метформина изменяли в течение исследования, были из него исключены.
Средняя начальная суточная доза глимепирида составила 1,0 ± 0,2 мг, что соответствует информации о применении препарата. Пациенты самостоятельно титровали дозу глимепирида по результатам самоконтроля уровня ГПН. Средние дозы глимепирида через 3 и 6 месяцев составили 2,1 ± 1,1 и 2,4 ± 1,2 мг соответственно. Наиболее часто используемой дозой глимепирида на момент визита 3 (после 6 месяцев лечения) было 2 мг. Эта доза использовалась 213 пациентами.
Средняя масса тела снизилась с 90,4 ± 13,1 кг на исходном уровне до 88,2 ± 12,6 кг через 6 месяцев лечения. Средняя разница по сравнению с исходным уровнем составила 2,1 ± 2,8 кг. Средний ИМТ снизился соответственно с 32,5 ± 4,0 до 31,7 ± 3,9 кг/м2. Средняя окружность талии (ОТ) уменьшилась с 101,1 ± 12,2 см на исходном уровне до 98,7 ± 12,0 см через 6 месяцев лечения. У большинства (n = 346) пациентов наблюдалось снижение массы тела более чем на 1 кг, у 41 – увеличение массы тела, а у 213 пациентов изменений массы тела не было или они были незначительными (менее 1 кг).
Данные об эпизодах гипогликемии собирались через 3 и 6 месяцев лечения. Всего было описано 508 эпизодов гипогликемии: 319 – после первых 3 месяцев лечения и 189 – после вторых 3 месяцев лечения. За весь период наблюдения был отмечен только 1 эпизод тяжелой гипогликемии. Среднее число эпизодов гипогликемии всех типов уменьшилось с 0,533 ± 1,42 в течение первой половины наблюдения (с 1-го по 3-й месяц) до 0,316 ± 0,84 в течение второй половины наблюдения (с 4-го по 6-й месяц). Разница была статистически значимой (p < 0,0001, парный коэффициент Стьюдента). Частота встречаемости эпизодов гипогликемии каждого типа представлена в таблице.
НЯ, описанные во время проведения исследования трех разных пациентов, – это анемия, гонартроз (1-я стадия), острая респираторная инфекция. Все НЯ были несерьезными. Среднее число амбулаторных визитов пациентов к эндокринологу в период лечения составило 4,8 ± 1,7, общее число госпитализаций за период исследования – 11 (среднее число – 0,02 ± 0,13). Все госпитализации запланированы для проведения диагностики и/или изменения дозы глимепирида. НЯ не являлись причиной госпитализаций и не рассматривались как серьезные.
Обсуждение
В проведенном исследовании были изучены результаты комбинированного применения метформина и ПСМ третьего поколения глимепирида у пациентов с СД2, не достигших целевых показателей углеводного обмена на фоне терапии метформином. Исследование продемонстрировало, что добавление глимепирида к терапии метформином приводит к значимому улучшению показателей HbA1c, ГПН, ППГ. Необходимо отметить, что такая терапия не имеет отрицательного влияния на массу тела (в ряде случаев отмечается снижение ИМТ и ОТ), а это важнейшие параметры, которые сами по себе могут приводить к ухудшению компенсации углеводного обмена.

Помимо эффективности ССТ, согласно современным рекомендациям, необходима оценка безопасности проводимой терапии. С этой целью строго контролируется частота и степень выраженности возникающих случаев гипогликемии. Проведенное исследование наглядно продемонстрировало низкий риск возникновения гипогликемии на фоне приема метформина и глимепирида, что свидетельствует о высокой безопасности применения данной комбинации для пациентов с СД2.
Нужно отметить, что неинтервенционный дизайн исследований служит возможным ограничением в отношении оценки массы тела, а также может объяснять небольшое число зафиксированных гипогликемий.
Полученные результаты перекликаются с данными других исследований. В исследовании Charpentier [9] было показано, что комбинация глимепирида и метформина, применение которой было начато у пациентов с HbA1c ≥ 7,0 %, вызвало достижение контроля гликемии (HbA1c -0,74 %), лучшего, чем применение монотерапии глимепиридом или метформином. В этом исследовании было показано, что терапия глимепиридом настолько же безопасна, как и монотерапия метформином, хотя частота встречаемости эпизодов гипогликемии в группе комбинированного лечения была выше, чем в группе метформина [9]. Эффективность комбинации глимепирида и метформина была доказана в исследовании с участием пациентов с СД2 без адекватного контроля на фоне монотерапии метформином. Двенадцатинедельная терапия продемонстрировала эффективность комбинации в плане улучшения (снижения) уровней ГПН и ППГ, а также HbA1c. Последний представлял собой основной параметр оценки эффективности в исследовании и снизился во время терапии с 8,35 ± 0,93 до 7,65 ± 1,70 % (p < 0,001). Доля пациентов со снижением HbA1c ≤ 6,5 % и/или HbA1c ≤ 7 % составила 65,79 % [10].
Выводы
Комбинированная терапия метформином и глимепиридом способна приводить к улучшению показателей углеводного обмена у больных СД2. Применение данной комбинации препаратов демонстрирует высокий уровень безопасности за счет низкого риска развития гипогликемий (симптоматических, ночных, бессимптомных и особенно тяжелых) и отсутствия других НЯ. Неоспоримым преимуществом такой терапии служит отсутствие прибавки массы тела, что позитивно сказывается на показателях углеводного обмена.



