Профессиональная бронхиальная астма (ПБА) – хроническое заболевание дыхательных путей, которое характеризуется обратимой обструкцией и/или гиперреактивностью бронхов, проявляется эпизодами затрудненного дыхания, свистами в груди, кашлем и этиологически обусловлено веществами, воздействующими на респираторный тракт на рабочем месте [1, 3]. Согласно Глобальной стратегии лечения и профилактики бронхиальной астмы (GINA – Global Initiative for Asthma, 2011), астма определяется как хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки: тучные, эзинофилы, Т-лимфоциты, альвеолярные макрофаги [5].
ПБА известна с начала XVIII в., когда была описана астма аптекарей (ипекакуановая астма), а также астма меховщиков при воздействии урсола.
Этиологические факторы и классификация
В соответствии с патогенезом выделяют следующие типы ПБA [2, 3]:
1. Иммунологическая ПБА или ПБА, связанная с гиперчувствительностью:
При ее возникновении необходим промежуток времени для развития сенсибилизации к этиологическому фактору и, следовательно, должен быть латентный период между воздействием этого фактора и появлением симптомов заболевания. В соответствии с этиологическими факторами выделяют следующие подтипы иммунологической ПБА:
• иммунологическая ПБА, вызванная высокомолекулярными соединениями; при этом задействованы иммунологические механизмы, включая иммуноглобулин Е (IgE);
• иммунологическая ПБА, вызванная низкомолекулярными соединениями; в этих случаях нет четкого подтверждения участия IgE.
2. Неиммунологическая ПБА, или ПБА, индуцированная ирритантами:
Этот тип ПБА является результатом раздражения или токсического поражения дыхательных путей. Развитие данного типа ПБА возможно в виде как синдрома реактивной дисфункции дыхательных путей, который вызывается однократными воздействиями высоких доз ирритантов и развивается в течение 24 часов от момента воздействия, так и ПБА, вызванной низкими дозами ирритантов, которая развивается после повторных контактов с низкими дозами этиологического фактора.
К высокомолекулярным соединениям, вызывающим иммунологическую ПБА, относятся белки животного происхождения, растительные протеины (мучная, зерновая, табачная пыль, пыль кофейных бобов). У работников хлебопекарной промышленности астму могут вызывать содержащиеся в муке белки злаковых; выявлены случаи сенсибилизации к продуктам переработки чая, чеснока, сои, а также к семенам клещевины, растительным клеям. К высокомолекулярным соединениям относятся также древесная пыль, краски (кармин), канифоль, энзимы (экстракт панкреатина, папаин, трипсин, пектиназа, амилаза, детергенты, выделенные из Bacillus subtilis), латекс, органические каучуки, резина [2–4, 6].
К развитию иммунологической ПБА, обусловленной низкомолекулярными соединениями, приводят изоцианаты – вещества, которые широко используются в производстве зольных красок, защитных покрытий и клеев. Наиболее значимы в качестве этиологического фактора такие соединения, как толуилендиизоцианат, гексаметилендиизоцианат, дифенилметил-диизоцианат. Возникновение иммунологической ПБА возможно при воздействии низкомолекулярных ангидридов, которому подвержены работники, занятые на производстве этих консервантов, а также разнообразных полимеров и пластмасс, клеев, красок и материалов для антикоррозийных покрытий. Металлы – никель, платина, хром и их соли, способны вызывать ринит, конъюнктивит и бронхиальную астму (БА), если поступают в дыхательные пути в респирабельной форме [2, 3] (табл. 1).
К факторам, приводящим к развитию неиммунологической ПБА, относятся хлор, продукты, образующиеся при гальванизации металлов, дым от сварки нержавеющей стали, от выплавки алюминия.
Существенную часть больных ПБА составляют медицинские работники (астму вызывают латекс, псилиум, дезинфекционные вещества – сульфатиазол, хлорамин, формальдегид, глутаральдегид; в анестезиологии – энфлуран), фармацевты (антибиотики, растительное лекарственное сырье), лаборанты (химические компоненты диагностических наборов, антибиотики, дезинфекционные вещества), работники вивариев (воздействие перхоти, слюны животных и белков мочи животных высокой молекулярной массы) и фармацевтических производств (антибиотики, метилдопа, циметидин, сальбутамол, пиперазин) [7–9].
Одной из причин БА у медицинских работников является растительный продукт латекс, особенно его порошковая форма, которая используется для припудривания резиновых перчаток. Первое описание перчаточной аллергии опубликовано в 1927 г. А с 1989 по 1993 г., по данным А. Heese, число случаев тяжелой аллергии на латекс возросло в 8,4 раза, при этом увеличилась доля тяжелых форм.
Патогенез
Сенсибилизирующие вещества с высоким молекулярным весом (5000 дальтонов [Da] или более) часто действуют посредством IgE-зависимого механизма. Сенсибилизирующие вещества с низким молекулярным весом (менее 5000 Da), к которым относятся высокореактивные вещества типа эфиров изоциановой кислоты, могут действовать посредством IgE-независимых механизмов либо вести себя как гаптены, соединяясь с протеинами организма. Если у рабочего выявляется сенсибилизация, повторное воздействие сенсибилизирующего вещества (интенсивность которого часто бывает ниже того уровня, который вызвал сенсибилизацию) приводит к воспалительным процессам в дыхательных путях, что часто сопровождается повышением непроходимости дыхательных путей и неспецифическими бронхиальными реакциями.
К высокомолекулярным соединениям, способным вызывать сенсибилизацию, относятся белки, которые являются полными антигенами [10, 11]. Кроме того, некоторые белки обладают ферментной активностью, облегчающей пенетрацию антигена [12]. В противоположность аллергенным белкам низкомолекулярные соединения, провоцирующие ПБА, обычно являются неполными антигенами (гаптенами) и для запуска иммунного ответа должны соединяться с другими молекулами [36]. Эти вещества характеризуются высокой реактогенностью и могут связываться с определенными участками белковых молекул в дыхательных путях [13].
IgE1-зависимые механизмы
Большинство высокомолекулярных соединений, вызывающих ПБА, представляет собой белки или гликопротеины животного либо растительного происхождения, которые действуют через IgE-опосредованные механизмы. Они являются полными антигенами и стимулируют выработку IgE. Тем не менее некоторые низкомолекулярные вещества (например, кислые ангидриды и соли платины) обладают свойствами гаптенов и соединяются с белком-носителем, образуя гаптен-белковый комплекс, который также стимулирует синтез IgE. При вдыхании эти вещества связываются со специфическим IgE, находящимся на поверхности тучных клеток и базофилов, запуская последовательность клеточных реакций. Это ведет к высвобождению и синтезу медиаторов и миграции, а также активации воспалительных клеток, которые формируют воспалительную реакцию в дыхательных путях, характерную для астмы, вызывают развитие процессов ремоделирования дыхательных путей, провоцируют бронхоконстрикцию и гиперреактивность дыхательных путей [11].
IgE1-независимые механизмы
Большинство низкомолекулярных соединений, вызывающих ПБА, действуют через механизмы, которые, вероятно, являются иммунными, но не включают IgE [11]. Специфические IgG- и IgG4-антитела, по-видимому, связаны с уровнем воздействия в бoльшей степени, чем с заболеванием как таковым. Возможно, в этих случаях задействована клеточная гиперчувствительность или гиперчувствительность замедленного типа [14]. CD4-лимфоциты играют поддерживающую роль в продукции IgE за счет В-лимфоцитов и также могут индуцировать воспаление через секрецию интерлейкина-5 (ИЛ-5), который является мощным стимулятором, активатором эозинофилов и основным цитокином, участвующим в миграции и активации эозинофилов во время отсроченной астматической реакции [15]. Повышение числа активированных Т-лимфоцитов (которые экспрессируют рецептор для ИЛ-2), активированных эозинофилов и тучных клеток обнаружено в бронхобиоптатах больных ПБА, вызванной низкомолекулярными соединениями [16, 17].
При ПБА ряд факторов роста, таких как фактор роста тромбоцитов (PDGF – Platelet-derived growth factor) и трансформирующий фактор роста-β (TGFb – Transforming Growth Factor Beta), могут стимулировать фиброгенез путем активации фибробластов и депозиции коллагеновых волокон в собственной пластинке слизистой оболочки бронхов.
Клиническая картина
ПБА часто проявляется внезапно. Для ПБА характерны зависимость возникновения болезни от интенсивности и длительности экспозиции причинного фактора, возникновение симптомов во время и после воздействия аллергенов и химических веществ на рабочем месте, отсутствие предшествующей респираторной симптоматики, сочетание астмы с другими клиническими проявлениями профессиональной аллергии (со стороны кожи, верхних дыхательных путей) [2–4, 8].
Так, по данным Е.В. Петровской [19], ПБА, вызванная контактом с высокомолекулярными веществами, в 57,3 % случаев сочетается с аллергическим ринитом, в 16,6 % – с аллергическим дерматитом. При контакте с низкомолекулярными соединениями аллергический ринит встречается в 31,3 %, аллергический дерматит – в 18,8 % случаев. При контакте с токсическими веществами в 28,0 % случаев выявляются поражения верхних дыхательных путей в виде ринофаринголарингита.
Среди некоторых пациентов еще до развития приступа бронхиальной обструкции (во время выполнения работы) отмечаются затруднение дыхания, приступообразный кашель, нерезко выраженное удушье, наличие признаков аллергического ринита, чихание, чувство першения и щекотания в горле. В межприступном периоде наблюдается экспираторная одышка с характерным положением, которое занимает больной; при перкуссии выслушивается коробочный звук, подвижность нижних краев легких ограничена, при аускультации легких определяются сухие хрипы на вдохе и выдохе, меняющие свою интенсивность и локализацию. Во время приступа дыхательные шумы могут не прослушиваться. Кожные покровы бледные, сухие, вспомогательные мышцы напряжены; отмечаются тахикардия, глухость сердечных тонов; определение границ относительной сердечной тупости затруднено из-за эмфиземы. Приступ удушья заканчивается отхождением вязкой, чаще прозрачной мокроты.
С учетом клинической симптоматики перед началом лечения различают следующие виды ПБА:
• интермиттирующую – cимптомы наблюдаются реже одного раза в неделю, обострения кратковременные, ночные симптомы не чаще двух раз в месяц, объем форсированного выдоха за 1-ю секунду (ОФВ1) или пиковая объемная скорость выдоха (ПОСвыд) ≥ 80 % от должных значений, вариабельность ПОСвыд или ОФВ1 < 20 %);
• легкую персистирующую – симптомы чаще одного раза в неделю, но реже одного раза в день, обострения могут нарушать активность и сон, ночные симптомы чаще двух раз в месяц, ОФВ1 или ПОСвыд ≥ 80 % от должных значений, вариабельность ПОСвыд или ОФВ1 ≤ 30 %;
• персистирующую средней тяжести – симптомы ежедневные, обострения могут нарушать активность и сон, ночные симптомы чаще одного раза в неделю, ежедневный прием ингаляционных β2-агонистов короткого действия, ОФВ1 или ПОСвыд 60–80 % от должных значений, вариабельность ПОСвыд или ОФВ1 > 30 %;
• тяжелую персистирующую – симптомы ежедневные, частые обострения, частые ночные симптомы ПБА, ограничение физической активности, ОФВ1 или ПОСвыд ≤ 60 % от должных значений, вариабельность ПОСвыд или ОФВ1 > 30 %.
Для ПБА характерен эффект элиминации (периодичность респираторных симптомов с улучшением состояния в выходные дни и в отпускной период), эффект реэкспозиции (ухудшение субъективного состояния и увеличение выраженности респираторных симптомов после возвращения на рабочее место – контакт с аллергенами), обратимый характер бронхиальной обструкции (кашля, одышки и свистящего затрудненного дыхания).
Следует отметить, что не всегда присутствует прямая зависимость между концентрацией профессиональных сенситизаторов в воздухе рабочих помещений и вероятностью развития ПБА, а также тяжестью ее обострений [9].
По клинической картине к ПБА близок биссиноз (впервые описан Greenbow, 1861) – своеобразное профессиональное заболевание, возникающее при длительном вдыхании волокнистой растительной пыли (хлопка, льна и пеньки; от byssos – лен) и клинически характеризующееся своеобразным, быстропроходящим бронхоспастическим синдромом [3–4].
По уровню контроля ПБА делится на контролируемую, частично-контролируемую, неконтролируемую (табл. 2).
Примечание. ГКС – глюкокортикостероиды.
* От должного значения или лучшего для пациента (если нет данных о должном).
Обострения ПБА бывают легкими, средней тяжести и тяжелыми [5]. Тяжесть обострения определяется на основании выраженности клинических симптомов, наличия свистящего дыхания, положения больного, частоты дыхания, частоты сердечных сокращений (ЧСС), параметров ПОСвыд, текущего содержания кислорода в крови – SpO2 (табл. 3).
На фоне ПБА возможно развитие астматического статуса, эмфиземы легких, пневмосклероза, хронического легочного сердца, дыхательной недостаточности и бронхоэктазий.
Диагностика
Диагноз “профессиональная бронхиальная астма” может связать с профессией только специализированное профпатологическое учреждение (профцентр, НИИ профессиональных заболеваний, кафедра и клиника болезней медицинского вуза).
При диагностике ПБА учитывают субъективные данные (жалобы больного), данные объективного обследования, результаты лабораторных, инструментальных и функциональных методов исследования от общих до специальных (рентгенография органов грудной полости, исследование мокроты, исследование функции внешнего дыхания). При необходимости проводят также компьютерную (КТ), магнитно-резонансную (МРТ) томографию легких, консультации пульмонолога, фтизиатра, аллерголога-иммунолога.
Степень выраженности бронхообструктивного синдрома оценивается по скоростным и объемным параметрам функции внешнего дыхания. Особенно ценная информация о состоянии бронхов может быть получена при изучении скоростных показателей пневмотахограммы и вязкостного дыхательного сопротивления – комплексного критерия бронхиальной обструкции. Применяется также динамическая пикфлоуметрия во время и после работы.
Одним из надежных способов специфической диагностики ПБА от химических гаптенов является провокационная ингаляционная проба с минимальными концентрациями водных растворов химических аллергенов, что исключает неспецифическое воздействие запаха и раздражающих свойств, присущих многим сенсибилизаторам [3, 4, 8]. Если вещество, раствор антигена ингалируется через небулайзер в виде аэрозоля в возрастающих концентрациях. Через 10 минут после каждой ингаляции проводят форсированную спирометрию. Результат считается положительным, если ОФВ1 снижается не менее чем на 20 %. Если результат отрицательный, пациенты для ингаляции используют максимальную концентрацию. Важно мониторировать ОФВ1 каждый час в течение 24 часов после ингаляции для выявления отсроченной реакции.
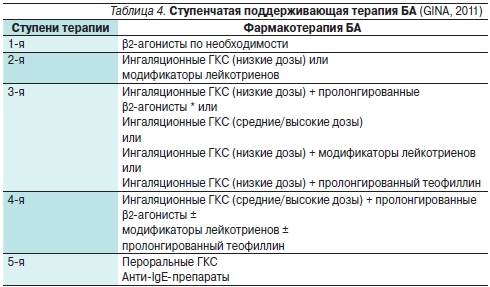
* Могут быть эффективными пролонгированные холинолитики.
Если вещество нерастворимо, пробу проводят в провокационной камере. В этом случае пациент подвергается воздействию нераздражающих концентраций предполагаемого этиологического фактора. Если возможно, следует измерить концентрацию этого вещества. Длительность воздействия варьируется в зависимости от вещества и характеристик пациента. Результаты считаются положительными при снижении ОФВ1 более чем на 20 %. Если тест отрицательный, воздействие повторяют в течение более длительного времени или с более высокими концентрациями вещества.
При невозможности проведения провокационных проб из-за тяжелого состояния больного рекомендуется использовать тест торможения естественной миграции лейкоцитов (“полоскательный тест”), принцип которого был разработан А.Д. Адо в 1980 г. и основан на изменении миграции лейкоцитов в ротовую полость после полоскания слабым раствором аллергена. Этот тест особенно рекомендуется при подозрении на лекарственную аллергию [9, 18].
Для подтверждения профессионального генеза БА необходимо определять в сыворотке уровень общего IgE и аллерген-специфические IgE (с помощью кожного тестирования, иммуноферментного анализа, радиоаллергосорбентного теста – РАСТ). При ПБА чаще всего отмечается повышение концентрации общего IgE в 5–7 раз и отсутствие в сыворотке аллергенспецифических IgE на основные группы непрофессиональных аллергенов (бытовых, пыльцевых, грибковых) [19].
Кроме того, с помощью иммунологических тестов определяют показатель специфического повреждения базофилов, уровень специфических антител в реакции связывания комплемента со специально подобранными дозами гаптенов. Кожное или серологическое (например, РАСТ) тестирование может продемонстрировать иммунологическую сенсибилизацию в ответ на воздействие определенного вещества.
Лучше всего иммунологическая оценка подходит веществам, для которых существуют стандартные тесты in vitro или покалывающие кожу реагенты, такие как соли платины и детергентные ферменты. Использование при тестировании растворов непромышленного производства часто вызывает тяжелые последствия, включая анафилактический шок, поэтому необходимо соблюдать осторожность.
Следует определять коэффициент сенсибилизации СД45+-лимфоцитов к производственным аллергенам и уровни Ил-4, -8 в сыворотке крови [19].
При ПБА в периферической крови обнаруживается абсолютный (или относительный) эозинофильный лейкоцитоз.
При обследовании больных ПБА могут быть также использованы фибробронхоскопия (при возможности проведения исходя из клинического состояния), рентгенография легких, КТ и МРТ легких (в целях дифференциальной диагностики для выявления интерстициальных процессов в легких как причины бронхообструктивного синдрома).
Для юридически обоснованной связи заболевания с профессией пациент с подозрением на профессиональный генез БА кроме направления должен представить в специализированное профпатологическое учреждение копию трудовой книжки (профессия, стаж), выписку из амбулаторной карты, карты периодических медицинских осмотров (подтверждают момент возникновения того или иного заболевания), санитарно-гигиеническую характеристику условий труда.
Санитарно-гигиеническая характеристика условий труда, составленная Роспотребнадзором при получении из лечебно-профилактического учреждения извещения о подозрении на профессиональное заболевание, содержит санитарно-гигиенические условия труда пациента, т. н. профессиональный маршрут (все места работы и ее продолжительность на том или ином участке), свойства, присущие данному виду аллергена (гидрофильность пыли или химического агента, раздражающее или сенсибилизирующее действие, наличие превышений предельно допустимой концентрации).
Лечение
При ПБА, даже на ранних стадиях болезни, необходимо отстранять пациента от работы, связанной с воздействием профессиональных аллергенов.
Патогенетическая терапия основывается на выявлении ведущего типа аллергической реакции и оказании блокирующего действия на развитие каждой стадии. Особое внимание при этом должно быть обращено на механизмы иммунологических реакций: торможение образования или освобождения биологически активных веществ, угнетение образования антител, взаимодействие с рецепторами клеток, гипосенсибилизацию, стимуляцию образования блокирующих антител. Назначают такие десенсибилизирующие препараты, как хлоропирамин, клемастин, цетиризин, фексофенадин и др.
В настоящее время в связи с появлением новых групп лекарственных препаратов, в т. ч. ингаляционных форм глюкокортикостероидов (ГКС), существенно изменились принципы рациональной фармакотерапии БА, разработана и внедрена в клиническую практику ступенчатая терапия астмы (GINA, 2011) с учетом этиологического фактора, данных иммунологического обследования, индивидуальных особенностей пациента [2, 5, 20, 21].
Первая ступень терапии в первую очередь применяется для пациентов с эпизодическими, кратковременными приступами (кашель, свистящие хрипы ≤ 2 раз в неделю или более редкие ночные симптомы), что соответствует определению контролируемой БА. В межприступный период жалобы на ночные пробуждения и вышеупомянутые симптомы отсутствуют, а показатели внешнего дыхания находятся в норме. При ухудшении состояния назначают ингаляционные ГКС, что означает переход на вторую ступень терапии. Если терапия, которую получает пациент, оказывается малоэффективной, нужно перейти на ступень выше (например, если пациент находится на 2-й ступени и лечение не дает должного эффекта, нужно перейти на ступень 3 и т. д.). И наоборот, если в течение 3 месяцев сохраняется хороший контроль БА, можно перейти на ступень ниже.
Во время обострения астмы, развития астматического статуса пациенту показаны препараты, купирующие приступ бронхиальной обструкции. К ним относятся ингаляционные β2-агонисты короткого действия (сальбутамол, фенотерол), подаваемые с помощью небулайзера; системные ГКС (парентеральное и пероральное введение), адреналин (эпинефрин). Иногда хороший эффект дает введение 2,4 %-ный раствор аминофиллина в вену в 10–20 мл изотонического раствора натрия хлорида.
Важное место в системе терапевтических мероприятий занимает специальное питание с исключением высокоаллергенных продуктов и разгрузочно-диетические дни.
Профилактика
В системе профилактики ПБА особую роль играют предварительные (при поступлении на работу) и периодические медицинские осмотры. Периодические медицинские осмотры проводят 1 раз в год с обязательным участием профпатолога, терапевта, пульмонолога, аллерголога-иммунолога, дерматовенеролога, оториноларинголога, согласно Приказу МЗ и МП РФ “Об утверждении перечней вредных и (или) опасных производственных факторов и работ”, при выполнении которых проводятся предварительные и периодические медицинские осмотры (обследования), и Порядка проведения предварительных и периодических медицинских осмотров (обследований) работников, занятых на тяжелых работах и на работах с вредными и (или) опасными условиями труда № 302н от 12.04.2011; периодически проводят также аллергологическое обследование работающих.
Медицинскими противопоказаниями к работе в контакте с профессиональными аллергенами являются аллергические заболевания, тотальные дистрофические заболевания верхних дыхательных путей, хронические заболевания бронхолегочного аппарата, искривление носовой перегородки, врожденные аномалии органов дыхания, хронические очаги инфекции.
Большая роль в профилактике ПБА принадлежит дальнейшему совершенствованию технологических процессов с целью снижения загрязнения воздуха рабочей зоны промышленными аллергенами, регулярном использовании исправных коллективных средств защиты (прежде всего эффективной проточно-вытяжной вентиляции), а также индивидуальных средств защиты (масок, лепестков, респираторов)
Медико-социальная экспертиза
Наличие хотя бы одного приступа удушья, доказательно связанного с воздействием профессиональных аллергенов, является показанием к немедленному прекращению контакта с потенциальными производственными аллергенами [1–4]. При подтверждении профессионального генеза БА больной направляется на медико-социальную экспертизу. Бюро медико-социальной экспертизы признает больного нетрудоспособным в своей профессии, определяет степень утраты общей трудоспособности (при наличии медицинских оснований – группу инвалидности), устанавливает нуждаемость в реабилитационных мероприятиях: реабилитационном, санаторно-курортном лечении, обеспечении лекарственными средствами для лечения ПБА и ее осложнений, средствами доставки (небулайзер) и контроля эффективности лекарственных средств (пикфлоуметр), при необходимости кислородотерапии (обеспечение кислородным концентратором), выясняет нуждаемость в профессиональном переобучении. При этом все соответствующие расходы покрывает Фонд социального страхования.



