Введение
Инфекция мочевых путей (ИМП) – одно из наиболее часто встречающихся заболеваний в популяции вслед за острыми респираторными заболеваниями и инфекциями верхних дыхательных путей. Термином «инфекция мочевых путей» обозначается неспецифический инфекционный процесс в различных отделах мочевой системы без точного указания топики поражения. Таким образом, ИМП – это собирательное понятие, не являющееся самостоятельной нозологической формой, но объединяющее поражение верхних (пиелонефрит, абсцесс, карбункул почки), нижних (цистит, уретрит) мочевых путей и асимптоматическую (бессимптомную) бактериурию. Пиелонефрит – инфекционно-воспалительное заболевание с преимущественным поражением интерстициальной ткани и чашечно-лоханочной системы почки; цистит – воспалительное заболевание стенки мочевого пузыря бактериального происхождения; уретрит – воспаление стенки мочеиспускательного канала (уретры). Бессимптомной бактериурией, согласно последним Российским клиническим рекомендациям, обозначают бактериурию, обнаруженную при диспансерном или целенаправленном обследовании пациента без каких-либо жалоб или клинических симптомов заболевания мочевой системы [1].
Распространенность ИМП в детском возрасте составляет около 18 случаев на 1000 детского населения. У детей грудного и раннего возраста ИМП – самая частая бактериальная инфекция, наблюдающаяся у 10–15% госпитализируемых этого возраста. До 3-месячного возраста ИМП чаще встречается у мальчиков, в более старшем возрасте – у девочек. В младшем школьном возрасте ИМП обнаруживается у 7,8% девочек и у 1,6% у мальчиков [1, 2].
Классификация ИМП
В последние годы укрепилась тенденция подразделять ИМП на осложненную и неосложненную. Неосложненная ИМП, как правило, возникает у людей без признаков обструкции и структурных изменений в почках и мочевыводящих путях, в то время как осложненные ИМП развиваются у больных обструктивными уропатиями, мочекаменной болезнью, поликистозом почек, доброкачественной гиперплазией предстательной железы, на фоне катетеризации мочевого пузыря и/или при инструментальных (инвазивных) методах исследования мочевых путей, а также у лиц с сопутствующими обменными заболеваниями (сахарный диабет, подагра и др.). Таким образом, термин «неосложненная ИМП» соответствует традиционному термину «первичная», «осложненная» – термину «вторичная». В детском возрасте вторичные (осложненные) ИМП чаще всего развиваются на фоне морфофункциональных нарушений органов мочевой системы: аномалий развития почек и мочевыводящих путей, дисфункции мочевого пузыря, пузырно-мочеточникового рефлюкса и др.
По течению ИМП подразделяют на острые и хронические (рецидивирующие).
Критерии хронической (рецидивирующей) ИМП:
- наличие признаков активности процесса в течение более 6 месяцев;
- возникновение 2 эпизодов заболевания в течение 6 месяцев;
- возникновение 4 обострений в течение 1 года.
Рецидивирующее течение чаще всего наблюдается при вторичной (осложненной) ИМП и встречается у 25% детей первого года жизни независимо от пола [3]. С возрастом после первого перенесенного эпизода ИМП возрастает относительный риск развития рецидива, поэтому мальчикам после одного, а девочкам после двух эпизодов ИМП показано полное обследование органов мочевой системы [4].
С клинической точки зрения важно выделение фебрильной и афебрильной ИМП [3]. Фебрильная ИМП преимущественно указывает на поражение верхних мочевых путей (пиелонефрит), афебрильная – на поражение нижних мочевых путей (цистит). Однако такое разделение весьма условно, особенно в отношении детей, поскольку инфекция нижних мочевых путей также может протекать с лихорадкой, пиелонефрит – без выраженных симптомов интоксикации.
Этиология и патогенез ИМП
Основным этиологическим фактором развития ИМП является уропатогенная микрофлора, а состав возбудителей зависит от характера течения ИМП, места возникновения, возраста и пола пациента. В подавляющем большинстве случаев неосложненную ИМП вызывают грамотрицательные микроорганизмы семейства Enterobacteriacae (грамотрицательные палочки), основным среди которых является Escherichia coli. В этиологической структуре неосложненной ИМП у детей доля E. сoli составляет более 80%, в то время как Staphylococcus saprophyticus, Klebsiella spp., Proteus mirabilis. Enterobacter и др. выделяют значительно реже [1, 5]. При рецидивирующем течении ИМП в этиологической структуре возрастает доля микробных ассоциаций, что затрудняет диагностику и лечение ИМП.
Для возникновения воспалительного процесса важны вид возбудителя, его вирулентность и склонность микроорганизма к адгезии, реализующейся благодаря наличию специальных адгезивных механизмов, таких как фимбрии, пили и жгутики, способствующие колонизации на поверхности уроэпителия и продвижению вверх против тока мочи, а также способность микроорганизмов вырабатывать факторы, повреждающие эпителий мочевых путей.
Попадание микроорганизмов в органы мочевой системы возможно гематогенным, лимфогенным и восходящим путями [6]. В подавляющем большинстве случаев при развитии ИМП реализуется восходящий путь инфицирования: из мочеиспускательного канала в мочевой пузырь – при цистите, из мочеточника в почку – при пиелонефрите. Гематогенный путь инфицирования в основном встречается у детей в период новорожденности и грудном возрасте, при наличии септицемии или иммунодефицитных состояний. У новорожденных детей относительно частой причиной инфекций мочевыводящих путей служат стрептококки групп А и В, S. saprophyticus. Гематогенный путь инфицирования характерен также для Actinomyces species, Brucellа spp., Mycobacterium tuberculosis [1]. Лимфогенно микроорганизмы попадают в органы мочевой системы, минуя уретру, путем т.н. транслокации из кишечника. В этом случае бактерии, обладая высокой уропатогенной активностью, не встречают адекватного иммунобиологического барьера со стороны слизистой оболочки кишечника и в лимфатических путях или вызывают нарушение почечной гемодинамики с последующим ослаблением иммунобиологического барьера как в целом, так и in situ [7].
Мочевая система обладает защитными механизмами, предотвращающими проникновение возбудителя и развитие инфекционного процесса. Основные факторы, препятствующие инфицированию мочевых путей [6, 8]:
- нормальный пассаж мочи (удаление при мочеиспускании инфицированной мочи и смыв микробов со стенок мочевого пузыря), везикоуретральные клапаны;
- физико-химические свойства мочи (низкий рН и колебания осмолярности мочи, высокое содержание мочевины и органических кислот);
- наличие гликозаминогликанов на поверхности мочевого пузыря и присутствие в подслизистом слое макрофагов;
- протяженность уретры у мужчин;
- с началом полового созревания – секрет предстательной железы у юношей и вагинальный секрет у девушек, ингибирующие размножение бактериальной флоры.
Любое нарушение этих механизмов создает благоприятные условия для проникновения бактерий и колонизации ими слизистой оболочки мочевых путей. Однако, несмотря на важность иммунных и метаболических нарушений в патогенезе ИМП, ведущая роль в возникновении микробно-воспалительного процесса в органах мочевой системы принадлежит нарушениям уродинамики [3]. Наиболее значимым и часто встречающимся из них является пузырно-мочеточниковый рефлюкс [9, 10]. В отношении мальчиков также возможно сочетание пузырно-мочеточникового рефлюкса с задним клапаном уретры, что существенно осложняет течение и исход ИМП [3, 10]. Явления дизэмбриогенеза почечной ткани (незрелость нефронов, микрообструкция, наличие ишемических очагов в паренхиме почек) предрасполагают к развитию воспалительного процесса в верхних отделах мочевой системы [3, 11, 12].
При проникновении возбудителей в почечную паренхиму происходит их быстрое размножение с выделением эндотоксинов, что вызывает активацию местных защитных факторов (макрофагов, лимфоцитов, клеток эндотелия), реализующуюся в выработке воспалительных цитокинов, лизосомальных ферментов, интенсификации процессов перекисного окисления липидов. Развивающийся воспалительный процесс, направленный на предотвращение распространения инфекции, приводит к повреждению почечной ткани, в первую очередь канальцев [1]. Часто рецидивирующее микробное воспаление или персистирование микроорганизмов в почечной паренхиме неизбежно приводит к развитию нефросклероза и почечной недостаточности.
Клиническая картина и диагностика ИМП
ИМП может протекать как ярко, так и малосимптомно. Как правило, острый процесс характеризуется яркой клинической картиной, тогда как рецидивы зачастую протекают клинически стерто.
Клинические симптомы ИМП у детей неспецифичны и могут различаться в зависимости от возраста и степени тяжести заболевания. Для новорожденных и детей грудного возраста в большинстве случаев характерно выраженное превалирование симптомов общей интоксикации над местными проявлениями, даже при инфекции нижних мочевых путей, однако у некоторых детей клинические проявления могут быть маловыраженными, что затрудняет своевременную диагностику. В первые 3 месяца жизни ИМП у детей чаще проявляется такими неспецифическими симптомами, как сонливость, возбудимость, рвота, понос, лихорадка или гипотермия, снижение массы тела, замедление темпов физического развития.
Начиная с 2-летнего возраста клиническая картина инфекции нижних мочевых путей все больше проявляется местной симптоматикой: учащенным мочеиспусканием, дизурией, болью в надлобковой области, животе, лихорадка чаще носит характер субфебрильной или не развивается вовсе [3, 6, 12]. Для детей этого возраста довольно типично развитие на фоне цистита недержания или неудержания мочи, которое у большинства быстро проходит по мере купирования воспалительного процесса.
Для пиелонефрита характерны выраженные признаки общей интоксикации (фебрильная лихорадка, озноб, вплоть до потрясающего, слабость, вялость, заторможенность), у детей раннего возраста может развиваться инфекционный токсикоз с эксикозом. Дети предъявляют жалобы на боли в поясничной области или животе, дизурию (вследствие сопутствующего цистита или уретрита), изменение цвета и запаха мочи. Тяжелое течение пиелонефрита с угрозой развития сепсиса более вероятно также у детей, получающих иммуносупрессивную терапию, у больных острым обструктивным пиелонефритом, у которых чаще возникает бактериемический шок с падением артериального давления, снижением адекватной перфузии почек и развитием острой почечной недостаточности.
Клиническая картина рецидива пиелонефрита у детей сходна с клиникой острого пиелонефрита, но зачастую выражена менее интенсивно. Нередко единственным проявлением является изолированный мочевой синдром.
Основным лабораторным критерием ИМП служит лейкоцитурия, выявляемая по данным общего анализа мочи и/или исследования мочевого осадка. Гематурия и протеинурия также часто обнаруживаются при ИМП, однако не являются основополагающими, хотя при геморрагическом цистите может наблюдаться и макрогематурия. Изменения в общем анализе крови при пиелонефрите свидетельствуют о бактериальном воспалении: увеличение скорости оседания эритроцитов, нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево, иногда лейкопения, у некоторых пациентов – анемия. Аналогичные изменения в крови можно обнаружить и при цистите у детей младшего возраста.
Дифференциальная диагностика поражений верхних и нижних мочевых путей иногда представляет собой сложную задачу, особенно в отношении детей грудного и младшего возраста. В старшем возрастном периоде клиническая картина становится более типичной (табл. 1).
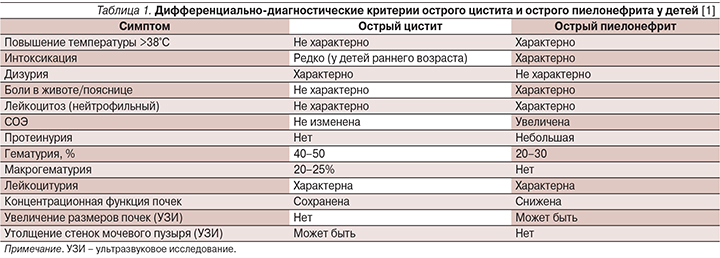
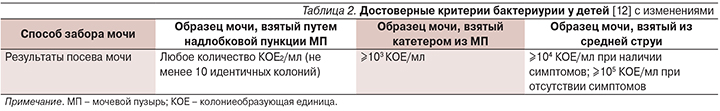
Бессимптомную бактериурию выявляют случайно или в результате скрининга, при этом жалобы, клинические, лабораторные и инструментальные признаки заболевания и нарушения функции почек и мочевых путей отсутствуют. Достоверно бактериурия подтверждается только результатами посева мочи (табл. 2). Обнаружение бактерий при микроскопии образца мочи не имеет самостоятельного диагностического значения.
Важную роль в диагностике ИМП играют инструментальные методы исследования, из которых наиболее безопасным и доступным в детском возрасте является УЗИ: его можно проводить в любом возрасте и при высокой активности воспалительного процесса. Метод позволяет оценивать размеры почек и изменения чашечно-лоханочной системы, объем и состояние стенки мочевого пузыря, заподозрить наличие аномалий строения мочевой системы, наличие конкрементов и др.
Рентгеноконтрастные методы исследования (внутривенная урография, цистография) позволяют получать более точную картину строения мочевых путей, выявлять пузырно-мочеточниковый рефлюкс, однако их применение ограниченно при высокой активности микробно-воспалительного процесса и сниженной функции почек. Для оценки состояния почечной паренхимы, выделительной функции почек, выявления рефлюксов также используются радиоизотопные исследования (статическая и динамическая сцинтиграфия).
Эндоскопические методы исследования (цистоскопия) применяются для оценки характера изменений слизистой мочевого пузыря.
Мультиспиральная компьютерная томография и магнитно-резонансная томография для диагностики ИМП у детей применяются редко, однако необходимость в их проведении может возникать при сохранении у пациента лихорадки более 72 часов от начала терапии для исключения камней, структурных изменений, абсцессов почки или паранефрального пространства.
Лечение ИМП у детей
В большинстве случаев лечение ИМП у детей проводится в амбулаторных условиях.
Показания к госпитализации ребенка с выявленной ИМП: возраст до двух лет, симптомы дегидратации и инфекционного токсикоза, повторные рвоты, выраженный болевой синдром, задержка мочи, бактериемия и сепсис.
При остром пиелонефрите рекомендуется постельный режим на период лихорадки с дальнейшим переходом на общий. Необходимо соблюдение режима «регулярных» мочеиспусканий (через 2–3 часа в зависимости от возраста). При других вариантах ИМП особых требований к режиму нет.
Диета при остром пиелонефрите назначается по возрасту, сбалансированная по основным питательным элементам, без ограничений по белку. Ограничивается потребление экстрактивных веществ и соли. В отсутствие обструкции назначается обильное питье (на 50% больше возрастной нормы), слабощелочные минеральные воды (Славяновская, Смирновская и т.д.) из расчета 2–3 мл/кг массы на прием.
Основные цели лечения ИМП:
- эрадикация возбудителя из мочевых путей;
- купирование симптомов (лихорадка, дизурия и др.);
- нормализация лабораторных показателей;
- коррекция нарушений уродинамики;
- профилактика развития рецидива ИМП и нефросклероза.
Основой терапии ИМП служит антибиотикотерапия, при этом решающее значение в выборе антибактериального препарата имеет чувствительность возбудителей к антибиотику. Препараты для лечения ИМП должны обладать высокой антибактериальной активностью, широким спектром действия, отсутствием нефротоксичности, оказывать преимущественно бактерицидное действие, а также выделяться с мочой в высоких концентрациях.
Стартовая антибактериальная терапия ИМП всегда осуществляется эмпирически. Как правило, препаратами выбора для лечения ИМП у детей являются амоксициллин/клавуланат, цефалоспорины III–IV поколений, фосфомицина трометамол, нитрофурантоин [6, 12]. В условиях стационара в отношении новорожденных и детей грудного возраста могут использоваться аминогликозиды [11].
Амоксициллина/клавуланат обладает высокой активностью по отношению к основным возбудителям ИМП у детей и служит препаратом выбора при лечении неосложненной инфекции ИМП в амбулаторных условиях. Долгое время к одним из основных его преимуществ перед другими антибиотиками, особенно цефалоспоринового ряда, относилось наличие пероральных форм препарата, что особенно важно при лечении детей. Амоксициллина/клавуланат назначается из расчета 50 мг/кг/сут (по амоксициллину) в два приема, для детей младшего возраста используется форма суспензии [13].
Цефалоспорины III–IV поколений высокоэффективны в отношении микроорганизмов семейства Enterobacteriaceae, устойчивы к действию β-лактамаз, имеют длительный период полувыведения. Появление пероральных форм значительно расширило применение цефалоспоринов III поколения в лечении ИПМ у детей в амбулаторных условиях. Одним из наиболее часто назначаемых пероральных цефалоспоринов III поколения является цефиксим. Препарат угнетает синтез клеточной мембраны возбудителя, обладает бактерицидным действием и устойчив к действию β-лактамаз [14]. Цефиксим активен в отношении большого количества грамположительных и грамотрицательных бактерий, основных возбудителей ИМП у детей, в т.ч. вызванных полирезистентной флорой. Препарат прост в дозировании, принимается 1–2 раза в сутки, назначается из расчета 8 мг/кг/сут или по 4 мг/кг каждые 12 часов. Стандартная доза для лечения ИМП у пациентов с массой тела более 50 кг составляет 1 таблетку (400 мг) один раз в сутки или по 200 мг каждые 12 часов. При массе тела от 25 до 50 кг цефиксим можно принимать по 200 мг один раз в сутки. В отношении детей младшего возраста цефиксим применяется в форме суспензии [13–15].
Цефиксим может использоваться на пероральном этапе ступенчатой терапии после применения парентеральных цефалоспоринов III–IV поколений. Препарат соответствует высоким критериям безопасности, случаи развития побочных эффектов после приема цефиксима регистрируются редко [13].
Использование налидиксовой кислоты и нитрофурантоинов имеет определенные недостатки в связи с необходимостью применения этих препаратов 3–4 раза в сутки, а также слабой активностью нитрофурантоина в отношении Proteus spp., налидиксовой кислоты – в отношении S. saprophyticus [13, 16].
Длительность антибактериальной терапии зависит от особенностей ИМП. В детском возрасте по сравнению с взрослыми антибактериальная терапия пиелонефрита проводится более длительным курсом, причем чем младше ребенок, тем длиннее может быть курс терапии. Это связано с несовершенством общего иммунитета и местных факторов защиты мочевых путей, наличием анатомических и длительно сохраняющихся функциональных вариантов обструкции току мочи, что создает предпосылки для возникновения рецидивов ИМП. Поэтому лечение острого неосложненного пиелонефрита проводится в два этапа – стартовая антибиотикотерапия (14–20 дней), затем длительная противорецидивная терапия уросептиками. Длительность курса антибактериальной терапии при лечении острой инфекции нижних мочевых путей у детей составляет 7–10 дней. Однократное применение парентерального препарата при неосложненной ИМП возможно лишь в случае сомнительной приверженности лечению и отсутствии аномалий развития мочевых путей [3, 6, 15].
При острой осложненной ИМП или при наличии факторов риска применяются те же антимикробные препараты, что и при неосложненной ИМП, однако длительность терапии увеличивается [6, 15].
Для противорецидивной терапии детей используются производные 5-нитрофурана (фуразидин), производные пипемидиновой кислоты, налидиксовой кислоты, производные 8-оксихинолина. Фторированные хинолоны в детском возрасте применяются только по жизненным показаниям [6].
При хронических и рецидивирующих инфекциях мочевых путей у детей в качестве профилактического средства применяются различные сборы лекарственных трав. Они, как правило, назначаются на долгий период, с чередованием преимущественно бактерицидных и мочегонных сборов. Курс терапии составляет 2–6 недель и при необходимости может быть продлен.
Диспансерное наблюдение и прогноз
Диспансерное наблюдение за детьми, перенесшими острый пиелонефрит, осуществляется в течение 5 лет в случае однократного эпизода болезни. При рецидивирующем течении заболевания ребенок наблюдается до перехода во взрослую сеть с обязательным ежегодным обследованием, включающим общие анализы крови и мочи, пробу по Нечипоренко, пробу Зимницкого, биохимический анализ крови и расчет скорости клубочковой фильтрации, измерения артериального давления, УЗИ почек и мочевых путей.
Неосложненная ИМП, включая неосложненный пиелонефрит, при своевременном лечении имеет благоприятный прогноз. При осложненной ИМП прогноз определяется в первую очередь характером нарушений, приведших к развитию ИМП (аномалии развития мочевой системы, степень нарушения уродинамики и др.), без устранения которых риск рецидива ИМП будет сохраняться постоянно. Прогноз ухудшается при несвоевременно начатой противомикробной терапии, постоянно рецидивирующих ИМП.



