Введение
Сахарный диабет 2 типа (СД2) является серьезной медицинской, социальной и экономической проблемой. Распространенность заболевания неуклонно растет во всем мире. По оценкам Международной федерации диабета, в 2010 г. число пациентов с СД составило 285 млн, а к 2030 г. эта цифра увеличится до 438 млн человек, при этом 95 % всех случаев СД приходится именно на СД2 [1]. Не менее значимым является тот факт, что СД2 выявляется во все более раннем возрасте – у детей и подростков. В настоящее время доля детей и молодых людей составляет в структуре СД2 примерно 33 %, что в первую очередь обусловлено ростом распространенности ожирения во всем мире [2].
СД2 связан со значительным риском развития ишемической болезни сердца (ИБС), инсульта, артериальной гипертензии, хронической болезни почек, ампутаций нижних конечностей, слепоты [3]. Так, например, риск развития ИБС в течение 10 лет с момента выявления СД2 составляет приблизительно 20 %, при этом по своей значимости СД2 не уступает другим факторам риска развития сердечно-сосудистых заболеваний (ССЗ), включая дислипидемию, курение и артериальную гипертензию [4]. Среди пациентов с диагнозом СД2, установленным в возрасте 40 лет, ожидаемая продолжительность жизни уменьшается в среднем на 14 лет, при этом более чем в 75 % случаев причиной смерти больных СД2 являются именно ССЗ [5, 6].
Очень серьезной проблемой являются и те трудности, с которыми сталкиваются врачи и пациенты при лечении СД2 и выборе сахароснижающей терапии. К сожалению, СД2 характеризуется прогрессирующим течением, что связано в первую очередь с нарастанием дисфункции β-клеток и как следствие – необходимостью интенсификации терапии в связи с невозможностью обеспечить гликемический контроль. Другой проблемой современной фармакотерапии являются такие нежелательные явления, наблюдаемые на фоне применения ряда сахароснижающих препаратов, как гипогликемия и увеличение массы тела, которые значительно ухудшают качество жизни пациентов, влияют на их приверженность лечению и уменьшают значимость снижения уровня гликемии, в первую очередь для риска развития макрососудистых осложнений СД.
Кроме того, СД2 часто сочетается не только с ССЗ, но и с нарушениями функции почек, а также печени, что тоже налагает определенные ограничения при выборе сахароснижающей терапии. Более 70 % пациентов с СД2 старше 65 лет имеют два и более сопутствующих заболеваний, что создает определенные трудности в лечении, обусловленные повышенным риском гипогликемии на фоне снижения функции почек, по сравнению с молодыми пациентами, а также более высоким риском нежелательных явлений и лекарственных взаимодействий на фоне приема большого количества различных лекарственных препаратов [7, 8]. Безусловно эти проблемы в лечении СД2 требуют поисков новых подходов к терапии СД, разработки новых классов лекарственных средств.
Появившиеся несколько лет назад препараты, действие которых основано на инкретиновом эффекте, продемонстрировали не только эффективность в отношении снижения уровня гликемии, но и низкий риск развития гипогликемии, отсутствие увеличения риска развития ССЗ, нейтральное влияние на массу тела либо снижение массы тела на фоне их применения.
Роль инкретинов в лечении СД2
Впервые инкретиновый эффект был описан H. Elrick и соавт., когда в эксперименте было обнаружено, что секреция инсулина в ответ на пероральный прием глюкозы значительно превышает секрецию инсулина при введении аналогичного количества глюкозы внутривенно [9]. Инкретины – это биологически активные вещества, гормоны, вырабатывающиеся в клетках кишечника в ответ на прием пищи и, как было установлено, ответственные за 50–70 % постпрандиальной секреции инсулина у здоровых лиц [10]. Именно этот вклад в секрецию инсулина и называют инкретиновым эффектом.
Наиболее значимую роль в секреции инсулина и обмене углеводов играют глюкагоноподобный пептид-1 (ГПП1) и глюкозозависимый инсулинотропный пептид (ГИП). Последний секретируется К-клетками двенадцатиперстной и тощей кишки в ответ на прием пищи, богатой углеводами и жирами. ГИП участвует в метаболизме липидов в адипоцитах и обладает пролиферативным эффектом на β-клетки. ГПП-1 секретируется L-клетками подвздошной и толстой кишки, оказывает разнообразное действие на обмен углеводов, включая глюкозозависимую стимуляцию секреции инсулина, глюкозозависимое подавление секреции глюкагона, снижение аппетита и скорости опорожнения желудка, возможно, улучшение чувствительности к инсулину. Помимо этого ГПП-1 увеличивает транскрипцию гена инсулина и принимает участие во всех этапах биосинтеза этого гормона [11–13]. Исследования на животных продемонстрировали, что под действием ГПП-1 происходит увеличение массы β-клеток и подавление процессов их апоптоза [14].
Инкретины быстро разрушаются под действием фермента дипептидилпептидазы-4 (ДПП-4), который расщепляет белки, в своей структуре содержащие аланин во второй позиции, что приводит к утрате ими биологической активности. ДПП-4 широко представлена во многих тканях организма человека, включая легкие, головной мозг, почки, надпочечники, поджелудочную железу, кишечник и лимфоциты. Многие нейропептиды, факторы роста, цитокины и хемокины могут быть потенциальными субстратами для ДПП-4 [11–13]. ДПП-4 была обнаружена в эндотелиальных клетках сосудов, расположенных в слизистой оболочке кишечника, где также локализуются L-клетки, что свидетельствует о том, что ГПП-1 разрушается практически сразу после секреции. Период полужизни для ГПП-1 составляет менее 2, для ГИП – 5–6 минут (рис. 1) [11–13].
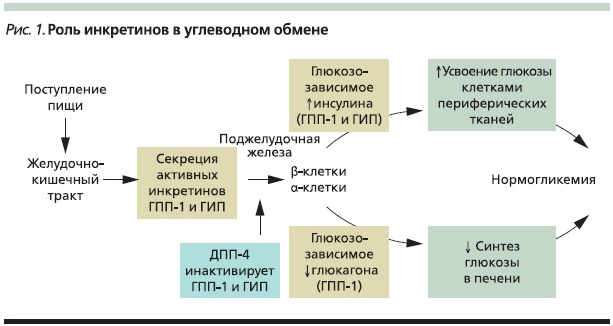
Однако было отмечено, что у пациентов с СД2 инкретиновый эффект снижен, и это может быть обусловлено нарушением процессов секреции инкретинов, их ускоренным метаболизмом или нечувствительностью клеточных рецепторов к их действию. Интересно, что у пациентов с СД2 снижается в первую очередь концентрация ГПП-1 при сохранении биологической активности этого инкретина, тогда как уровни ГИП остаются в пределах нормальных или близких к нормальным значений, но он утрачивает все эффекты на секрецию инсулина [15, 16].
Именно эти данные позволили разработать и внедрить в клиническую практику класс препаратов, сахароснижающий механизм действия которых основан на эффектах ГПП-1. Это агонисты или миметики ГПП-1 (обладают эффектами ГПП-1 на секрецию инсулина и глюкагона, но при этом устойчивы к действию фермента ДПП-4) и ингибиторы ДПП-4, на фоне применения которых происходят увеличение концентрации эндогенного ГПП-1 в 1,5–3,0 раза и как следствие – глюкозозависимая стимуляция секреции инсулина, а также подавление секреции глюкагона.
Саксаглиптин – ингибитор ДПП-4
Саксаглиптин (Онглиза) относится к классу ингибиторов ДПП-4. Обладая высокой селективностью и сродством к ДПП-4, препарат образует с ферментом комплекс медленной диссоциации. В результате этого ДПП-4 находится в состоянии равновесия между активной и неактивной формами, что позволяет саксаглиптину не только сохранять ингибирующее действие в отношении фермента в течение 24 часов, но и продолжать подавлять его активность in vivo даже при резком возрастании концентрации ГПП-1 [17].
Как показали исследования, применение саксаглиптина в дозе 5 мг/сут у пациентов с СД2 приводит к увеличению постпрандиального уровня нативного ГПП-1 в 1,5–3,0 раза, что в свою очередь способствует не только стимуляции секреции инсулина и как следствие – снижению уровня гликемии после приема пищи, но и подавляет секрецию глюкагона, стимулирующего процессы гликолиза в печени, что приводит к снижению уровня глюкозы натощак [18]. Таким образом, механизм действия саксаглиптина позволяет контролировать и глюкозу плазмы натощак (ГПН), и постпрандиальную гликемию (ППГ), и интегральный показатель уровня глюкозы в крови – гликозилированный гемоглобин (HbA1c), тем самым обеспечивая всесторонний гликемический контроль.
Важность всестороннего гликемического контроля обусловлена рядом факторов. Длительное время традиционными и общепринятыми показателями компенсации углеводного обмена, на которые ориентировались врачи в своей практике, являлись ГПН и HbA1c. Важность контроля HbA1c подтверждена результатами крупномасштабного проспективного исследования UKPDS 35 (United Kingdom Prospective Diabetes Study), которое продемонстрировало, что снижение HbA1c на 1 % приводит к уменьшению на 21 % риска любых связанных с СД2 осложнений, включая снижение риска инфаркта миокарда на 14 % и риска микроваскулярных осложнений на 37 % (р < 0,0001) [19].
Однако ряд эпидемиологических исследований указывает на то, что у больных СД2 и уровнем НbA1c < 7,0 % очень часто определяются высокие уровни ППГ [20]. При этом, как было установлено, вклад ППГ в значение HbA1c возрастает по мере улучшения гликемического контроля и приближения HbA1c к нормальным значениям (рис 2) [21].

Необходимость контроля ППГ обусловлена и тем фактом, что ППГ является независимым фактором риска ССЗ, поскольку запускает каскад метаболических нарушений, включая окислительный стресс, изменение реактивности сосудов, гиперкоагуляцию и эндотелиальную дисфункцию, которые приводят к прогрессированию атеросклероза и развитию макроваскулярных осложнений СД2 [22–24].
Как показали результаты клинических исследований по оценке эффективности применения саксаглиптина, препарат эффективно снижает все три показателя гликемического контроля как в монотерапии, так и в комбинации с другими сахароснижающими средствами – метформином, производными сульфонилмочевины (ПСМ), тиазолидиндионами [24–29]. Применение саксаглиптина в монотерапии больных СД2, ранее не получавших медикаментозного лечения, с исходным значением НbA1c ≥ 7 и ≤ 10 % в течение 24 недель сопровождалось достоверным по сравнению с плацебо снижением уровня НbA1c в среднем на 0,46 %, ГПН – на 0,5 ммоль/л и ППГ – на 2,4 ммоль/л.
При этом использование саксаглиптина не было связано с риском увеличения массы тела и характеризовалось низким риском развития гипогликемии (не было ни одного случая подтвержденной гипогликемии) [22].
В настоящее время Проект консенсуса экспертов РАЭ (Российская ассоциация эндокринологов) по инициации и интенсификации сахароснижающей терапии СД2 рекомендует в качестве препаратов первой линии при исходном значении НbA1c 6,5–7,5 % не только метформин, но и ингибиторы ДПП-4 [30]. Эффективность и безопасность саксаглиптина, продемонстрированная в клинических исследованиях, позволяет назначать препарат в монотерапии пациентам с СД2, расширяя возможности врача и пациента для эффективного лечения, особенно когда противопоказано применение метформина, как, например, в случае хронической болезни почек (при снижении скорости клубочковой фильтрации [СКФ] менее 60 мл/мин), которая встречается среди 40 % больных СД2 [31].
Назначение саксаглиптина больным СД2 с хронической болезнью почек возможно на любой стадии заболевания, включая терминальную (СКФ менее 15 мл/мин или гемодиализ), при этом необходимо снижение суточной дозы препарата до 2,5 мг у пациентов с умеренным и тяжелым нарушениями функции почек [32]. Снижение дозы связано с тем, что саксаглиптин выводится преимущественно через почки и нарушение функции почек может приводить к кумуляции препарата в организме, увеличивая риск гипогликемии. Однако важно отметить, что в клиническом исследовании применение саксаглиптина в дозе 2,5 мг в течение 12 недель у пациентов с СД2 и умеренной (СКФ менее 50 мл/мин) или тяжелой степенью (СКФ менее 30 мл/мин) нарушения функции почек не было связано с ухудшением показателя СКФ и течением заболевания почек, а также не увеличивало риск гипогликемии и других нежелательных явлений [33].
Применение саксаглиптина будет оправданно и в случае нарушения функции печени, включая не только синдром цитолиза, но и любую степень печеночной недостаточности. В клинической практике врач чаще всего сталкивается с синдромом цитолиза у больных СД2, основной причиной которого является неалкогольная жировая болезнь печени (НАЖБП) – спектр морфологических изменений этого органа, развивающихся у пациентов, не употребляющих алкоголь в гепатотоксичных дозах (не более 40 г этанола в сутки для мужчин и не более 20 – для женщин), включающих жировой гепатоз, неалкогольный стеатогепатит и цирроз печени [34]. Причиной НАЖБП чаще всего является синдром инсулинорезистентности, поэтому среди 70–90 % пациентов с СД2 обнаруживаются разные стадии НАЖБП [34–36]. По данным литературы, НАЖБП сопровождается синдромом цитолиза в 50–90 % случаев заболевания, поэтому выбор перорального сахароснижающего препарата (ПССП) может быть ограничен наличием у пациента с СД2 и НАЖБП синдрома цитолиза, поскольку увеличение АЛТ (аланинаминотрансферазы) и АСТ (аспартатаминотрансферазы) более чем в 2,5 раза является противопоказанием к назначению некоторых ПССП [34–36].
Саксаглиптин метаболизируется в печени с участием цитохрома P450. Однако оценка фармакокинетики препарата у пациентов с разными степенями печеночной недостаточности (стадии A, B, C по классификации Чайлд–Пью) показала, что значения фармакокинетических параметров саксаглиптина у пациентов с печеночной недостаточностью изменяются менее чем в 2 раза в сравнении со здоровыми лицами, что является клинически незначимым. При этом также не было выявлено статистически значимой отрицательной корреляции между общим клиренсом саксаглиптина и степенью печеночной недостаточности. Данное исследование позволило сделать вывод о том, что у пациентов с нарушением функции печени не требуется коррекции дозы саксаглиптина и препарат может применяться пациентами как с синдромом цитолиза, так и с более серьезными нарушениями функции печени [37].
Одной из важных проблем лечения СД2 является необходимость интенсификации терапии в связи с прогрессированием заболевания и невозможностью длительно обеспечивать гликемический контроль на монотерапии. Так, например, только 53 % пациентов на монотерапии метформином достигают целевых значений гликемии при применении препарата в течение 2 лет и только 34 % – при его использовании в течение 3 лет [38]. Исследования по оценке эффективности и безопасности саксаглиптина при добавлении его к метформину показали, что комбинация метформин + саксаглиптин является более эффективной в отношении снижения всех показателей гликемического контроля, чем продолжающаяся монотерапия метформином. Через 24 недели лечения у всех пациентов, получавших 5 мг саксаглиптина в сочетании с метформином, отмечено достоверное снижение уровней HbA1c в среднем на 0,7 %, ГПН – на 1,2 ммоль/л, ППГ – на 3,2 ммоль/л по сравнению с исходными значениями. Применение саксаглиптина также было связано со снижением постпрандиальной секреции глюкагона и увеличением постпрандиальной секреции инсулина по сравнению с исходными данными [27].
В настоящее время получены результаты долгосрочного наблюдения по оценке эффективности комбинированной терапии саксаглиптином и метформином на протяжении 154 недель лечения. Эти данные свидетельствуют о том, что комбинированная терапия саксаглиптином и метформином обеспечивает более длительный, клинически значимый гликемический контроль по сравнению с монотерапией метформином без увеличения риска развития гипогликемии и нарастания массы тела на фоне лечения (рис. 3) [39]. Период долгосрочного наблюдения в данном исследовании составил 206 недель, однако конечной точкой сравнения эффективности комбинированной терапии саксаглиптином + метформин и монотерапии метформином были именно 154 недели, поскольку невозможно было далее проводить сравнение между группами из-за нарастающего числа пациентов в группе метформин + плацебо, исключенных из исследования вследствие отсутствия адекватного гликемического контроля [39].
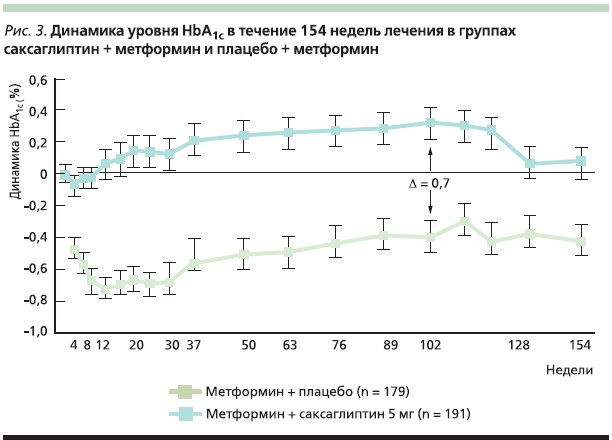
Однако наблюдение за пациентами в течение 206 недель позволило сделать выводы по безопасности комбинированной терапии саксглиптином и метформином. Саксаглиптин в комбинации с метформином хорошо переносился в течение 206 недель наблюдения: частота нежелательных явлений, в т. ч. и эпизодов гипогликеми, была сопоставимой с результатами, полученными в группе плацебо (табл.1). При этом не было отмечено увеличения массы тела пациентов на фоне проводимого лечения, а также клинически значимых изменений со стороны почек и печени [39].
Таблица 1. Нежелательные явления в исследовании эффективности и безопасности терапии саксаглиптином и метформином в течение 206 недель наблюдения.
Комбинированная терапия саксаглиптином и метформином является целесообразной, поскольку эти препараты, обладая взаимодополняющими механизмами действия, влияют на разные патогенетические звенья СД2 – инсулинорезистентность и дисфункцию β-клеток. При этом их совместное применение не связано с риском увеличения массы тела и развития гипогликемии. Кроме того, в последнее время появились данные о том, что метформин способен потенцировать действие ингибиторов ДПП-4, увеличивая концентрацию ГПП-1, что может быть связано как со стимуляцией секреции ГПП-1 L-клетками или активацией транскрипции гена проглюкагона, так и с непосредственным ингибированием ДПП-4 [40, 41]. Ведущими диабетологическими организациями эта комбинация признана в настоящее время одной из самых рациональных для лечения СД2.
Аргументом в пользу применения данной схемы лечения являются и результаты сравнительного исследования комбинаций саксаглиптина + метформин и метформина + ПСМ. Комбинированная терапия метформином и ПСМ является широко распространенной схемой лечения СД2 в нашей стране. Однако применение ПСМ связано с высоким риском возникновения гипогликемии, которая, по данным крупных проспективных исследований, является более значимым фактором риска ССЗ у пациентов с СД2, чем наличие ССЗ в анамнезе, возраст, уровни HbA1c и липопротеидов высокой плотности [42].
Результаты многоцентрового двойного слепого рандомизированного исследования с включением 858 пациентов с СД2 и неадекватным гликемическим контролем на фоне монотерапии метформином показали, что саксаглиптин в комбинации с метформином по эффективности не уступает комбинации метформина с ПСМ, но является более безопасным в отношении риска развития гипогликемии и увеличения массы тела. Через 52 недели наблюдения динамика уровня HbA1c в группе саксаглиптин + метформин составила -0,74 %, а в группе глипизид + метформин – -0,80 %, что с учетом данных статистического анализа говорит о сопоставимости полученных результатов. При этом процент гипогликемий, отмеченных в группе саксаглиптина и метформина, был в 10 раз меньше, чем в группе сравнения: 3,0 против 36,3 % (р < 0,0001). В группе комбинированной терапии метформином и саксаглиптином не было отмечено увеличения массы тела, тогда как в группе сравнения наблюдалось увеличение массы тела в среднем на 1,1 кг (р < 0,0001) [43].
При долгосрочном наблюдении, через 104 недели от начала лечения, также были получены результаты, подтверждающие неменьшую эффективность саксаглиптина в комбинации с метформином по сравнению с комбинацией метформина и ПСМ при достоверно бoльшей безопасности комбинации саксаглиптина и метформина в отношении рисков увеличения массы тела и развития гипогликемий (рис. 4, 5) [44].
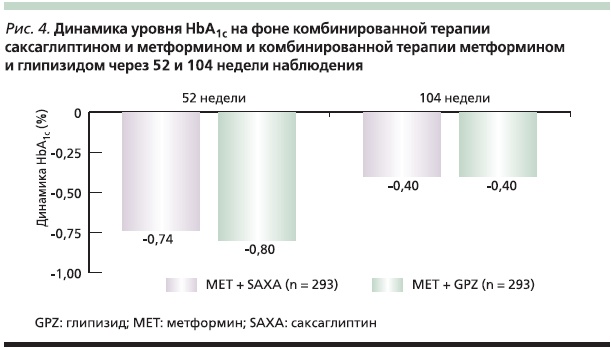
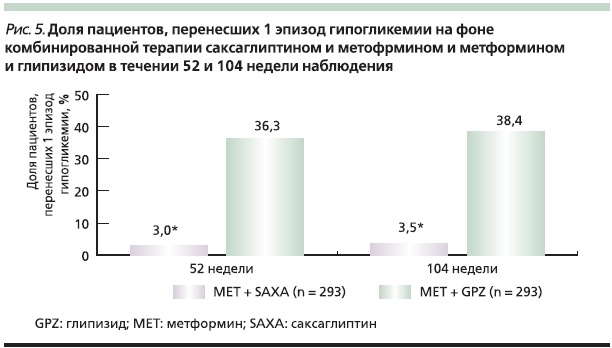
Таким образом, применение саксаглиптина в комбинации с метформином является эффективной и безопасной схемой лечения пациентов с СД2, позволяющей достигать целевых значений гликемии и длительно обеспечивать гликемический контроль без необходимости интенсификации терапии.
Саксаглиптин может быть препаратом выбора для пожилых пациентов с СД2, не требуя при этом коррекции дозы, поскольку у больных 65–80 лет не выявлено клинически значимых различий параметров фармакокинетики препарата по сравнению с пациентами более молодого возраста (18–40 лет) [45].
Стоит отметить, что ретроспективный анализ объединенных данных исследований III фазы монои комбинированной терапии саксаглиптином показал, что препарат так же эффективен для пациентов старше 65 лет в отношении всех показателей гликемического контроля (HbA1c, ГПН и ППГ), как и для молодых лиц. Динамика уровня HbA1c за 24 недели, по данным анализа, составила -0,68 % у больных в возрасте до 65 лет и -0,73 % у лиц старше 65 лет. При этом профиль безопасности препарата для лиц старше 65 лет был сопоставимым как с результатами в группе плацебо, так и с данными, полученными для пациентов в возрасте до 65 лет [46].
Поскольку одной из главных проблем лечения пожилых больных СД2 является повышенный риск развития гипогликемии, необходимо отметить, что саксаглиптин не увеличивает риск гипогликемии у лиц старше 65 лет. Как показал проведенный анализ, частота гипогликемий у пациентов старше 65 лет была сопоставимой с таковой как в группе плацебо, так и в группе больных моложе 65 лет (табл. 2) [46].
Таблица 2.Гипогликемии у пациентов старше 65 лет – данные ретроспективного анализа.
Помимо клинической эффективности препарата, важной и для врача, и для пациента, необходимо учитывать и безопасность рекомендованного лечения. Во всех клинических исследованиях саксаглиптин продемонстрировал хорошую переносимость, не увеличивал риск возникновения гипогликемии и не оказывал негативного влияния на массу тела пациентов [24–29, 39].
В настоящее время одним из важнейших критериев безопасности ПССП является отсутствие отрицательного влияния на риск развития ССЗ. Поэтому очень важным преимуществом саксаглиптина можно считать его кардиоваскулярную безопасность, что было подтверждено результатами метаанализа восьми клинических исследований. Частота возникновения серьезных сердечно-сосудистых осложнений у пациентов, получавших саксаглиптин и препараты групп сравнения, составила 0,7 и 1,4 % соответственно при отношении рисков 0,44. При этом частота летальных исходов вследствие ССЗ (0,2 и 0,8 % соответственно) была низкой. Достоверной разницы между группами отмечено не было, но результаты мета-анализа позволили предположить, что саксаглиптин, возможно, обладает кардиопротективным действием [47]. В настоящее время продолжается международное многоцентровое рандомизированное двойное слепое исследование IV фазы с включением 12 тыс. пациентов и периодом наблюдения 5 лет по оценке влияния саксаглиптина на риск развития ССЗ – SAVOR (Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus Trial), результаты которого, возможно, подтвердят кардиопротективный эффект препарата [48].
В России саксаглиптин зарегистрирован под названием Онглиза®. Препарат показан пациентам с СД2 в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве монотерапии, стартовой комбинированной терапии с метформином, а также как добавление к монотерапии метформином, тиазолидиндионами или производными сульфонилмочевины в отсутствие адекватного гликемического контроля на данной терапии.
Заключение
СД по-прежнему остается одной из самых актуальных проблем здравоохранения во всем мире. Решение этой проблемы безусловно связано с разработкой и внедрением в клиническую практику новых эффективных и безопасных сахароснижающих препаратов, позволяющих контролировать заболевание и избегать развития тяжелых осложнений СД.
Препарат саксаглиптин группы ингибиторов ДПП-4 обладает благоприятным соотношением риск/польза при применении пациентами с СД2.
С учетом важности всестороннего гликемического контроля с точки зрения его влияния на риск развития осложнений СД2 и способности саксаглиптина эффективно контролировать все три параметра гликемии (ГПН, ППГ и HbA1c) данный препарат может быть рекомендован широкому кругу пациентов с СД2 как в монотерапии, так и в комбинации с метформином или ПСМ. Низкий риск гипогликемии и нейтральное влияние на массу тела пациента делают саксаглиптин еще более привлекательным для врача, поскольку препарат позволяет эффективно добиваться адекватного контроля гликемии без риска для пациента.
Хороший профиль безопасности и переносимости саксаглиптина позволяет применять его и больными с сопутствующими заболеваниями почек, печени и сердечно-сосудистой системы, которые в клинической практике часто сочетаются с СД2 и ограничивают выбор врача в отношении сахароснижающей терапии. Применение препарата не требует коррекции дозы (5 мг) в зависимости от возраста, пола пациента, наличия заболеваний печени, сопровождающихся нарушением ее функции, и легкой почечной недостаточности.
Информация об авторах:
Петунина Нина Александровна – доктор медицинских наук, профессор, заведующая кафедрой эндокринологииФППОВ ГОУ ВПО “Первый МГМУ им. И.М. Сеченова” Минздравсоцразвития РФ.
Тел. 8 (495) 530-32-16;
Бращенкова Анна Викторовна – кандидат медицинских наук, медицинский советник
ООО “Бристол-Майерс Сквибб”



