Проблемы иммунодезадаптационных состояний, развивающихся на фоне инфекционных заболеваний, всегда привлекали внимание специалистов. Особенно это актуально в педиатрической практике, т. к. развитие адаптационных реакций у ребенка находится в стадии формирования [1, 2, 6–8].
Изучение процессов адаптации и дезадаптации было начато в работах H. Selye, сформулировавшего гипотезу общего адаптационного синдрома, согласно которой болезнетворный фактор обладает триггерным действием, включающим выработанные в процессе эволюции механизмы адаптации. Открытый H. Selye (1936) неспецифический ответ организма на различные по характеру воздействия (холод, повреждение тканей, предельные физические нагрузки, интоксикация сублетальными дозами различных препаратов и др.) был назван им общим адаптационным синдромом. В дальнейшем было выделено три стадии развертывания данного синдрома: тревоги (alarm reaction), резистентности (stage of resistence) и истощения (stage of exhaustion) [2].
Развитие идей H. Selye получило продолжение в трудах П.К. Анохина (1980), Н.А. Агаджаняна (1990), В.П. Казначеева (1998), Ф.З. Меерсона (1998) и др. С 1975 г. Л.Х. Гаркави и соавт. разрабатывалась гипотеза, объясняющая механизмы неспецифических реакций организма в процессе адаптации в зависимости от количественных характеристик действующих факторов [1, 2]. Согласно данной гипотезе, в организме адаптационные реакции могут развиваться в ответ на слабые, средние и сильные (чрезвычайные) воздействия факторов окружающей среды. Реакции на чрезвычайные воздействия как раз и являются тем
адаптационным синдромом, который описывал H. Selye. Авторы гипотезы определили типы реакций адаптации, каждый из которых имел собственные иммунонейроэндокринные характеристики. Среди них выделяют реакции тренировки, активации и стресса [1, 2]. Под адаптационной реакцией тренировки подразумевают ответ на слабые повторяющие воздействия окружающей среды. Основным ее отличием является стабильность состояния всех регуляторных систем организма, причем показатели, ее характеризующие (в частности, показатели гемограммы), находятся вблизи нижних границ нормы. Если изменений в силе, частоте и интенсивности раздражающих факторов не происходит, результатом
становится отсутствие реакции организма на данное воздействие.
Факторы, оказывающие среднее воздействие на организм, вызывают реакцию активации, которая подразделяется на подтипы: реакции спокойной активации, повышенной активации и переактивации. Интенсивность адаптационных процессов в организме возрастает от первой реакции к последующим.
Наиболее неблагоприятная реакция стресса развивается в ответ на сильные воздействия и характеризуется комплексом реакций дезадаптации [1, 2]. Однако оценить состояние адаптационных возможностей организма не всегда представляется возможным. Поэтому одним из важных методов
диагностики нарушений адаптации является определение лейкоцитарных индексов, позволяющих переводить гемограмму в соизмеримые числовые показатели, дающие возможность оценить реакцию системы крови, косвенно судить о состоянии иммунной системы и ее реактивности.
Проблемы иммунодезадаптационных состояний организма тесно связаны с состоянием микрофлоры различных биотопов организма человека (толстый и тонкий кишечник, слизистые оболочки полости рта, наружных половых органов и др.). Особенно актуально это для детей, у которых микробиоценозы находятся в стадии становления. Многочисленные экспериментальные данные и клинические наблюдения свидетельствуют о том, что совокупность биотопов организма человека являются своеобразным экстракорпоральным органом и формирование дисбиотических нарушений на определенном участке слизистой оболочки неизбежно будет распространяться на другие отделы, нарушая функционирование системы иммунного гомеостаза и повышая вероятность иммунодезадаптационных состояний [3–5]. Это нашло подтверждение в исследованиях препаратов, влияющих на состояние микробиоценозов различных биотопов организма человека, при их использовании в профилактике и лечении острых респираторных заболеваний (ОРЗ) [9]. Так, в исследовании M. de Vrese и соавт. при использовании комплекса пробиотических бактерий (Lactobacillus gasseri PA 16/8, Bifidobacterium longum SP 07/3, B. bifidum MF 20/5) наблюдали существенное снижение выраженности основных симптомов ОРЗ, средней продолжительности заболевания, а также длительности лихорадочной реакции [10]. Ведущим механизмом отмеченных эффектов являлась биоценозопосредованная активация клеточного иммунитета: повышение уровня цитотоксических T-лимфоцитов (CD8+) и T-хелперов (CD4+).
Таким образом, препараты, влияющие на микрофлору, не только являются средством коррекции микроэкологических нарушений в отдельно взятом биотопе, но и способны влиять на процессы адаптации посредством активации системы иммунологического гомеостаза.
Цель настоящего исследования состояла в оценке эффективности пребиотика метаболического типа Хилак форте в комплексной терапии ОРЗ у детей.
Материал и методы
Клиническая часть работы проводилась в условиях стационара (Детская инфекционная больница № 5 Москвы), где под наблюдением находились 62 пациента со среднетяжелыми и осложненными формами ОРЗ в возрасте с рождения до 13 лет. Комплекс лечебных и диагностических мероприятий для всех пациентов был общим и включал общепринятую базисную терапию, в т. ч. антибактериальные препараты по показаниям, муколитические, десенсибилизирующие и некоторые другие средства. Тридцать два ребенка дополнительно к стандартной терапии с первого дня стационарного лечения получали Хилак форте в возрастной дозировке с длительностью курса до 8–10 дней.
В группу сравнения вошли 30 детей, получавших стандартную терапию. Подбор больных проводился методом случайной выборки. Сравниваемые группы были сопоставимыми по полу, возрасту, тяжести и формам заболевания.
Оценку эффективности проводимой терапии осуществляли клинически (учитывали сроки купирования основных клинических симптомов и синдромов), по клинико-лабораторным данным (оценивали состояние микрофлоры желудочно-кишечного тракта [взятие и посевисследуемого материала на селективные питательные среды, выделение чистых культур микроорганизмов, определение их видового и количественного составов по стандартной методике] и показатели лейкоцитарной формулы крови [лейкоцитарный индекс интоксикации по Кальф–Калифу, индексы Рейса и
Островского, сдвига, эндотоксикоза по Даштаянц, аллергизации], изменения которых позволяли говорить о развитии у детей той или иной адаптационной реакции). Клинико-лабораторная оценка в группах сравнения проводилась двукратно – в первые сутки стационарного лечения и повторно через 8–10 дней.
Статистическая обработка результатов исследования проводилась с использованием программы Primer of Biostatistics (V. 4.03) с расчетом средней арифметической и ошибки средней (ошибка репрезентативности). Достоверность различий результатов исследования оценивали по критерию
Стъюдента. Различия считали достоверными при р < 0,05.
Результаты и обсуждение
Анализ динамики клинических симптомов основного заболевания показал, что в группе детей, в комплексную терапию которых был включен препарат Хилак форте, отмечено сокращение длительности интоксикационного синдрома. Так, продолжительность лихорадки составила 3,67 ± 0,32 суток в основной группе против 4,62 ± 0,35 – в группе сравнения (р = 0,049); сроки восстановления аппетита также были достоверно меньше в основной группе, составив 3,43 ± 0,43 против 5,03 ± 0,37
суток (р = 0,007).
При применении Хилака форте была также отмечена тенденция к сокращению длительности катаральных проявлений ОРЗ – гиперемии ротоглотки (5,9 ± 0,43 против 6,5 ± 0,37 суток; р = 0,237) и ринита (5,35 ± 0,34 против 6,0 ± 0,27 суток; р = 0,318). Существенной разницы в длительности кашля и хрипов в легких выявлено не было.
Проведение антибактериальной терапии у четырех больных группы сравнения сопровождалось развитием антибиотикоассоциированной диареи (ААД). В то же время у пациентов основной группы, получавших аналогичные антибактериальные препараты на фоне приема Хилака форте, не было отмечено симптомов ААД, что говорит о снижении риска данного осложнения при использовании данного пребиотика в терапии ОРЗ у детей.
Комплексная оценка эффективности Хилака форте при ОРЗ помимо динамики клинических проявлений заболевания включала изучение состояния микрофлоры толстой кишки (у всех больных основной группы и 10 пациентов группы сравнения). Было установлено, что у подавляющего большинства детей течение ОРЗ сопровождалось развитием выраженных нарушений микробиоценоза желудочно-кишечного тракта уже в остром периоде. Наибольшие изменения были выявлены в популяции бифидофлоры: лишь у 12,5 % больных основной группы и у 10 % – группы сравнения ее уровень составил выше 108 КОЕ/г. Дефицит лактобактерий был обнаружен у 43,8 и 40 % больных соответственно. Доля пациентов с нарушениями в популяции энтерококков была еще более высокой – 75 и 90 %. При этом одинаково часто наблюдался как их избыточный рост (у 40,6 и 50,0 % больных), так и дефицит (у 34,3 и 40,0 % больных соответственно). В основной группе дефицит колифлоры был выявлен у половины больных, в то время как в группе сравнения – только у 30 % обследованных. Данные нарушения сопровождались появлением кишечной палочки с измененной ферментативной активностью, в т. ч. лактозонегативной (у 12,5 и 30,0 % больных) и гемолизирующей (у 15,6 и 10,0 % пациентов соответственно).
У включенных в исследование детей был проведен интегральный анализ состояния микрофлоры желудочно-кишечного тракта на фоне терапии Хилаком форте с помощью разработанного нами индекса колонизационной резистентности [11].
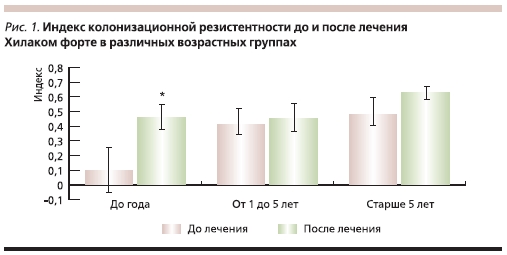
При сравнении среднего показателя индекса колонизационной резистентности в группе детей, получавших Хилак форте в составе комплексной терапии ОРЗ, достоверных отличий в его уровне до и после лечения отмечено не было. Однако при более детальном рассмотрении этого показателя в различных возрастных группах было выявлено его достоверное увеличение после лечения у
детей первого года жизни, для которых изменения в составе микрофлоры являются наиболее прогностически значимыми (рис. 1).
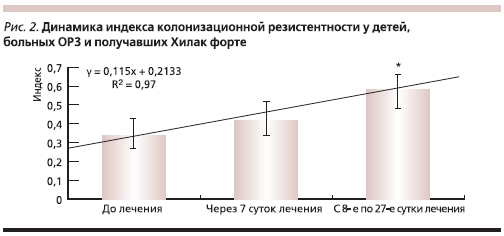
При динамическом изучении состояния микрофлоры желудочно-кишечного тракта в различные сроки после выздоровления нами была отмечена линейная зависимость индекса колонизационной резистентности от времени с высоким коэффициентом корреляции (рис. 2). При этом к 8–27-м суткам после выздоровления наблюдали достоверное повышение этого индекса по сравнению с исходным состоянием.
Таким образом, пребиотик метаболитного типа Хилак форте способствовал улучшению состояния измененной микрофлоры желудочно-кишечного тракта у детей, больных ОРЗ, получавших антибактериальную терапию. При этом наиболее значимый эффект отмечался у детей первого года жизни. Для изучения способности Хилака форте воздействовать на неспецифическую резистентность организма на фоне ОРЗ определялась динамика интегральных показателей лейкоцитарной формулы крови у больных в группах сравнения. Неблагоприятные дезадаптационные реакции характеризуются изменениями в периферической крови – развитием нейтрофильного лейкоцитоза, лимфо- и эозинопении. Однако помимо процентного содержания лимфоцитов имеет также значение выраженность отклонений от нормы других элементов лейкоцитарной формулы – базофилов, эозинофилов, моноцитов, палочкоядерных нейтрофилов, а также общего количества лейкоцитов, что наиболее оптимально рассматривать интегрально с помощью формул расчета лейкоцитарных индексов [3].
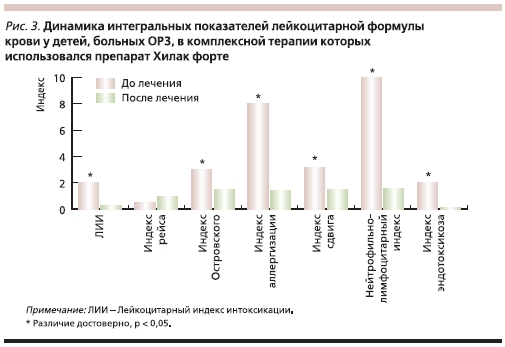
При расчете лейкоцитарных индексов у пациентов в группах сравнения были получены данные, подтвердившие адаптогенные свойства Хилака форте. Динамика интегральных показателей лейкоцитарной формулы крови больных ОРЗ, в комплексной терапии которых использовался пребиотик Хилак форте, носит характер “стягивания” данных параметров в зону средних значений (рис. 3). Эти данные подтверждают адаптивный характер изменений, развивающихся на фоне терапии указанным препаратом. С учетом того факта, что этот феномен наблюдается на фоне реакции адаптации по типу переактивации и характеризуется уменьшением таких показателей, как лейкоцитарный индекс интоксикации, индекс сдвига лейкоцитов, соотношение нейтрофилов и лимфоцитов (рис. 3), можно говорить о том, что Хилак форте обладает способностью изменять неспецифическую резистентность организма в сторону благоприятных при инфекционном процессе адаптационных реакций.
Подводя итог проведенным исследованиям, можно сделать вывод, что включение пребиотика метаболитного типа Хилак форте, обладающего адаптогенным действием, в комплексную терапию осложненных форм острых респираторных инфекций у детей приводит к сокращению длительности клинических симптомов, осложнений, уменьшает выраженность дисбиотических нарушений, повышая уровень облигатной микрофлоры кишечника, и обеспечивает профилактику ААД.



