Введение
Хроническая боль в спине (ХБС) является одним из наиболее распространенных показаний к назначению обезболивающих средств, в т.ч. нестероидных противовоспалительных средств (НПВС) [1–5]. С учетом требований безопасности НПВС больным ХБС чаще рекомендуют назначать короткими курсами в минимально эффективных дозах [3–9]. Определение ХБС подразумевает ее продолжительность в три месяца и более, т.е. по определению, полное купирование боли за короткий курс применения лекарственных средств маловероятно [1, 2].
Помимо клинических (сохранение боли) обсуждаются и патогенетические предпосылки для разной длительности применения НПВС при боли в спине. Это связано с тем, что все большее число работ показывает, что усиление боли в спине чаще всего связано с т.н. малым воспалением [10], которое разрешается достаточно медленно. Так, в ряде исследований с применением магнитно-резонансной терапии (МРТ) показано, что воспаление в виде остеитов, спондилитов, энтезитов может разрешаться в течение нескольких месяцев и дольше. Таким образом, имеется ряд клинических, этиологических и патогенетических предпосылок к увеличению длительности назначения НПВС при боли в спине [1–10]. Все чаще обсуждается возможность назначения НПВС для лечения хронической боли в средне- или долгосрочной перспективах [5], т.е. изменяет понятие минимального эффективного курса терапии. При этом неопределенность понятия «минимально эффективная доза» НПВС сохраняется, в связи с чем подбор лечения проводится на основании субъективного мнения пациента и лечащего врача об эффективности проводимой терапии.
Все перечисленные вопросы делают актуальным поиск наиболее эффективных схем назначения НПВС для средне- и долгосрочной перспектив лечения боли в спине.
Цель настоящего исследования – сравнение эффективности и безопасности трех режимов назначения НПВС для лечения ХБС.
Материал и методы
В исследование были включены 100 пациентов старше 18 лет с ХБС, подписавших информированное согласие на участие в исследовании [14]. Критерием включения в исследование стало наличие боли в нижней части спины (БНЧС), оцененной по числовой рейтинговой шкале (ЧРШ) в 4 балла и более. В случае приема анальгетиков их доза была стабильной в течение недели, предшествовавшей исходному визиту (день 1). Критерии исключения из исследования: БНЧС травматического характера или острая БНЧС (продолжительностью менее 3 месяцев); любые хронические заболевания в стадии обострения, внутривенное, внутримышечное или интра/периартикулярное введение глюкокортикоидов за 4 недели и менее до скрининга; наличие противопоказаний к назначению амтолметин гуацила согласно утвержденной инструкции; любая активная вирусная, бактериальная или грибковая инфекции на момент обследования, вирусный гепатит B или C, ВИЧ-инфекция; первичный или вторичный иммунодефицит; прием антикоагулянтов, двух дезагрегантов; острые психические заболевания, которые могли влиять на способность пациента понимать требования исследования; фибромиалгия, алкогольная зависимость или употребление наркотических веществ в течение 12 месяцев, предшествовавших исследованию; вакцинация живыми вакцинами менее чем за 12 недель до исходного визита; гиперчувствительность к любому компоненту исследуемого препарата; уровень гемоглобина ≤85 г/л; число нейтрофилов <2 000 в мкл, число тромбоцитов <125,000 в мкл; глюкоза крови натощак ≥7,0 ммоль/л, креатинин сыворотки крови ≥140 мкмоль/л для женщин или 160 мкмоль/л для мужчин; повышение активности аспартатаминотрансферазы (АСТ) или аланинаминотрансферазы (АЛТ), или щелочной фосфатазы (ЩФ), или γ-глутамилтранспептидазы (ГГТП) более чем в 3 раза относительно верхней границы нормы; бронхиальная астма, хроническая обструктивная болезнь легких или гиперреактивность бронхов, поллиноз; другая тяжелая неконтролируемая патология печени, желудочно-кишечного тракта, мочевыделительной, дыхательной, сердечно-сосудистой, нервной или эндокринной систем; онкогематологические заболевания.
Все пациенты были в случайном порядке рандомизированы в три группы. Пациенты первой группы (группа деэскалационного применения НПВС) получали амтолметин гуацил (АМГ) (Найзилат, Др. Редди’с Лабораторис, Индия) в суточной дозе 1800 мг в течение 14 дней с последующим переходом на минимальную дозу 600 мг/сут (n=60). Пациенты второй группы (группа постоянного приема средних доз НПВС) получали АМГ в постоянной дозе 1200 мг/сут (n=20). Группу сравнения составили пациенты, принимавшие другие НПВС в режиме «по требованию» (n=20). Продолжительность наблюдения за пациентами в каждой из групп составила 12 недель.
При оценке эффективности АМГ первичной конечной точкой считали число пациентов, достигших уменьшения интенсивности БНЧС на 2 пункта и более по ЧРШ через 12 недель. Вторичными конечными точками при оценке эффективности стали улучшение общей оценки боли, ночной боли по данным числовых рейтинговых шкал (ЧРШ), улучшение показателей подвижности позвоночника (тест Шобера и латеральная подвижность позвоночника в поясничном отделе) на 12-й неделе.

Безопасность оценивали путем учета числа побочных эффектов, возникших в течение 12 недель с момента приема первой дозы препарата.
Статистический анализ выполнен с применением пакетов прикладных программ Statistica SPSS17 и Statistica 8.0 (StatSoft). Для проверки соответствия распределения признака нормальному распределению применяли методы Колмогорова–Смирнова и Шапиро–Уилка, нормальным считалось распределение при p>0,05. Для описания нормально распределенных количественных признаков использовано среднее значение признака и среднее квадратичное отклонение (M±SD); для описания выборочного распределения признаков, отличающегося от нормального, указывались медиана, верхний и нижний квартили – Me [Q25; Q75]. Для сравнения двух групп с нормальным распределением количественного признака определялся t-критерий Стьюдента для независимых групп (с учетом вида дисперсии признака, определенного методом Левена). Корреляция двух нормально распределенных количественных признаков изучалась с помощью метода Пирсона, при отклонении распределения от нормального, а также при анализе ассоциации качественных признаков использован метод Спирмена. Для сравнения достоверности межгрупповых различий количественных значений применен тест Манна–Уитни. Различия считались достоверными при p<0,05 [11].
Исследование одобрено локальным этическим комитетом Саратовского государственного медицинского университета им. В.И. Разумовского Минздрава России.
Результаты исследования
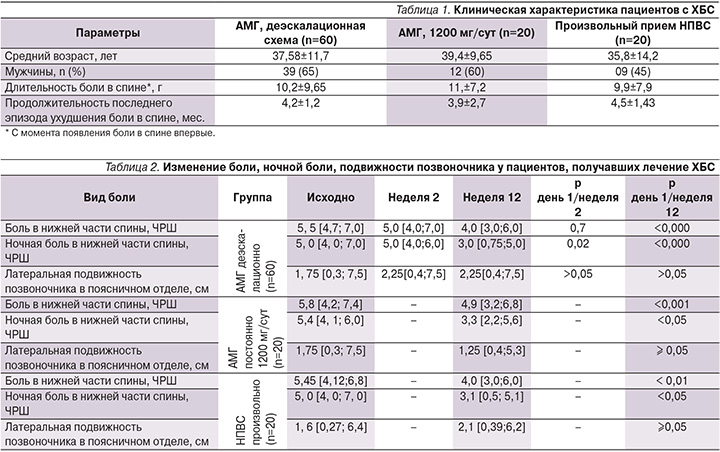
По полу, возрасту, длительности заболевания пациенты сравниваемых групп были сопоставимыми (табл. 1). Суммарная доза принятых НПВС (согласно индексу приема НПВС ASAS – Assessment of SpondyloArthritis international Society) в группе произвольного приема составила 8,0±7,8% от максимально возможной (100%).
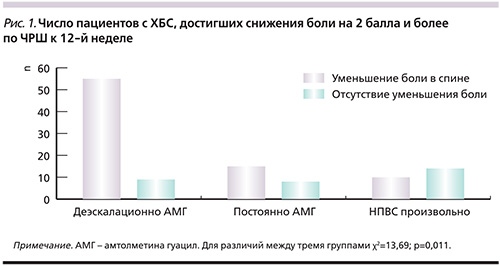
Первичной конечной точки (уменьшение боли на 2 пункта и более к 12-й неделе) достиг 51 (85%) пациент из 60 больных группы деэскалационного приема НПВС, 12 (60%) из 20 пациентов из группы постоянного приема НПВС и 9 (45%) из 20 пациентов произвольного приема НПВС. Различия эффективности деэскалационного и постоянного режимов приема АМГ достоверны (p=0,027), как и различия эффективности лечения деэскалационного режима и произвольного приема НПВС (p=0,0008). Эффективность постоянного приема средних доз АМГ и произвольного приема НПВС не различалась (p=0,52, рис. 1).
При применении деэскалационной схемы приема НПВС средние показатели боли в спине через 2 недели лечения (во время приема максимальной дозы препарата) снизились недостоверно. Важно отметить, что уменьшение боли в спине продолжилось после уменьшения дозы АМГ (Найзилат) до минимальной (600 мг/сут), достигнув минимальных значений к 12-й неделе лечения (табл. 2).
За 12 недель исследования суммарно зафиксировано 20 побочных эффектов, не потребовавших отмены лечения. Серьезных побочных эффектов не установлено. У 6 (10%) больных группы деэскалационного приема на фоне применения максимальной дозы АМГ отмечена дестабилизация артериального давления (АД), потребовавшая коррекции антигипертензивной терапии, но не отмены лечения. После снижения дозы АМГ дестабилизации АД не отмечено. У больных с произвольным приемом НПВС дестабилизация АД установлена у 3 (15%) пациентов. У лиц, принимавших средние дозы АМГ, АД не изменялось.
Диспепсия отмечена у 5 (25%) пациентов группы постоянного приема и у 2 (3,33%) пациентов, принимавших АМГ в высоких дозах (p<0,05). Из них у одного пациента группы произвольного приема установлено наличие эрозивных изменений желудка на 12-й неделе (рекомендован отказ от дальнейшей противовоспалительной терапии, лечение у гастроэнтеролога). У пациентов, принимавших АМГ, диспепсия не ассоциировалась с изменением общего анализа крови или с наличием эрозивных изменений слизистой оболочки верхних отделов желудочно-кишечного тракта. Изменение печеночных трансаминаз (повышение более двух высших границ нормы) отметили у 4 пациентов, что потребовало назначения диеты, гепатопротекторов, но не отмены лечения НПВС.
Обсуждение
Настоящее исследование – одна из первых попыток разработать новые подходы к безопасному применению НПВС в условиях изменений представлений о патогенезе ХБС и изменений представлений о ремоделировании опорно-двигательного аппарата при хронических заболеваниях позвоночника [7, 12, 13].
Внедрение новых методов инструментальной диагностики (МРТ, компьютерная томография и др.), иммуногистохимического анализа позволило уточнить роль воспаления в патогенезе болевого синдрома при дегенеративно-дистрофических изменениях позвоночника [6, 7, 12]. В некоторых работах, в т.ч. в исследовании H. Radner и соавт. (2012), показано, что болевой синдром напрямую взаимосвязан с объемом и выраженностью воспалительных изменений позвонков, прилежащих к дегенеративно измененным межпозвонковым дискам. В других работах четко показано, что рост остеофитов начинается в местах поствоспалительных изменений позвонков [12]. Увеличение внимания к воспалению в патогенезе боли и ремоделированию позвонков изменяет взгляд на подходы к лечению дегенеративно-дистрофических заболеваний позвоночника. Появляется мнение о преимуществах персонифицированного подхода к лечению пациента с болью в спине, о возможности применения в качестве обезболивающих не только простых анальгетиков [2], но и средств с противовоспалительной активностью [7]. Возникает вопрос: следует ли прерывать лечение пациента, достигшего ответа на лечение боли в спине при применении НПВС, если полного купирования ХБС в течение короткого времени (7–14 дней) не достигнуто? Идея продолжать лечение до полного разрешения боли в спине в этих условиях требует разработки мер, повышающих безопасность такой терапии. Одним из способов снижения риска побочных эффектов НПВС является уменьшение дозы назначаемого препарата, однако это может быть сопряжено со снижением эффективности лечения. Преимущества и недостатки разных режимов терапии НПВС при дегенеративно-дистрофических заболеваниях позвоночника в настоящий момент практически не изучены.
Наша работа демонстрирует возможность безопасного лечения ХБС с применением разных режимов терапии НПВС, среди которых наибольшую эффективность показал деэскалационный режим применения АМГ. Полученные результаты достаточно предсказуемы – для большинства НПВС показана дозозависимость в вопросах как эффективности, так и кардиоваскулярной и желудочно-кишечной безопасности [13–21]. При этом выбранный нами для исследования препарат – амтолметина гуацил (Найзилат, Др. Редди’с Лабораторис, Индия) – обладает самостоятельной гастропротективной активностью [14, 15, 17–19]. Наименьшей эффективностью при наихудшей безопасности отличался вариант приема НПВС в режиме «по требованию». Низкая эффективность произвольного приема может быть обусловлена очень низкой суммарной дозой принятых НПВС, что, казалось бы, должно приводить к увеличению безопасности лечения. Однако увеличения безопасности лечения при произвольном приеме НПВС не продемонстрировано. При анализе возможной причины подобного «парадокса» установили, что при произвольном приеме пациенты принимают НПВС при ухудшении состояния подряд в максимальных дозах, после чего следует период, когда препарат не принимается (рис. 2). Подобное чередование периодов максимального приема с периодами неприема препарата, по нашему мнению, и определяет снижение безопасности лечения НПВС при произвольном приеме по сравнению с постоянным приемом низких или средних доз лекарств (рис. 2). Полученные данные согласуются с результатами ряда популяционных исследований, показавших, что постоянный прием НПВС обладает преимуществами в кардиоваскулярной безо-пасности над прерывистым приемом [22].
Полученные клинические и лабораторные данные настоящей работы также согласуются с ранее полученными результатами исследования КОРАЛЛ, в котором мы показали несколько более высокую клиническую и МРТ-эффективность постоянного частого приема НПВС над их редким приемом [23, 24].
В заключение следует отметить, что вопрос купирования ХБС изучен недостаточно и нуждается в дальнейшем исследовании. В частности, в ходе больших исследований необходимо разработать оптимальные подходы к противовоспалительной терапии при ХБС, основанные на индивидуальном подходе к пациенту, обеспечивающие максимальную эффективность и безопасность лечения, в т.ч. за счет возможности подбора разных режимов приема препаратов, на оптимальный промежуток времени.
Выводы
- Деэскалационный режим назначения амтолметина гуацил (Найзилат, Др. Редди’с Лабораторис, Индия) ассоциируется с большей эффективностью лечения ХБС, чем постоянный прием средних доз АМГ или произвольный прием разных НПВС.
- Произвольный прием НПВС ассоциируется с меньшей желудочно-кишечной безопасностью, чем прием амтолметина гуацила.
- Прием максимальных доз АМГ ассоциируется с большей вероятностью дестабилизации АД, чем прием средних или минимальных доз препарата, и требует коррекции антигипертензивной терапии.



