Введение
В терапии анкилозирующего спондилита (АС) нестероидные противовоспалительные средства (НВПС) являются препаратом первой линии [1, 2]. НВПС при АС применяют длительно и в постоянном режиме [3]. Такой подход обусловлен хроническим персистирующим характером воспалительного процесса при АС и известной способностью НВПС замедлять рентгенологическое прогрессирование заболевания [4, 5].
Назначение НВПС ограничивается риском развития побочных эффектов, среди которых наиболее часто встречаются осложнения со стороны сердечно-сосудистой системы [6, 7], желудочно-кишечного тракта (ЖКТ) [8] и почек. В клинической практике для снижения риска желудочно-кишечных осложнений до недавних пор придерживались двух основных направлений – назначения ингибиторов протонной помпы и/или уменьшения степени ингибирования циклооксигеназы 1 (ЦОГ-1). В 2013 г. в РФ был зарегистрирован препарат группы НВПС – амтолметин гуацил (АМГ) [Найзилат], неселективный ингибитор ЦОГ-2 с принципиально новым механизмом гастропротективной активности. Препарат обладает способностью активировать желудочную NO-синтетазу, что приводит к увеличению синтеза слизистой оболочкой ЖКТ оксида азота, обладающего комплексным гастропротективным действием [9–11].
Таким образом, при хронической боли в спине, в т.ч. и при АС, препарат выглядит очень перспективным с учетом высокой гастроэнтерологической безопасности. При этом данные об эффективности АМГ при АС и его кардиоваскулярной безопасности ограничены [12]. Ранее мы представили промежуточные результаты исследования эффективности и кардиоваскулярной безопасности АМГ [13].
Целью настоящего исследования стала оценка эффективности и сердечно-сосудистой безопасности АМГ (Найзилат) для больных АС с интенсивной болью в нижней части спины.
Материал и методы
В статье представлены окончательные результаты открытого проспективного 12-недельного исследования КОРОНА (эффеКтивность и кардиОваскулярная безопасность пРименения амтОлметин гуацила для пациеНтов с хронической болью в нижней части спины и контролируемой Артериальной гипертензией). Регистрационный номер ЕГИСУ 115021010143 от 10.02.2015. Исследование одобрено локальным этическим комитетом Саратовского государственного медицинского университета им. В.И. Разумовского Минздрава России.
В исследование включены 60 пациентов старше 18 лет, отвечавших модифицированным Нью-Йоркским критериям АС (1984), подписавших информированное согласие на участие в исследовании [14]. Критерием включения в исследование стало наличие боли в нижней части спины, оцененной по визуальной аналоговой шкале в 4,0 и более баллов.
Допускалось наличие контролируемой артериальной гипертензии – АГ (под контролируемой АГ понимался достигнутый и стабильный уровень целевого артериального давления [АД] на фоне постоянной антигипертензивной терапии [АГТ], в обязательном порядке включавшей прием амлодипина). При приеме пациентом глюкокортикоидов их доза (эквивалентная преднизолону) не превышала 10 мг/сут и оставалась стабильной в течение 2 или более недель, предшествовавших исходному визиту (день 1-й). При применении пациентом метотрексата (не более 25 мг в неделю), сульфасалазина (не более 3,0 г/сут), антигипертензивных препаратов (c обязательным применением амлодипина), их доза была стабильной в течение 4 и более недель, предшествовавших исходному визиту (день 1-й). В случае приема анальгетиков их доза была стабильной в течение недели, предшествовавшей исходному визиту (день 1-й).

Критерии исключения из исследования: боль в нижней части спины травматического характера или острая боль в нижней части спины продолжительностью менее 3 месяцев; любые хронические заболевания в стадии обострения, внутривенное, внутримышечное или интра/периартикулярное введение глюкокортикоидов за 4 и менее недель до скрининга; наличие противопоказаний к назначению АМГ, согласно утвержденной инструкции; любая активная вирусная, бактериальная или грибковая инфекция на момент обследования, вирусный гепатит B или C, ВИЧ-инфекция; первичный или вторичный иммунодефицит; прием антикоагулянтов, двух дезагрегантов; острые психические заболевания, которые могли влиять на способность пациента понимать требования исследования; фибромиалгия, алкогольная зависимость или употребление наркотических веществ в течение 12 месяцев, предшествовавших исследованию; вакцинация живыми вакцинами менее чем за 12 недель до исходного визита; гиперчувствительность к любому компоненту исследуемого препарата; уровень гемоглобина <85 г/л; число нейтрофилов <2/мкл, число тромбоцитов <125/мкл; глюкоза крови натощак ≥7 ммоль/л, креатинин сыворотки крови >140 мкмоль/л для женщин или 160 мкмоль/л для мужчин; повышение активности аспартатаминотрансферазы (АСТ) или аланинаминотрансферазы (АЛТ), или щелочной фосфатазы (ЩФ), или γ-глутамилтранспептидазы (ГГТП) более чем в 3 раза относительно верхней границы нормы; бронхиальная астма, хроническая обструктивная болезнь легких или гиперреактивность бронхов, поллиноз; другая тяжелая неконтролируемая патология ЖКТ, печеночной, мочевыделительной, дыхательной, сердечно-сосудистой, нервной или эндокринной систем, онкогематологические заболевания.
Все пациенты были разделены на две группы: первая (n=41) – пациенты с контролируемой АГ, вторая группа (n=19) – без АГ.
Все пациенты получали АМГ в суточной дозе 1800 мг в течение 14 дней с последующим переходом на дозу 600 мг/сут. Продолжительность наблюдения за пациентами – 12 недель. При оценке эффективности АМГ первичной конечной точкой считали число пациентов, достигших уменьшения интенсивности боли в нижней части спины на 2 и более пунктов по числовой рейтинговой шкале (ЧРШ) через две недели, при оценке кардиоваскулярной безопасности – число лиц с возникновением стенокардии, фатального или нефатального инфаркта миокарда или внезапной коронарной смерти, острого нарушения мозгового кровообращения, фатального или нефатального инфаркта мозга в период исследования. Трижды зафиксированное повышение АД на 20 и более мм рт.ст. относительно исходного уровня считалось первичной конечной точкой безопасности. АД измеряли во время визитов – клиническое АД, также контролировали домашнее АД – пациентам выдавали дневники контроля АД (два раза в сутки).
Вторичными конечными точками при оценке эффективности являлись улучшение общей оценки боли, ночной боли, по данным ЧРШ, улучшение показателей подвижности позвоночника (тест Шобера и латеральная подвижность позвоночника в поясничном отделе) на 2-й и 12-й неделях, снижение показателей клинико-лабораторной активности заболевания на 2-й и 12-й неделях, при оценке кардиоваскулярной безопасности – АГТ за счет как увеличения дозы принимаемых ранее препаратов, так и добавления к лечению новых антигипертензивных средств в период исследования. Для определения активности АС рассчитывали индекс активности BASDAI (the Bath Ankylosing Spondylitis Activity Index) [15], изучали уровень С-реактивного белка, определенного высокочувствительным методом с применением реактивов фирмы Diasis (аппарат Hitachi). Для оценки функционального статуса определяли индекс BASFI (the Bath Ankylosing Spondylitis Functional Index) [16].
Статистический анализ выполнен с применением пакетов прикладных программ Statistica SPSS17 и Statistica 8.0 (StatSoft).Для проверки соответствия распределения признака нормальному распределению применяли методы Колмогорова–Смирнова и Шапиро–Уилка, нормальным считалось распределение при p>0,05. Для описания нормально распределенных количественных признаков использовалось среднее значение признака и среднее квадратичное отклонение (M±SD); для описания выборочного распределения признаков, отличающегося от нормального указывались медиана, верхний и нижний квартили – Me [Q25;Q75]. Для сравнения двух групп с нормальным распределением количественного признака определялся t-критерий Стьюдента для независимых групп (с учетом вида дисперсии признака, определенного методом Левена). Корреляция двух нормально распределенных количественных признаков изучалась с помощью метода Пирсона, при отклонении распределения от нормального, а также при анализе ассоциации качественных признаков использовался метод Спирмена. Сравнение достоверности межгрупповых различий количественных значений применяли тест Манна–Уитни. Различия считались достоверными при p<0,05 [17].
Результаты
По полу, возрасту, длительности заболевания, суммарному расчетному риску фатальных сердечно-сосудистых событий пациенты с АГ и без таковой были сопоставимыми. Различия выявлены по частоте курения, уровню исходного систолического АД, индексу массы тела – ИМТ (табл. 1).
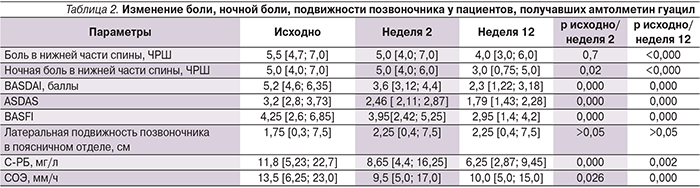
Исходная оценка боли, в т.ч. и в ночные часы, в нижней части спины, подвижность позвоночника у лиц с АГ и без нее были сопоставимыми (табл. 2).
Первичной конечной точкой (уменьшение боли на 2 и более пунктов) достиг 51 (85%) пациент из 60: 18 пациентов группы лиц с АГ и 33 – группы лиц без АГ. Средние показатели боли в спине, индексы активности АС и лабораторные показатели активности значимо снизились через 2 недели лечения (во время приема максимальной дозы препарата) вне зависимости от наличия или отсутствия АГ. Важно отметить, что снижение активности продолжилось и после уменьшения дозы до минимальной – 600 мг/сут, достигнув минимальных значений к 12-й неделе лечения (табл. 2).
За время исследования ни у одного из пациентов не было зарегистрировано возникновения стенокардии, фатального или нефатального инфаркта миокарда, внезапной коронарной смерти, острого нарушения мозгового кровообращения, фатального или нефатального АД ко 2-й неделе исследования, по данным дневников контроля АД: у четверых пациентов, ранее не имевших в анамнезе АГ, и у двух с исходно контролируемой АГ. Все пациенты с впервые развившейся АГ имели повышенный индекс массы тела (ИМТ) – 28,1 [24,3; 29,6] кг/м2, отягощенную наследственность по АГ и ишемической болезни сердца. Все лица с дестабилизацией АГ курили. Участники исследования, у которых не возникли сердечно-сосудистые осложнения, были моложе 34,66±7,4 против 44,3±8,8 года, имели меньший ИМТ – 24,4 кг/м2 (p<0,05). Примечательно, что повышение АД ощущал только один пациент с впервые диагностированной АГ, у остальных пациентов повышение АД было установлено в результате планового мониторинга АД. Всем пациентам выполнена коррекция/назначение АГТ, при этом отмены НВПС (АМГ) не потребовалось. Изменения/назначения АГТ в последующий период исследования не потребовалось. После 2-й недели исследования дестабилизации АД не зафиксировано ни у одного из пациентов.
В ходе исследования среднее систолическое АД снизилось. Исходное систолическое АД составило 129,8±15,2мм рт.ст., через две недели – 119,8 ±12,2 (р=0,00007 для сравнения с исходным), через 12 недель – 116,1±11,4 мм рт.ст. (р=0,000 для сравнения с исходным). У пациентов с контролируемой АГ исходно систолическое АД составило 134,6±16,3, у пациентов без АГ – 119,5±11,7 мм рт.ст. (р=0,002). Через две недели у пациентов с АГ систолическое АД составило 122,8±12,6 мм рт.ст. (p=0,0004 с исходным), через 12 недель – 1,7±11,9 (p=0,0000 с исходным). У пациентов без предсуществующей АГ через две недели систолическое АД составило 113,4±8,4 мм рт.ст. (p=0,07 с исходным), через 12 недель – 114,7±10,4 (р=0,23 с исходным).
Исходное диастолическое АД составило 77±7,2 мм рт.ст., через 2 недели – 74,5±6,1, через 12 недель – 72,1 мм рт.ст. (p>0,05 для всех).
Обсуждение
НВПС имеют высокую эффективность в лечении АС [18–20], причем у всех существующих препаратов она сопоставима [21]. Продемонстрированная в исследовании эффективность АМГ закономерна. Большинство исследований показывает бо́льшую эффективность высоких доз НВПС при АС [22]. На примере эторикоксиба ранее нами была показана несколько бо́льшая эффективность различных режимов дозирования НВПС у больных АС [24, 24]. В настоящем исследовании показано, что достигнутый в ходе лечения высокими дозами результат можно поддерживать приемом низких доз препарата, что может ассоциироваться с потенциально меньшим риском развития осложнений. Таким образом, впервые была применена деэскалационная схема применения НВПС в постоянном режиме. С учетом короткого периода исследования (12 недель) можно оценить только клинико-лабораторную эффективность этой схемы лечения. Безусловно, для оценки влияния такой схемы лечения на прогрессирование структурных изменений необходимы длительные проспективные наблюдения.
Другим важным моментом исследования стало изучение кардиоваскулярной безопасности АМГ (Найзилат), в т.ч. и у больных контролируемой АГ. У каждой молекулы НВПС имеется собственный профиль сердечно-сосудистой безопасности. Каждое отдельное ревматическое заболевание ассоциируется с собственным сердечно-сосудистым риском [25–28]. Например, применение эторикоксиба и диклофенака натрия ассоциируется с бо́льшим, чем применение целекоксиба и напроксена, сердечно-сосудистым риском а, у пациентов с АС риск развития сердечно-сосудистых событий выше, чем у их здоровых ровесников, но ниже, чем у больных ревматоидным артритом или системной склеродермией [25, 26, 29, 30]. При применении в течение двух недель высоких доз АМГ у больных АС мы не зарегистрировали сердечно-сосудистых событий (инфаркты миокарда и мозга, внезапная сердечная смерть, усиление недостаточности кровообращения). Однако у части пациентов (10%) в первые две недели лечения именно при приеме высоких доз препарата имело место некоторое повышение АД, что потребовало коррекции АГТ, но не отмены НВПС. Из шести пациентов повышение АД ощущал только один, что может косвенно отражать имеющуюся до вступления в исследование АГ у остальных пяти пациентов, выявленную лишь при амбулаторном мониторировании АД. Закономерно, что повышение АД отмечено лишь у больных АС с большим сердечно-сосудистым риском: у пациентов старшего возраста, курильщиков, пациентов с отягощенной наследственностью по АГ, ишемической болезни сердца.
В период наблюдения после 2-й недели АД было стабильным у всех пациентов. Это может быть следствием снижения дозы препарата в ходе исследования, отражением того, что первые 2 недели лечения НВПС являются самыми опасными для дестабилизации АД и пациенты нуждаются в более тщательном его мониторинге именно в этот период. Кроме того, стабильность АД после первых двух недель исследования может быть следствием адекватной АГТ. В то же время за период исследования у пациентов (особенно у пациентов с АГ) наблюдалась тенденция к снижению уровня систолического АД. Маловероятно, что снижение уровня систолического АД у пациентов с предсуществовавшей АГ объясняется выполненной двоим из 41 пациента коррекцией АГТ. Мы предполагаем, что снижение АД, скорее, отражает влияние эффективной терапии хронического болевого синдрома и воспаления. Уменьшение боли у лиц с АГ, возможно, имеет самостоятельный гипотензивный эффект. В целом применение АМГ ассоциировалось со снижением уровня систолического АД, в наибольшей степени выраженным у пациентов с контролируемой АГ.
Заключение
АМГ (Найзилат) показал эффективность при лечении боли в нижней части спины у больных АС, в т.ч. у лиц с контролируемой АГ. С целью профилактики сердечно-сосудистых осложнений всем пациентам, принимающим АМГ, необходимы контроль АД, коррекция уже имеющихся факторов риска АГ. А пациентам с высоким кардиоваскулярным риском необходим более тщательный мониторинг АД, по крайней мере в первые две недели приема препарата. В целом эффективность и безопасность АМГ при его более длительном применении требует дальнейшего изучения. В уточнении нуждается и возможность воздействия препарата на процессы костного ремоделирования.
Выводы
АМГ (Найзилат) в максимальной суточной дозировке уменьшает боль в спине и другие показатели активности АС.
Снижение максимальной суточной дозы АМГ до минимальной поддерживающей ассоциируется с сохранением достигнутого обезболивающего и противовоспалительного эффектов у пациентов с АС.
У больных АС при применении АМГ в течение 12 недель значимые сердечно-сосудистые события не зарегистрированы.
Применение АМГ у больных АС с повышенным риском сердечно-сосудистых событий (повышенный ИМТ, отягощенная наследственность по АГ и ишемической болезни сердца, курение) приводило к повышению АД у отдельных больных, что потребовало коррекции АГТ, но не отмены НВПС.
У больных АС с контролируемой АГ применение АМГ ассоциировалось со снижением систолического АД.



