Введение
Одним из ключевых способов раннего выявления меланомы кожи (МК) является проведение скрининговых обследований групп населения с высоким риском развития данной опухоли и их последующий динамический клинико-дерматоскопический мониторинг, поскольку обзорные фотографии всего кожного покрова позволяют отслеживать появление новых новообразований, а сравнение дерматоскопических снимков в динамике – выявлять динамические изменения в исследуемых пигментных новообразованиях кожи [1, 2]. Интервалы динамического мониторинга, по данным различных литературных источников, могут быть краткосрочными или долгосрочными и варьироваться от 3 до 6–12 месяцев. Динамические изменения, наблюдаемые в исследуемых невусах, подразделяют на 2 группы: значимые и незначимые. К незначимым изменениям относят такие, как общее изменение окраски (потемнение или посветление) новообразования, уменьшение числа пигментных точек, частичное исчезновение участков пигментной сети в центральной части с замещением на диффузную пигментацию, изменение числа коричневых глобул. Значимыми изменениями считают ассиметричное увеличение, очаговое изменение пигментации или структур, появление структур регресса, изменение цвета [3].
В настоящее время не вызывает сомнений польза длительного пожизненного наблюдения пациентов высокого риска с множественными меланоцитарными невусами. Например, пациентам с МК в анамнезе показано динамическое клинико-дерматоскопическое наблюдение, согласно клиническим рекомендациям по диагностике и лечению МК [4, 5]. В то же время ряд вопросов, связанных с проведением динамического мониторинга, остается недостаточно освещенным. Так, практически отсутствуют данные о тактике ведения и частоте наблюдений пациентов с другими факторами риска развития меланомы и единичными меланоцитарными невусами.
Также некоторые работы указывают на то, что единичные невусы не могут надежно гарантировать отсутствие риска развития меланомы. Об этом свидетельствуют как отдельные наблюдения развития меланомы у пациентов с единичными невусами [6, 7], так и некоторые исследования достаточно крупных выборок. Например, A. Geller et al. сообщают, что такие характеристики, как общее число и размер меланоцитарных невусов, не должны играть первостепенного значения в определении пациентов, подлежащих обследованию с целью исключения МК [8]. Авторы исследовали корреляцию числа меланоцитарных и атипичных невусов с толщиной меланомы.
В исследование включили 566 пациентов с меланомой. Было установлено, что у большинства обследованных пациентов (66,4% [n=376]) имелись лишь единичные (0–20) невусы.
У 20,5% (n=116) пациентов зарегистртровали среднее число невусов (от 20 до 50) и лишь у 13,1% (n=74) отмечались множественные меланоцитарные невусы. Кроме того, у большинства пациентов (73,3% [n=415]) отсутствовали атипичные невусы. При обследовании лишь у 14,5% (n=82) пациентов обнаружили не более 5 атипичных невусов и у 12,2% (n=69) пациентов наблюдали более 5 атипичных невусов. Авторы пришли к выводу, согласно которому при проведении обследования не стоит полагаться только на общее число имеющихся меланоцитарных невусов как на единственный фактор определения степени риска, т.к. у пациентов с немногочисленными невусами обнаруживалась меланома в 66,4% случаев.
И наконец, некоторые фундаментальные исследования подтверждают возможность наличия генетической предрасположенности к развитию меланомы у пациентов с немногочисленными невусами. Так, австралийские исследователи выявили варианты гена рецептора меланокортина 1-го типа MC1R (D84E, R142H, R151C, I155T, R160W, D294H), ассоциированные с риском развития МК у пациентов с небольшим числом меланоцитарных невусов [9].
Таким образом, наличие немногочисленных невусов у пациента не позволяет полностью исключить риск развития МК. В то же время работы, сравнивавшие динамические изменения в множественных и немногочисленных меланоцитарных невусах, позволивших обосновать разную тактику ведения этих пациентов, отсутствуют.
Цель исследования: изучение час-тоты выявления клинико-дерматоскопических изменений меланоцитарных невусов у пациентов с множествен-ными и единичными невусами, имеющих факторы риска развития меланомы.
Методы
В программу динамического дерматоскопического мониторинга были включены 75 пациентов с наличием одного и более факторов риска развития МК1. Пациенты были распределены в две группы в зависимости от количества имеювшихся меланоцитарных новообразований кожи.
Критериями включения для I группы (n=43) стали наличие 50 и более меланоцитарных невусов; наличие одного и более факторов риска развития меланомы; возраст пациентов старше 18 лет; наличие подписанного информированного добровольного согласия.
Критерии включения для II группы (n=32): наличие менее 50 меланоцитарных невусов; наличие одного и более факторов риска развития меланомы; возраст пациентов старше 18 лет; подписание пациентом информированного добровольного согласия.
Всем пациентам было проведено анкетирование с заполнением индивидуальной регистрационной карты, содержавшей разделы с вопросами о наличии факторов риска развития МК2. Пациент отвечал на вопросы об анамнестических факторах риска, врач регистртровал факторы риска, определенные при клиническом дерматологическом обследовании и дерматоскопии.
Затем было проведено клиническое дерматологическое обследование, результаты которого врач вносил во вторую часть индивидуальной регистрационной карты, где указывал дерматологический диагноз, степень тяжести заболевания, а также факторы риска развития МК, выявленные при осмотре пациента3.
На следующем этапе с помощью видеодерматоскопа FotoFinder Dermoscope ATBM получали не менее 20 клинических цифровых изображений пациента в восьми ракурсах; при наличии новообразований в труднодоступных локализациях получали их снимки в дополнительных ракурсах. Также регистрировали дерматоскопические изображения меланоцитарных новообразований размером более 2 мм в диаметре. Далее проводилось контрольное фотокартирование в динамике с интервалом не менее 2 месяцев.
Иссечение новообразования кожи с патоморфологическим исследованием проводилось, когда выявленные дерматоскопические изменения в динамике соответствовали подозрительным по A. Marghoob (2012): асимметричное увеличение, изменение очертаний, любые другие изменения цвета помимо общего побледнения или потемнения окраски, изменения дерматоскопических структур, за исключением расцененных как незначимые. При незначимых изменениях рекомендовали повторный осмотр через 3 месяца; при нарастании изменений проводили гистологическое исследование.
В дальнейшем полученные результаты патоморфологического исследования сопоставляли с клиническими и дерматоскопическими характеристиками, включая особенности изменений в динамике, для оценки их клинической значимости.
Все полученные данные, зафиксированные в анкетах, далее были перенесены в таблицу Excel для последующего статистического анализа результатов. Количественные данные перед анализом оценивали на нормальность распределения по критерию Колмогорова–Смирнова. При соответствии распределения данных нормальному для сравнения групп использовался t-критерий Стьюдента, в противном случае – критерий Манна–Уитни. Сравнение качественных показателей проводилось с использованием χ2-критерия Пирсона. При анализе четырехпольных таблиц, если хотя бы в одной ячейке четырехпольных таблиц или более чем в 20% многопольных таблиц ожидаемое значение оказывалось меньше 5, то для анализа использовался точный критерий Фишера. В качестве демонстрации влияния фактора на исход применяли расчет отношения шансов (ОШ) и его 95% доверительного интервала (ДИ). Во всех случаях уровень значимости принимался как p≤0,05.
Результаты
Пациенты в исследуемой выборке (n=75) были распределены в две группы. В I группу были включены 43 пациента с множественными меланоцитарными невусами (>50), во II – 32 пациенты с единичными меланоцитарными невусами (<50).
В I группе доля женщин составила 60,5% (95% ДИ: 45,58–73,63), во II – 75% (95% ДИ: 57,89–86,75). Возраст в I и II группах составил 44,35±11,96 и 40,81±17,37 года (р=0,3).
Общее число меланоцитарных новообразований, включенных в динамическое наблюдение, в I и II группах составило 9676 и 1274 соответственно. Среднее число меланоцитарных новообразований, выявленных у 1 пациента, составило в I группе 225±234,58, во II – 40,75±14,26 (р>0,001).
Структура основных клинических диагнозов с учетом числа меланоцитарных новообразований в исследуемых группах представлена в табл. 1.

В ходе проведенного сравнительного анализа не было выявлено статистически значимых различий по спектру исследуемых факторов риска в обеих группах, кроме отягощенного семейного анамнеза по меланоме (ОШ=4,15, 95% ДИ: 1,23–14,00; р=0,017), чаще встречаемого среди пациентов I группы (16/37,2%) по сравнению со II (4/12,5%). Полученные данные, возможно, были обусловлены клинико-анамнестическими особенностями пациентов I группы и наличием у них практически в половине случаев синдрома диспластических невусов и FAMMM-синдрома (табл. 1).
В ходе наблюдения в I группе у части новообразований клинически отмечался рост и изменение интенсивности пигментации. Так, наблюдалось увеличение площади в 61 (12,9%) новообразовании, неравномерная потеря пигмента до светло-коричневого цвета в 109 (23%), в 98 (21%) меланоцитарных невусах наблюдалось неравномерное усиление окраски до темно-коричневого цвета.
Также за период наблюдения в I группе были отмечены динамические дерматоскопические изменения в 473 (4,89%) из 9676 меланоцитарных новообразований. При этом значимые дерматоскопические изменения (табл. 2) были отмечены в 60 (12,7% от изменившихся очагов) меланоцитарных новообразованиях, которые в дальнейшем были удалены с последующим патоморфологическим исследованием.
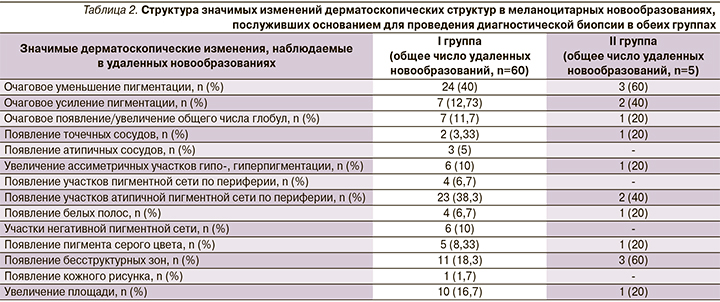
Структура патоморфологических диагнозов иссеченных новообразований представлена в табл. 3.
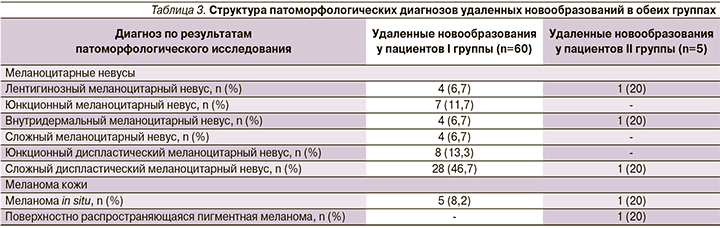
В результате обследования у 3 пациентов I группы обнаружено 5 меланом in situ (8,3% от общего числа иссеченных новообразований). Из них у 2 пациентов выявлено по 2 гистологически верифицированные меланомы. У всех 3 пациентов наблюдалось сочетание таких факторов риска, как отягощенный семейный анамнез по меланоме, признаки фотоповреждения кожи, светлые фототипы кожи (II), более 100 меланоцитарных невусов, наличие атипичных невусов, врожденные меланоцитарные невусы малого размера.
В ходе наблюдения во II группе клинически наблюдалось увеличение площади 7 (5,7%) новообразований, неравномерная потеря пигмента до светло-коричневого цвета отмечалась в 39 (32%) новообразованиях, в 16 (13,1%) меланоцитарных невусах – неравномерное усиление окраски до темно-коричневого цвета.
Во II группе в ходе дерматоскопического мониторинга изменились 122 (9,58%) из 1274 меланоцитарных новообразований. Значимые дерматоскопические изменения при этом были отмечены в меланоцитарных новообразованиях у 5 пациентов (табл. 2), которые впоследствии были иссечены с патоморфологической верификацией диагноза (табл. 3). Согласно полученным результатам, в двух случаях была обнаружена МК, что составило 40% от общего числа иссеченных новообразований в исследуемой группе сравнения при динамическом наблюдении. У 2 пациентов с МК отмечалось сочетание нескольких факторов низкого риска развития МК: светлый фототип кожи (II), признаки фотоповреждения кожи.
Примечательно, что при опросе пациенты обеих групп отмечали факт появления новых невусов или изменения имевшихся невусов (увеличение в размерах, изменения окраски и краев невусов). Статистически значимых различий (р=0,225) в обеих группах при сравнительном анализе не выявлено, но в процентном соотношении чаще все же отмечали изменение образований пациенты с множественными меланоцитарными невусами. При дальнейшем анализе эти данные не коррелировали с таковыми медицинского осмотра и, наоборот, наибольшая частота изменившихся невусов была характерной для немножественных.
Проведенный сравнительный анализ выявил статистически значимые различия в обеих группах по таким критериям, как изменившиеся и удаленные невусы (табл. 4).
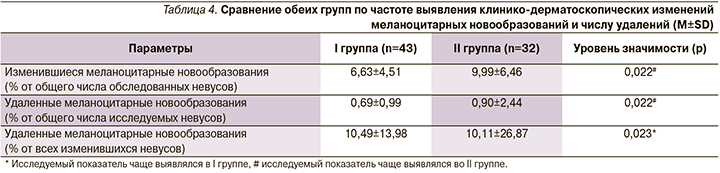
Таким образом, единичные невусы менялись не реже, чем множественные невусы, а доля изменившихся новообразований у пациентов с единичными невусами превысила этот показатель в группе пациентов с множественными.
Обсуждение
По опыту зарубежных исследователей, при динамическом наблюдении пациентов с множественными меланоцитарными невусами (с диагнозами «синдром диспластических невусов», «FAMMM-синдром») доля меняющихся новообразований варьировалась от 6,4 до 49,9%, при этом среднее число исследуемых новообразований было невелико и составляло от 1,4 до 16,8 [10–14]. В настоящем исследовании среднее число множественных меланоцитарных невусов, выявленных у одного пациента, оказалось значительно больше и составило 225±234,58, что может объяснить невысокую долю меняющихся новообразований (4734/89%) по сравнению с таковой в упомянутых выше исследованиях.
Международное дерматоскопическое общество предлагает применять к пациентам с низким риском развития МК простой дихотомный метод. Если при обследовании новообразований выявлены подозрительные дерматоскопические признаки, то рекомендовано их иссечение или краткосрочный мониторинг [15]. В случае отсутствия подозрительных новообразований дальнейшего наблюдения не требуется. Как правило, к факторам низкого риска развития МК относят отсутствие атипичных и врожденных меланоцитарных невусов, наличие единичных меланоцитарных невусов общим числом не более 15, отсутствие отягощенного семейного анамнеза по меланоме и личного анамнеза по злокачественным опухолям кожи, отсутствие солнечных ожогов и инсоляции [1]. В ходе настоящего исследования продемонстрированы диаметрально противоположные результаты, указывающие на необходимость динамического наблюдения пациентов группы низкого риска развития МК, т.к. у пациентов с немногочисленными невусами из динамически меняющихся новообразований в 40% случаев выявлена МК. При этом у пациентов с обнаруженной меланомой отмечалось сочетание нескольких факторов низкого риска развития МК.
Также известно, что риск развития МК очень низкий у пациентов с единичными простыми приобретенными невусами и может прямо пропорционально повышаться с увеличением общего числа невусов [1, 2, 16]. Однако полученные данные настоящего исследования указывают, что у 4 (12,5%) из 23 пациентов с единичными невусами есть такие факторы риска развития меланомы, как отягощенный семейный анамнез.
Кроме того, в исследовании, проведенном T. Buhl et al. [17], соотношение меняющихся злокачественных и доброкачественных новообразований составило 1:10 По данным настоящего исследования, у пациентов с множественными невусами это соотношение составило 1:11, у пациентов с немногочисленными невусами – 1:1,5, что указывает на необходимость наблюдения пациентов с немногочисленными невусами.
По результатам проведенного исследования доля гистологически верифицированных меланом среди новообразований со значимыми дерматоскопическими изменениями у пациентов с единичными невусами составила 40%, у пациентов с множественными невусами – 9,1%, что диктует необходимость поиска новых алгоритмов наблюдения за пациентами с факторами риска с учетом числа новообразований на кожном покрове.
Выводы
В ходе динамического наблюдения установлено, что у пациентов с единичными меланоцитарными невусами и факторами риска МК изменения дерматоскопических структур в меланоцитарных невусах в процессе мониторинга выявлялись не реже, чем у пациентов с множественными меланоцитарными невусами (p=0,022). Поэтому пациентов и с единичными, и с множественными меланоцитарными невусами кожи необходимо наблюдать со схожей частотой проведения клинических осмотров и включать в программу динамического клиникодерматоскопического мониторинга.
Вклад авторов. Н.Н. Потекаев, А.В. Миченко, Д.В. Романов – концепция и дизайн исследования. И.И. Вахитова – сбор и обработка материала, написание текста. И.И. Вахитова, А.Ю. Бражников – статистическая обработка данных. А.В. Миченко, К.С. Титов, Д.В. Романов – редактирование.



