Современная демографическая ситуация характеризуется стремительным старением населения всех стран. Согласно докладу, опубликованному фондом ООН в области народонаселения, в 2014 г. темп годового прироста населения в возрасте 60 лет и старше превысил темпы роста общей численности населения почти в 3 раза. С 1994 по 2014 г. численность этой возрастной группы увеличилась почти вдвое, ожидается, что к 2050 г. ее доля достигнет 21%. Повышается возраст и самого пожилого населения1. Так, доля людей в возрасте 80 лет и старше («людей позднего пожилого возраста») в составе пожилого населения в 2014 г. составила 14%, а к 2050 г. прогнозируется ее увеличение до 19%2 [1]. Принимая во внимание современные демографические тенденции, прогнозируется, что в России к 2050 г. почти каждый третий человек будет находиться за порогом 60 лет [2].
Результаты исследования, проведенного в 188 странах, говорят о том, что число хронических заболеваний у лиц пожилого возраста растет, а их течение принимает более тяжелые формы [3]. Нельзя забывать о том, что злокачественные опухоли поражают людей всех возрастов, но гораздо чаще возникают в пожилом возрасте. Так, в России 67,9% случаев злокачественных новообразований в мужской и 63,5% в женской популяциях диагностируются у лиц 60 лет и старше [4]. Больные злокачественными новообразованиями безусловно составляют одну из основных групп пациентов, страдающих хронической болью. При этом в генерализованной стадии заболевания в обезболивании нуждаются до 90% пациентов [5–9].
К наиболее частым причинам возникновения хронической боли у пожилых, не связанным с онкологическим заболеванием, относятся дегенеративно-дистрофические изменения позвоночника и заболевания суставов (остеоартроз, ревматоидный артрит, другие артропатии, стеноз позвоночного канала), ревматическая полимиалгия, фибромиалгия, постгерпетическая невралгия, постинсультные болевые синдромы, переломы позвонков и костей конечностей, связанные с остеопорозом; длительная иммобилизация и связанные с ней контрактуры и пролежни, полинейропатии при заболеваниях периферических сосудов [10–12]. Не менее 20% лиц 60 лет и старше страдают хронической болью, а в возрасте старше 75 лет хроническая боль отмечается более чем у половины мужчин и почти у 90% женщин [10, 13–16]. По данным крупных исследований, среди страдающих болью пожилых людей 60% оценивают свою боль как «средней интенсивности» и около 25% как «сильную» [17, 18].
Феномен хронической боли у пожилых людей отличается некоторыми особенностями. Прежде всего это множественные причины и полиморбидные клинические проявления болевого синдрома. Действительно, нередко развитие хронической боли нельзя объяснить каким-то определенным патологическим процессом и в формировании мультифакторного болевого синдрома принимают участие как физиологические, так и психологические компоненты [13, 19]. В то же время различные сопутствующие заболевания усложняют не только оценку боли и выделение ее ведущего патогенетического механизма, но и лечение пациента. При проведении терапии пожилых пациентов нельзя игнорировать и физиологию возрастных изменений. С одной стороны, это снижение эффективности фармакотерапии у таких пациентов ввиду замедления процессов всасывания веществ из желудочно-кишечного тракта, с другой – повышение анальгетической активности некоторых классов препаратов (например, опиоидов). Еще ряд особенностей, которые необходимо учитывать при проведении обезболивания у пациентов пожилого возраста, – это повышенная частота развития нежелательных реакций, риски лекарственных взаимодействий, изменение фармакокинетических параметров вследствие замедления почечной экскреции и метаболических процессов в печени [20]. Так, у пациентов пожилого возраста увеличивается риск развития делирия (а некупированная боль может способствовать повышению этого риска) и в то же время отмечаются нарушения когнитивных функций на фоне применения многих препаратов центрального действия. В связи с этим появляется необходимость постоянного врачебного контроля [21].
В рамках гериатрической практики характерно частое одновременное использование нескольких групп лекарственных средств, представители которых действуют на различные патологические факторы. Таким образом, еще одной спецификой терапии пациентов пожилого возраста является вынужденная «политерапия» и полипрагмазия.
Подбор комбинации совместимых препаратов (а в оптимальном варианте – синергистов) рассматривается как одна из наиболее важных и в то же время сложных задач современной фармакотерапии. Врач обязан прогнозировать взаимодействие лекарственных средств, усложненное обоснованной полипрагмазией.
У всех пациентов пожилого возраста с болью средней или тяжелой степеней выраженности с появлением функциональных нарушений или снижением качества жизни вследствие боли различного генеза следует рассматривать целесообразность назначения опиоидных обезболивающих средств [20–23]. На сегодняшний день уже ни у кого не возникает сомнений, что назначение опиоидных анальгетиков (ОА) показано более 80% инкурабельных онкологических больных и основной проблемой обезболивания этих пациентов является вопрос доступности в регионах достаточного количества неинвазивных форм лекарственных препаратов, признанных оптимальными для лечения хронической боли у пациентов любого возраста [24–27].
Пожалуй, самой актуальной задачей в настоящее время является определение тактики назначения ОА пожилым пациентам неонкологического профиля, особенно с учетом указанных выше особенностей фармакотерапии таких больных.
Имеются лишь единичные исследования эффективности применения ОА для купирования хронического болевого синдрома у лиц пожилого и старческого возраста, но в заключении международной группы экспертов по шести наиболее часто применяющимся в клинической практике ОА делается вывод об их клинической эффективности при купировании хронического болевого синдрома у лиц пожилого возраста [20]. Следует отметить, что рандомизированные контролируемые исследования, в которых сравнивался бы опыт применения различных ОА, до сих пор проводились лишь с участием пациентов среднего возраста, но не гериатрических больных (>75 лет). Более того, очень мало данных о специфике и частоте развития нежелательных реакций ОА у больных пожилого возраста с полиморбидной патологией [21]. Поэтому у практикующего врача возникает вопрос: какова оптимальная тактика опиоидной терапии пациентов пожилого возраста с заболеваниями неопухолевой природы?
Здесь необходимо подчеркнуть, что более целесообразно анализировать тактику терапии болевых синдромов не в соответствии с градацией «онколо-гический»/«неонкологический» пациент, а в соответствии с прогнозом в отношении жизни, т.к. тактика анальгетической терапии зависит не от диагноза, а от прогноза или динамики состояния больного. При назначении ОА пациентам с благоприятным прогнозом в отношении жизни тактика анальгетической терапии наряду с избавлением от боли и профилактикой ее хронизации должна, по мнению авторов, сочетаться с профилактикой формирования у пациента опиоидной зависимости и, соответственно, с планированием применения ОА только на время обострения боли, с возможностью последующей их отмены [27, 28].
Проблема хронизации боли давно изучается российскими учеными и отражена в ряде публикаций, в которых подчеркивается, что своевременно начатая адекватная анальгезия снижает риск формирования хронического болевого синдрома [29–32]. То есть если назначенная неопиоидная противоболевая терапия неэффективна, риск хронизации боли повышается.
Даже в тех случаях, когда проводимая неопиоидная терапия полностью патогенетически обоснована, ее недостаточная эффективность может способствовать формированию дополнительной патологической симптоматики:
- прессорных сердечно-сосудистых реакций;
- периферического вазоспазма;
- нарушения реологических свойств (повышение вязкости) крови;
- снижения тканевого и органного кровотока;
- метаболического ацидоза, тканевой гипоксии;
- психоэмоциональных нарушений.
При этом необходимо учитывать, что возникновение и/или усугубление патологической симптоматики ухудшает качество не только анальгезии, но и терапии основного и/или сопутствующих заболеваний, что для пожилых пациентов становится фатальным фактором. Примером таких проявлений в ответ на неконтролируемую боль могут служить тахикардия и повышение артериального давления, снижающие эффективность антигипертензивной терапии. У больных сахарным диабетом в ответ на неэффективное обезболивание отмечается повышение глюкозотоксичности, требующей усиления сахаропонижающей терапии и приводящей к нарастанию проявлений диабетической нейропатии, что в свою очередь усложняет терапию болевого синдрома. Таким образом, очевидна необходимость своевременного начала адекватной анальгетической терапии.
В отсутствие полноценного эффекта неопиоидной анальгетической терапии, возможности которой для пожилых пациентов ограничены в первую очередь применением более низких доз, целесообразно усиление терапии ОА, которые в дальнейшем по мере наступления эффекта патогенетически обоснованной неопиоидной терапии могут постепенно отменяться или назначаться в снижающихся дозах.
К сожалению, при лечении боли неонкологической природы ОА (в комбинации с патогенетически обоснованной терапией и несмотря на их способность полностью контролировать боль даже в низких дозах) в настоящее время назначаются только после достаточно длительного периода неэффективной неопиоидной терапии (если назначаются вообще). По мнению авторов, подобная тактика связана не только с недостаточным знанием врачами нормативно-правовых актов, регламентирующих оборот ОА (о чем уже говорилось выше), но и с недостаточным знанием фармакологических свойств опиоидных препаратов.
Хотя выбор ОА для лечения хронического болевого синдрома должен в первую очередь определяться интенсивностью боли, немаловажным фактором также является и прогноз в отношении жизни пациента, благоприятный характер которого требует назначения лекарственных средств с минимальным наркогенным потенциалом [28].
Таким образом, тактику выбора как самого ОА, так и его лекарственной формы должны определять следующие факторы:
- Интенсивность боли (выбор ОА в соответствии с его анальгетическим потенциалом).
- Прогноз в отношении жизни пациента.
- Планируемая продолжительность применения ОА (чаще всего основывается на прогнозе в отношении жизни пациента).
В соответствии с делением боли на «умеренную» и «сильную» назначаются «слабые» и «сильные» опиоиды. Однако такое деление достаточно условно. К «сильным» опиоидам принято относить ОА, по анальгетическому эффекту сопоставимые с морфином3. Однако необходимо понимать, что при этом сопоставляются дозы, которые в готовых лекарственных формах могут значительно различаться. Таким образом, при «умеренной» боли могут применяться как «слабые», так и «сильные» опиоиды, но последние в низких дозах. Подробный анализ использования конкретных препаратов достаточно полно отражен в специальной литературе, но здесь необходимо отметить, что для терапии умеренной боли у пожилых пациентов с благоприятным жизненным прогнозом наиболее целесообразно использование ОА ненаркотического ряда.
В настоящее время самым безопасным с точки зрения формирования опиоидной зависимости препаратом признан трамадол, используемый при лечении различных видов боли как в общей медицинской, так и в работе различных специалистов – ревматологов, неврологов, травматологов, хирургов, урологов и др. Назначение трамадола не ограничивается ни одним из нормативных документов, и его может самостоятельно назначать и выписывать врач любой специальности в необходимом для пациента количестве. Обширный опыт его применения во многих странах и целенаправленные клинические исследования указывают на крайне редкое развитие пристрастия к препарату, которое чаще всего является следствием длительного применения высоких доз. Опиоидный механизм действия трамадола как агониста опиоидных рецепторов выражен в сотни раз слабее, чем у морфина, и его достаточный для терапии умеренной боли анальгетический эффект связан с синергизмом опиоидного и неопиоидного механизмов – блокадой обратного захвата серотонина и норадреналина в центральной нервной системе, активирующей механизмы нисходящего контроля боли.
Следует подчеркнуть, что применение трамадола в высоких дозах, способствующих повышению серотонинергической активности, может вызывать такие симптомы, как головная боль, беспокойство, спутанность сознания, гиперрефлексия, миоклония. Аналогичная симптоматика может также быть проявлением дегенеративных заболеваний, часто встречающихся у лиц пожилого возраста, поэтому указанные признаки легкого серотонинового синдрома не всегда распознаются.
В настоящее время одним из ключевых принципов адекватной анальгезии является комбинирование ОА с неопиоидными препаратами. Это обеспечивает мультимодальное (c вовлечением различных механизмов) действие, позволяет повышать эффективность обезболивания, уменьшать дозы каждого компонента терапии и помогает оптимизировать лечение боли у пациентов пожилого возраста.
Классическая схема фармакотерапии боли должна также строиться с учетом факторов, снижающих риск развития толерантности и зависимости, предусматривать сочетание ОА с неопиоидными средствами. При создании готовых фиксированных комбинаций должны учитываться возможные лекарственные взаимодействия, а также как физико-химические, так и биохимические факторы.
В настоящее время на территорию РФ поставляется только один комбинированный лекарственный анальгетик, в состав которого входит трамадол – самый безопасный c клинической и наркогенной позиций опиоид в сочетании с рекомендуемым ВОЗ неопиоидным анальгетиком парацетамолом – Залдиар. Одна таблетка комбинированного препарата, содержащего трамадол и парацетамол (кТП), содержит: трамадола гидрохлорида – 37,5 мг, парацетамола – 325 мг, т.е. более низкие дозы каждого активного вещества по сравнению с дозами в монопрепаратах для приема внутрь (трамадол – 50 мг в 1 таблетке, парацетамол – 500 мг в 1 таблетке). Максимальная суточная доза кТП – 8 таблеток: трамадола – 300 мг, парацетамола – 2600 мг, т.е. также ниже, чем при монотерапии каждым из этих препаратов (соответственно 400 и 4000 мг/сут).
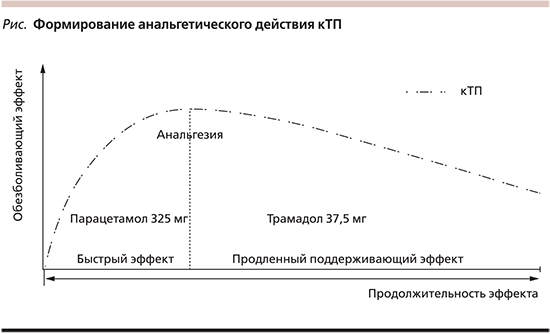
Оба компонента кТП почти полностью (до 90%) всасываются в желудочно-кишечном тракте. На рисунке видно, что неопиоидный препарат парацетамол обеспечивает быстродействующий эффект, который усиливается и пролонгируется с началом действия трамадола (см. рисунок). Парацетамол относится к анальгетикам центрального действия, механизмы которого продолжают изучаться. Описано его действие на циклооксигеназу центральной нервной системы и на NMDA-рецепторы, что препятствует развитию гипералгезии [33, 34].
В исследованиях, проведенных в США, отмечено, что после приема парацетамола статистически значимо снижалась оценка боли. Важно, что это касалось не только собственной боли, но и чужой, т.е. имел место и психоэмоциональный компонент, который связывается авторами с влиянием на серотониновую, опиоидную и каннабиноидную системы [36].
В некоторых работах отмечается действие парацетамола и на каннабиноидные рецепторы, что открывает еще одну сторону его анальгетической активности [37]. Таким образом, с учетом двойного противоболевого механизма действия трамадола кТП имеет множественный механизм тормозящего действия на передачу болевых импульсов в структурах головного и спинного мозга, что дает предпосылки к его эффективному и безопасному применению пациентами пожилого возраста.
С целью определения места кТП в гериатрической практике, а также для оценки его эффективности и переносимости пациентами пожилого возраста нами было проведено исследование. В исследовании участвовали 102 пациента в возрасте от 70 до 86 лет с различными, чаще поливалентными, причинами хронической боли. Основные жалобы предъявлялись на боли в спине и крупных суставах. Все пациенты получали патогенетически обоснованную терапию, на фоне которой сохранялся болевой синдром умеренной интенсивности по вербальной шкале. У 24 (21,5%) пациентов в анамнезе были эпизоды применения трамадола в разовой дозе 50 мг, но от его дальнейшего назначения пациенты отказывались в связи с нежелательными побочными эффектами (тошнота, слабость, заторможенность, головокружение). Пациентам назначался кТП на фоне продолжающейся патогенетически обоснованной терапии по следующей стандартной схеме – 1 таблетка (трамадол – 37,5 мг, парацетамол – 325 мг) каждые 8–12 часов. Оценка анальгетического эффекта комплексной терапии начиналась со вторых суток применения кТП и проводилась до его отмены в связи со снижением интенсивности боли или до окончания срока исследования – 2 месяцев. Эффект оценивался по 4-балльной шкале: 4 балла – полное обезболивание; 3 – полное обезболивание в покое, достаточное (не ограничивающее привычную нагрузку) при движении; 2 – удовлетворительное (не требующее приема дополнительных анальгетиков), но ограничивающее привычную нагрузку; 1 – неудовлетворительное (требующее приема дополнительных анальгетиков); 0 баллов – без эффекта. Регистрировались все нежелательные побочные эффекты, связываемые пациентами с началом применения кТП.
Адекватное обезболивание было достигнуто у 96 (85,7%) больных, из них полное и достаточное – у 64 (57,1%) пациентов, удовлетворительное – у 32 (28,6%) пациентов. Не было больных, отказавшихся от лечения кТП по причине полной неэффективности.
Значимым направлением исследования был анализ побочных эффектов при применении кТП, проведенный с учетом патологических симптомов, характерных для основного и сопутствующих заболеваний, которые имелись у пациентов. Ввиду того что у больных исследуемой группы преобладали заболевания сердечно-сосудистой и нервной систем, проводился мониторинг артериального давления, частоты сердечных сокращений, а также таких симптомов, как сонливость, головокружение. Нежелательные побочные эффекты наблюдались у 7,2% больных. При этом отмечено, что большинство из них имели временный преходящий характер – в первые 2–3 суток терапии. Так, сонливость отмечена у 0,9%, преходящее головокружение – у 3,1%. В 0,8% случаев имела место сухость во рту, в 2,1% – тошнота. В 0,3% были выявлены аллергические кожные проявления – зуд, крапивница, ставшие причиной отмены кТП. Клинически значимых нарушений показателей артериального давления и частоты сердечных сокращений в исследуемой группе отмечено не было. Указанный уровень нежелательных побочных эффектов значительно отличается от такового при применении трамадола (примерно у половины пациентов) [36, 37].
Интересные данные представлены в Открытом отчете о применении кТП Департаментом здравоохранения и старения населения Правительства Австралии в 2012 г. [38]. В документе проведен сравнительный анализ информации о наиболее часто встречающихся побочных реакциях (>1%) при приеме комбинации трамадол/парацетамол и изолированном приеме трамадола лицами 65 лет и старше (см. табицу).
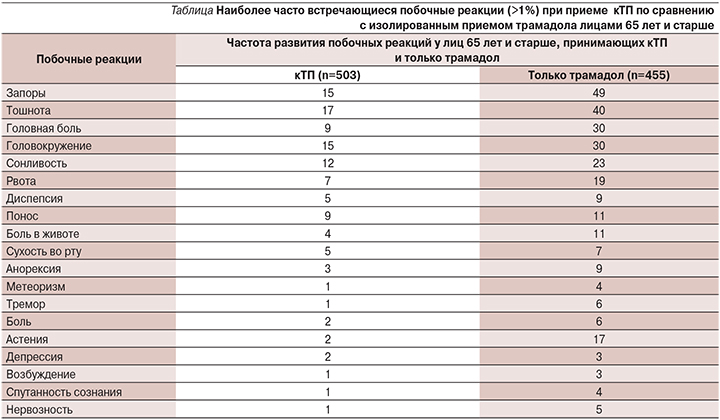
Очевидно, что в группе пациентов пожилого возраста указанная разница должна определять тактику выбора препарата. Кроме того, как показало проведенное во Франции обсервационное многоцентровое открытое перспективное исследование эффективности и переносимости кТП пожилыми пациентами (5495 больных, средний возраст которых составил 80,5±4,5 года), уменьшение интенсивности боли отмечалось у 50% пациентов, представители этой возрастной группы хорошо переносили терапию препаратом [39].
В заключение необходимо отметить, что лечение пожилых людей, страдающих хронической болью, особенно обусловленной патологией неонкологической природы, является сложной задачей, в решении которой основная дилемма – определить, что важнее: польза от препарата или возможные риски в связи с фармакологическим вмешательством [40]?
При купировании хронической боли (особенно у больных в возрасте 75 лет и старше) сложно подобрать оптимальную дозу препарата и прогнозировать возможности развития нежелательных реакций. Тактика использования ОА при лечении пожилых пациентов настоятельно рекомендует соблюдение принципа «начинать с малых доз и увеличивать дозу постепенно».
Физиологические изменения, связанные со старением, имеют прогрессирующее течение, но степень их выраженности достаточно вариабельна у разных людей и зависит от многих факторов. В большинстве случаев хроническая боль в пожилом возра-сте может успешно корректироваться, если стратегия терапевтических воздействий будет приспособлена к спе-цифическим особенностям каждого конкретного случая. Такой подход требует тщательной оценки болевого синдрома с учетом всех физиологических, психологических и социальных особенностей людей пожилого и старческого возраста и выбора правильной тактики обезболивания.



