Введение
Более трети населения Земли ежегодно страдают от болей в шее. По частоте боль в шее уступает лишь двум другим болевым синдромам: головной и боли в пояснично-крестцовой области. Как и в случае боли в пояснично-крестцовой области, причиной цервикалгии является вертеброгенная патология, особенно дегенеративно-дистрофические изменения позвоночника.
Выделяют три основных варианта цервикалгии:
- аксиальная боль в шейном отделе позвоночника (аксиальная цервикалгия) – 84%;
- цервикальная радикулопатия – 10%;
- цервикальная миелопатия – 5%.
На «специфическую патологию» приходится 1% цервикалгий. Наиболее интенсивная и стойкая боль характерна для цервикальной радикулопатии (ЦРП), подходы к диагностике и лечению которой предлагается рассмотреть в данной статье.
Эпидемиология цервикальной радикулопратии
Распространенность ЦРП варьируется от 1,2 до 5,8 случая на 1000 человек, при этом ежегодно выявляется от 0,83 до 1,79 нового случая заболевания на 1000 человек. Пик заболеваемости приходится на пятое десятилетие жизни.
К основным факторам риска цервикальной радикулопатии относятся:
- женский пол;
- пожилой возраст;
- профессии, связанные с повышенной осевой нагрузкой (например, стоматологи, хирурги, водители, офисные работники, длительное время работающие за компьютером);
- курение;
- гиподинамия;
- боли в других отделах позвоночника;
- травма шейного отдела позвоночника (особенно хлыстовая) [1, 2].
Этиология и патогенез цервикальной радикулопатии
Наиболее частыми причинами ЦРП являются выпячивание (протрузии) межпозвонковых дисков и шейный спондилез. Патогенез радикулопатии связан как с механической компрессией корешка и/или спинномозгового ганглия, так и со вторичными воспалительными изменениями, происходящими в компримированном корешке.
Примерно в трети случаев ЦРП причиной служит грыжа диска, в оставшихся причиной является шейный спондилез [3, 4]. В норме шейный межпозвонковый диск характеризуется большей высотой с вентральной стороны, что способствует формированию шейного лордоза. Фиброзное кольцо вентральной стороны содержит многослойные переплетающиеся коллагеновые волокна различной ориентации, тогда как дорсальная сторона состоит из тонкого слоя коллагена. С возрастом межпозвонковый диск теряет способность удерживать воду, что приводит к снижению его эластичности и выпадению диска кзади, сдавливающего прилегающие нервные структуры.
В инициации поддержания интенсивного болевого синдрома решающую роль могут играть не столько механическая компрессия, сколько воспалительные изменения периневральной ткани, возникающие в результате контакта двух чужеродных тканей. У пациентов с радикулопатией отмечается выработка провоспалительных цитокинов интерлейкина-6 и интерлекина-8, высвобождение фактора некроза опухоли-α, матриксных металлопротеиназ, оксида азота, простагландина Е2 и фосфолипазы А2. Этот провоспалительный химический каскад связан с усилением боли и сенсибилизацией [3]. Кроме того, считается, что воспалительные и биохимические изменения в области нервного корешка повышают восприимчивость к статическим и динамическим механическим воздействиям, могут усиливать болевой синдром.
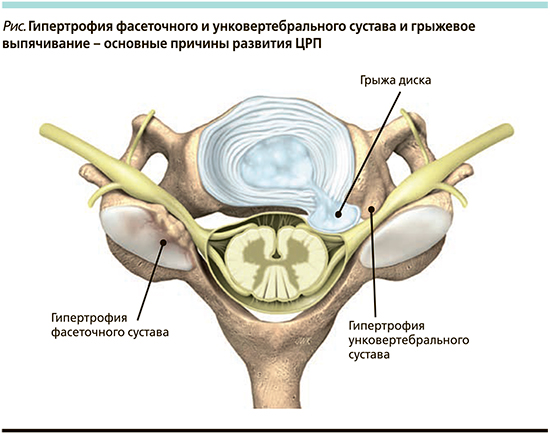
Кроме того, компрессия корешка может быть связана с сужением корешкового канала – гипертрофией структур шейного позвоночно-двигательного сегмента, в частности гипертрофией фасеточных суставов (рисунок). Дегенеративные изменения межпозвонкового диска с возрастом приводят к уменьшению высоты диска и сужению межпозвонковых отверстий, а также к увеличению нагрузки на тело позвонка и межпозвонковые суставы, образованию остеофитов и гипертрофии суставных поверхностей. Гипертрофия «унковертебральных» и фасеточных суставов может вызывать фораминальный стеноз и шейную радикулопатию (см. рисунок).
Болевой синдром при вертеброгенной радикулопатии носит смешанный характер. Ноцицептивный механизм связан с раздражением ноцицепторов в наружных слоях поврежденного диска и окружающих его тканях, в т.ч. в твердой мозговой оболочке, а также в спазмированных мышцах. Невропатический компонент болевого синдрома может быть связан с компрессией, воспалением, отеком, ишемией, демиелинизацией и аксональной дегенерацией. Хронически протекающая радикулопатия обычно сопровождается и психогенным компонентом болевого синдрома, роль которого в хронификациии боли исключительно велика.
Клиническая картина
Боль при ЦРП может развиваться как остро, так и подостро, при этом вначале чаще всего наблюдается односторонняя боль в шее и руке с иррадиацией в дистальные отделы. Кроме того, нередко выявляется нарушение чувствительности в соответствующем дерматоме, а со временем возникает слабость мышц и выпадение сухожильного рефлекса в зоне иннервации соответствующего корешка [5]. Частота встречаемости различных симптомов цервикальной радикулопатии представлена в табл. 1.

Чаще всего отмечается поражение С6- и С7-корешков в результате грыжи С5/С6 и С6/С7 с развитием соответствующей клинической картины. Типичные клинические признаки, облегчающие диагностику уровня поражения, представлены в табл. 2. При спондилезе чаще страдают верхнешейные (С2–С4), преимущественно задние, а не передние корешки (поэтому реже отмечаются моторные нарушения), боль обычно усиливается при разгибании, а не при сгибании.

Со временем симптомы корешковой компрессии дополняются миофасциальными симптомами: диффузной или глубинной болью в мышцах шеи и надплечья. Воспроизведение боли при разгибании и ипсилатеральной ротации головы (прием Шпурлинга) патогномоничен для поражения шейных корешков и может считаться аналогом симптома Ласега, но для шейного уровня. Симптом Лермитта – возникновение при наклоне ощущения прохождения электрического тока в обе руки – указывает на компрессию спинного мозга у больного шейной миелопатией. При высоком поражении спинного мозга возможно онемение ипсилатеральной половины лица. Вовлечение корешка С8 вызывает ощущение онемения и иррадиацию боли, которая доходит по внутренней поверхности предплечья до 4–5-го пальцев, при вовлечении TH1 онемение и боль локализуются по внутренней поверхности предплечья и кисти. Слабость и атрофия мышц, а также выпадение сухожильных рефлексов возможны при поражении как корешка, так и спинного мозга.
Диагностика
Рентгенография при ЦРП не информативна. Компьютерную (КТ) и магнитно-резонансную томографию (МРТ) не рекомендуется проводить в отсутствие «красных флажков». МРТ шейного отдела абсолютно показана лишь при планировании оперативного вмешательства (обычно не ранее 6 недель), наличии признаков сдавления спинного мозга, а также при подозрении на инфекционное, опухолевое или воспалительное поражение позвоночника.
Верифицировать грыжу диска можно в первую очередь с помощью МРТ, а также КТ. Последняя лучше выявляет стеноз межпозвонкового отверстия, остеофиты, оссификацию задней продольной связки.
Интерпретация результатов нейровизуализации несколько затруднена из-за высокой частоты асимптомно протекающих дегенеративно-дистрофических процессов. Так, например, протрузия диска встречается у 29% 20-летних и у 43% 80-летних людей, не предъявляющих жалоб на боли, в то время как дегенерация фасеточного сустава выявлена у 4 и 83% соответственно [6, 7].
В 1988 г. Modic et al. отписали три типа изменений сигнала по данным МРТ от костного мозга и хрящевых замыкательных пластинок тел позвонков в зависимости от степени дегенеративно-дистрофических изменений позвоночника. Для Модик-1 характерно развитие отека и воспаления смежных замыкательных пластин и прилежащих отделов костного мозга, свойственное для острого периода радикулопатии. На МРТ Модик-1 проявляется гипоинтенсивным сигналом на Т1 ВИ и гиперинтенсивным сигналом на Т2 ВИ. Наиболее часто встречающимся изменением сигнала является Модик-2, ассоциированный с хроническим процессом, ишемией костного мозга и жировым замещением нормального красного костного мозга. Проявляется на МРТ гиперинтенсивным сигналом на Т1 ВИ и изоинтенсивым или незначительно гиперинтенсивным сигналом на Т2 ВИ. Модик-3 характеризуется развитием склеротических изменений замыкательных пластинок, проявляющимся гипоинтенсивным сигналом на Т1 и Т2 ВИ. Проявления дегенеративно-дистрофических изменений позвоночника по Модик представлены в табл. 3 [8–10].

В ряде исследований отмечена корреляция между изменениями сигнала на МРТ по Модик и интенсивностью и длительностью болевого синдрома. При этом изменения, характерные для Модик-2, указывают на тенденцию к хронизации цервикалгии, тогда как Модик-1 с большей вероятностью выявляется в остром и подостром периодах [8]. Изменения по Модик выявляются у 18–29,5% пациентов с болями в шейном отделе, чаще всего при наличии межпозвонковой грыжи на уровне С5–С6 [11]. При этом изменения по Модик не характерны для дегенерации фасеточных суставов, наиболее часто выявляемых на уровне С2–С3 [12].
Данные электронейромиографии (ЭНМГ) редко имеют практическую значимость при вертеброгенной радикулопатии, но иногда важны в дифференциальной диагностике с поражением периферического нерва или сплетения.
Дифференциальный диагноз и методы диагностики представлены в табл. 4 [13].

Течение цервикальной радикулопатии
Обычно цервикалгия регрессирует быстро (до 3 месяцев), однако у 14% пациентов цервикалгия имеет тенденцию к хронизации уже после первого болевого эпизода [14, 15].
Важным предиктором хронизации цервикалгии и долгосрочной инвалидизации являются следующие факторы:
- «болевой» тип личности пациента, склонный к катастрофизации боли (у таких пациентов развивается кинезиофобия, они стараются избегать любых движений, способных спровоцировать развитие болевого синдрома);
- сопутствующие тревожные расстройства;
- наличие депрессии;
- нарушения сна;
- одиночество и отсутствие социальной поддержки;
- наличие заботливого «тревожного» партнера;
- неудовлетворенность работой, высокая рабочая нагрузка, несоответствие рабочей нагрузки вознаграждению, рутинная работа;
- материальные интересы, например, льготы по инвалидности.
Принципы лечения
Большинству пациентов с вертеброгенной цервикалгией на фоне консервативной терапии удается достичь существенного ослабления и регресса болевого синдрома.
В остром периоде показана иммобилизация шеи с помощью мягкого или полужесткого воротника (прежде всего в ночное время), срок которой должен быть ограничен несколькими днями.
В последующем проводятся постепенная мобилизация шеи, постизометрическая релаксация, физиотерапевтические процедуры, лечебная гимнастика.
Основой консервативной терапии радикулопатии являются нестероидные противовоспалительные средства (НПВС), которые должны применяться с первых часов развития заболевания, предпочтительнее парентерально. Облигатным компонентом лечения должен быть короткий (7–14 дней) курс миорелаксантов (например, тизанидина или толперазона).
Кортикостероиды – наиболее эффективное средство подавления воспалительной реакции, которая может участвовать в развитии болевого синдрома. Как и при пояснично-крестцовой радикулопатии, предпочтительнее их эпидуральное введение, особенно трансфораминальное, создающее наиболее высокую локальную концентрацию препарата. Чаще всего используют такие препараты, как гидрокортизон, флудрокортизон, допускается и введение преднизолона. Эпидурально предпочтительно вводить кортикостероиды, образующие депо в месте введения, как правило, в 1 шприце с местным анестетиком (например, с 0,5%-ным раствором новокаина). Манипуляция обязательно должна проводиться под флуороскопическим контролем. Системное введение котикостероидов не эффективно.
С учетом смешанного характера болевого синдрома представляется перспективным воздействие не только на ноцицептивный, но и на невропатический компонент боли. Тем не менее до сих пор эффективность средств, традиционно применяемых при невропатической боли, прежде всего антидепрессантов и антиконвульсантов, остается недостаточно доказанной. Условием их эффективности может быть раннее начало их применения.
Одним из потенциальных резервов повышения эффективности консервативной терапии радикулопатии может быть применение витаминов группы В. Антиноцицептивный и противовоспалительный эффекты витаминов группы В подтверждены экспериментально на моделях химически и термически индуцируемой боли [16]. Показано, что витамин В1 самостоятельно или в комбинации с витаминами В6 и В12 способен тормозить прохождение болевой импульсации на уровне задних рогов и таламуса [17]. Экспериментально обнаружено также, что комплекс витаминов группы В усиливает действие норадреналина и серотонина – главных антиноцицептивных нейромедиаторов. Кроме того, за счет повышения синтеза протеинов под действием витаминов группы В могут создаваться условия для более успешной регенерации нервных волокон [18]. Выдвинуто также предположение, согласно которому антиноцицептивный эффект комбинированного витаминного комплекса может быть обусловлен ингибированием синтеза и/или блокированием действия воспалительных медиаторов [19]. На лабораторных моделях боли показано, что витамины группы В способны потенцировать эффекты анальгетиков, что снижает необходимые для адекватного обезболивания дозы и длительность введения НПВС, делает лечение более безопасным [19].
Таким образом, комплекс витаминов группы В в виде внутримышечных инъекций может потенцировать обезболивающий эффект НПВС и способствовать более быстрому регрессу болевого синдрома при вертеброгенной радикулопатии, эффективно воздействуя на невропатический компонент боли. Вместе с тем результаты клинических испытаний витаминов группы В противоречивы: в одних исследованиях наблюдался несомненный положительный эффект, прежде всего в быстром купировании боли и усилении обезболивающего действия НПВС, в других – достоверно подтвердить их обезболивающее действие не удалось. Объяснить эту противоречивость можно гетерогенностью исследований: в одних включались больные с разными степенями болей в спине, другие исследования были слишком кратковременны, что оставляло открытым вопрос, насколько данный препарат влиял на долгосрочный эффект. Проведенное нами исследование активности комплекса витаминов группы В показало, что данный препарат способен ускорять регресс боли именно в долгосрочной перспективе. Данное исследование носило проспективный характер: включались больные, которые имели выраженную или умеренную боль, оценка по ВАШ (визуальная аналоговая шкала) была не менее 4. Больные делились на две группы, одним был назначен диклофенак, другим – сочетание диклофенака с витаминами группы В, в течение 24 дней другие процедуры не проводились. К концу первой фазы исследования отмечено достоверное различие в пользу комбинации витаминов группы В и диклофенака: снижение суммарной оценки по шкале боли в спине на 43%. Особенностью исследования была оценка состояния больных с помощью телефонного интервью с использованием специально разработанного опросника. На фоне комбинированной терапии происходило более быстрое снижение спонтанной боли и увеличение повседневной активности. При этом значительный эффект был отмечен у 25% больных по сравнению с 10% в группе сравнения, удовлетворительный (умеренный) у 41%. При этом на эффективность терапии не влияли исходная интенсивность и длительность боли, наличие симптомов выпадения и выраженность вертебральных симптомов. Как показало телефонное интервью, спустя 3 месяца болевой синдром в группе пациентов, применявших комбинацию витаминов В и НПВС, отсутствовал или был минимальным у 63%, у 50% больных фактически полностью регрессировал. Опрос пациентов через 6 месяцев не выявил различий между группами ни по частоте, ни по средней интенсивности клинических проявлений, ни по безопасности. Таким образом, полученные результаты свидетельствуют: комплекс витаминов группы В может потенцировать обезболивающий эффект НПВС и способствует более быстрому регрессу болевого синдрома. Включение комплекса витаминов группы В в схему терапии может повышать эффективность консервативной терапии ЦРП. Данные результаты исследования опубликованы в 2009 г. В последующем в разных странах проведен ряд исследований, построенных по сходному принципу, доказательность которых была не очень высокой. Тем не менее в недавно опубликованном мета-анализе лечения боли в пояснично-крестцовой области с помощью комбинирования диклофенака и комплекса витаминов группы В показано, что данные препараты в острой стадии имеют явное преимущество перед диклофенаком, длительность лечения снижалась примерно на половину, тогда как при хронической боли в спине разницы эффективности и безопасности монотерапии диклофенаком и комбинированной терапии с витаминами В не обнаружено, что не в последнюю очередь объяснялось отсутствием качественных исследований. Ни в одном из исследований не доказано, что комбинированная терапия приводила к снижению частоты оперативных вмешательств по поводу ЦРП. Тем не менее, оценивая весь массив имеющихся данных, можно указать на перспективность применения комплекса витаминов группы В прежде всего в остром периоде болей в спине и шее, а также для уменьшения невропатического компонента боли у больных с ЦРП.
Хирургическое вмешательство показано при симптомах сдавления спинного мозга (спондилогенная шейная миелопатия) и резко выраженном болевом синдроме (четкие признаки радикулопатии, подтверждение сдавления корешка с помощью МРТ или КТ миелографии и неэффективность в течение 8 недель всего арсенала консервативного лечения). По данным разных исследований, потребность в оперативном лечении возникает в 10–30% случаев ЦРП [16].
Заключение
Ежегодно более трети населения Земли страдают от болей в шее, при этом вертеброгенная патология является не самой частой, но наиболее инвалидизирующей причиной цервикалгиии. Кроме того, вертеброгенная цервикальная радикулопатия часто имеет тенденцию к хронизации процесса. В связи с этим необходимо своевременное и грамотное назначение консервативной терапии, основой которой являются НПВС в сочетании с миорелаксантами и витаминами группы В.



