Введение
Блокаторы рецепторов ангиотензина II – основная группа лекарственных средств для лечения артериальной гипертензии (АГ) [1]. Лозартан – непептидный селективный антагонист АТ1-рецепторов и первый препарат данной группы, используемый вот уже более 25 лет.
Снижение сердечно-сосудистого риска у больных АГ на фоне лечения лозартаном показано в ряде крупномасштабных исследований, таких как ELITE II (2000), LIFE (2002), RENAAL (2007) и др. [2–4].
Эволюция в группе блокаторов рецепторов ангиотензина II и появление новых препаратов, обладающих более выраженным антигипертензивным действием по сравнению с эффективностью лозартана, казалось бы, решает задачу терапии АГ, тем не менее лозартан занимает существенное место в структуре назначений лекарственных средств в амбулаторной практике, в т.ч. нередко в виде монотерапии [5]. Применение лозартана может оказаться неэффективным, что может быть связано с влиянием генов кодирующих ферменты его метаболизма [6]. Являясь пролекарством, лозартан реализует свой фармакологический эффект посредством активного метаболита Е-3174 [7]. Главным ферментом метаболизма лозартана является CYP2С9 [8]. Его генетический полиморфизм характеризуется аллелями со сниженной активностью – CYP2C9*2 (rs1799853) и CYP2C9*3 (rs1057910) [9].
Показано, что носительство аллельных вариантов CYP2C9*2 (rs1799853) и CYP2C9*3 (rs1057910), («медленные» метаболизаторы) ассоциировано с уменьшением концентрации E-3174 за счет снижения активности CYP2C9 [10–12], что может в свою очередь значительно снижать клиническую эффективность лозартана.
В отечественной популяции количество индивидов со сниженной активностью CYP2C9 составляет около 20% [13, 14], что может предопределять низкую эффективность применения лозартана для достаточно значительного числа больных АГ.
Цель исследования: изучить влияние генетического полиморфизма CYP2C9 на режим дозирования лозартана у пациентов с АГ I–II степеней.
Методы
Клиническая часть исследования проводилась на базе терапевтического отделения ООО «Клиника ЛМС», Москва, с 2018 по 2020 г. Фармакогенетическое тестирование по CYP2С9 проводили на базе Научно-исследовательского института молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО Минздрава России.
Исследование одобрено Локальным этическим комитетом ФГБОУ ДПО РМАНПО Минздрава России и проведено в соответствии с Хельсинкской декларацией. От каждого пациента получено добровольное информированное согласие на участие в исследовании.
Согласно критериям включения и исключения из исследования, включен 81 пациент – 46 (56,8%) мужчин и 35 (43,2%) женщин с АГ I–II степеней в возрасте от 24 до 74 лет, средний возраст составил 48,83±11,76 года. Исходно пациенты не получали регулярной антигипертензивной терапии. Исследование проводилось в течение 12 недель.
Критерии включения: АГ I–II степеней, возраст старше 18 лет, подписанное информированное согласие на участие в исследовании.
Критерии исключения: АГ III степени и неконтролируемая АГ, острый инфаркт миокарда, острое нарушение мозгового кровообращения менее чем за 6 месяцев до включения в исследование, нестабильная стенокардия, ХСН III–IV ФК, а также другие хронические заболевания в стадии обострения или декомпенсации. Кроме того, исключение составляли беременность, алкоголизм, наркотическая зависимость, одновременный прием лекарственных средств, являвшихся субстратом цитохрома Р-450 CYP2C9, а также непереносимость лозартана.
Исследование было проведено в два этапа. На первом этапе (до начала терапии) проводилось суточное мониторирование артериального давления (СМАД) с использованием портативных регистраторов Tonoport V («GE Medical Systems Information Technologies GmbH», Germany).
Для определения однонуклеотидных генетических полиморфизмов CYP2C9*2 (rs1799853) и CYP2C9*3 (rs1057910) использовался метод ПЦР в реальном времени, по результатам которого пациенты были разделены на две сравниваемые группы; первая группа (n=55 [67,9%]) – пациенты с генотипом CYP2C9*1/*1, вторая (n=26 [32,1%]) – гомо- и гетерозиготные носители аллельных вариантов CYP2C9*2 и CYP2C9*3. Лозартан назначался в дозе 25–50 мг/сут. На плановых визитах (2-я, 4 и 8-я недели наблюдения) велся мониторинг офисного АД, анализировались данные домашнего мониторинга АД (ДМАД), по результатам чего при необходимости проводилась коррекция терапии либо терапия оставалась прежней в случае снижения АД <140/90 мм рт.ст., что соответствует основным целям лечения. На втором этапе (через 12 недель) оценивалась эффективность лозартана по данным СМАД [15], а также режима дозирования лозартана в группах с различными генотипами по CYP2C9.
Статистическая обработка данных проведена в программном пакете SPSS Statistics 22.0. Носители CYP2C9 *1/*1 были использованы как группа сравнения. Следуя обоснованию Joy et al. [12], полиморфные варианты CYP2C9 (*1/*2, *1/*3, *2/*2 и *2/*3) были объединены в одну группу как «не 1/1». Обработка результатов подразумевала сравнение различных параметров пациентов между двумя генетическими группами в общей выборке (n=81). Для анализа количественных переменных (доза лозартана, данные СМАД) применялся критерий Манна–Уитни. Анализ эффективности антигипертензивной терапии проводился при помощи метода таблиц сопряженности – двустороннего критерия Хиквадрат. Для определения достоверности различий между параметрами использовалась величина p<0,05.
Результаты
Сравнение по параметру дозирования лозартана проведено между двумя группами; первая – пациенты с генотипом CYP2C9*1/*1 (n=55 [67,9%]) и вторая группа – гомо- и гетерозиготные носители по аллельному варианту CYP2C9*2 и CYP2C9*3 (n=26 [32,1%]); генотипы CYP2C9*1/*2 (n=13 [16%]), CYP2C9*1/*3 (n=9 [11,1%]), CYP2C9*2/*2 (n=2 [2,5%]) и CYP2C9 *2/*3 (n=2 [2,5%]). Достоверных различий наблюдаемого распределения от ожидаемого, согласно закону Харди–Вайнберга, не выявлено (р>0,05).
При сопоставлении клинико-демографических данных между пациентами с различными генотипами по CYP2C9 значимого различия не обнаружено (табл. 1).
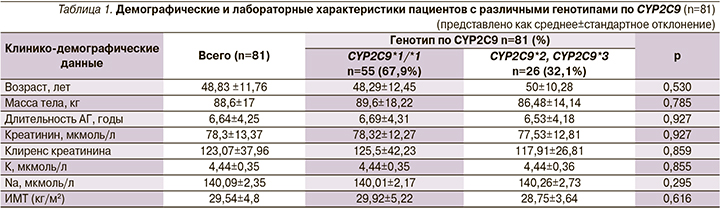
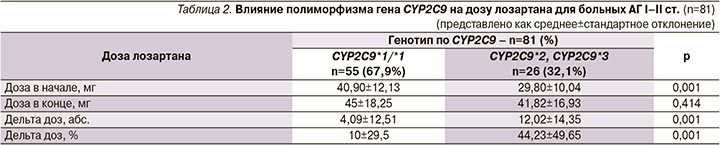
Доза лозартана в начале исследования пациентов с генотипом CYP2C9*1/*1 составила 40,90±12,13 мг, у носителей полиморфных аллелей CYP2С9*2, CYP2C9*3 – 29,80±10,04 мг (р=0,001); в конце исследования доза лозартана для лиц с генотипом CYP2C9*1/*1 составила 45±18,25 мг, для пациентов с полиморфными аллелями – 41,82±16,93 мг (р=0,414).
Дельта доз (абс.) для пациентов с генотипом CYP2C9*1/*1 составила 4,09±12,51, для носителей полиморфных аллелей – 12,02±14,35 (р=0,001). Дельта доз (%) была 10±29,5 против 44,23±49,65 соответственно (р=0,001).
Так, доза лозартана в начале исследования была статистически выше у лиц с генотипом CYP2C9*1/*1 (р=0,001), однако в конце исследования достоверной разницы в дозах между пациентами с различными генотипами обнаружено не было (р=0,414) (табл. 2).
Обнаружив разницу в дозах, было решено выяснить, влияло ли носительство полиморфных аллелей CYP2C9*2 и CYP2C9*3 на вероятность того, что доза лозартана будет увеличена. Показано, что носительство полиморфных аллелей CYP2C9*2 и CYP2C9*3 было ассоциировано с увеличением шанса на повышение дозы лозартана: ОШ=7,00, 95% ДИ: от 2,225 до 22,018; р=0,001 (табл. 3).

Обсуждение
Данные ранее выполненных фармакогенетических исследований показали, что «медленные» метаболизаторы служат носителями аллельных вариантов CYP2C9*2 и CYP2C9*3 [15, 16]. Влияние полиморфизма гена CYP2C9 на метаболизм лозартана показано в ранее проведенных исследованиях [10, 11], в т.ч. на группах пациентов с АГ и хронической болезнью почек [12].
Однако оценка влияния генетического полиморфизма CYP2С9 на режим дозирования лозартана не проводилась. В ранее представленной работе показана низкая эффективность лозартана по данным СМАД у пациентов – носителей полиморфных аллелей CYP2C9*2 и CYP2C9*3 [17].
В настоящем исследовании проведен сравнительный анализ дозы лозартана в начале и в конце лечения больных АГ I–II степеней в зависимости от генетического полиморфизма CYP2C9.
Таким образом, продемонстрировано, что генетический полиморфизм CYP2C9 имеет определенную корреляционную связь с режимом дозирования лозартана, а именно с необходимостью использования более высоких доз для носителей полиморфных аллелей CYP2C9*2 и CYP2C9*3 по сравнению с пациентами с «диким» типом CYP2C9*1/*1.
Заключение
По результатам проведенного исследования больных АГ I–II стереней выявлено, что носительство полиморфных аллелей CYP2C9*2 (rs1799853) и CYP2C9*3 (rs1057910) ассоциировано с повышением дозы лозартана, что может свидетельствовать о недостаточной его эффективности для данной категории пациентов. Однако доза лозартана в начале исследования была достоверно выше в подгруппе пациентов с генотипом CYP2C9*1/*1, в конце же наблюдения значимой разницы по дозе у пациентов с различными генотипами не обнаружено. Возможности и оценка эффективности конкретных терапевтических подходов требуют дальнейшего изучения влияния полиморфизма гена CYP2C9 на режим дозирования лозартана у больных АГ.
Для прогнозирования ответной реакции на применение лозартана больными АГ может быть рекомендовано проведение фармакогенетического тестирования по CYP2C9, позволяющего дифференцированно подходить к выбору как самого лекарственного средства, так и режима его дозирования.



