Этиология и патогенез пиодермий
Пиодермии (pyon – гной+derma – кожа) – гнойничковые болезни кожи – группа острых и хронических, поверхностных и глубоких воспалительных процессов в коже, вызываемых как патогенными (стрепто-, стафилококками), так и условно-патогенными кокками, реже – полимикробной ассоциацией: протеем, энтерококками, синегнойной или кишечной палочками, бактероидами. По международной классификации пиодермии включены в гетерогенную группу инфекций кожи и мягких тканей – ИКМТ (SSTIs – skin and soft-tissue infections). Пациенты с ИКМТ могут наблюдаться у дерматовенерологов, хирургов, терапевтов, педиатров, гинекологов и врачей других специальностей. ИКМТ занимают лидирующие позиции не только в структуре заболеваний дерматологического профиля от 17 до 43%, но, по данным обращаемости на общий амбулаторный прием, – до 38%, среди первичных обращений к хирургу – до 70% [1–3].
Пиодермии могут встречаться в любом возрасте, однако наиболее подвержены данному заболеванию дети, пожилые люди, а также лица с иммунодефицитными состояниями различной этиологии. ИКМТ отличаются разнообразием клинических проявлений, склонностью к рецидивированию, хронизации и торпидному течению. Инфекционный процесс при пиодермиях в ряде случаев не ограничивается лишь местным эффектом – развитием локального воспаления, а может приводить к серьезным последствиям, например к синдрому стафилококкового и стрептококкового токсического шока или к возникновению заболеваний, протекающих без воспалительных явлений (точечный кератолизис) [4].
Клинических классификаций пиодермий на сегодняшний день несколько. В российской дерматологии общепризнанна классификация, предложенная Jadasson (1949) в модификации А.А. Каламкаряна (1954) и С.Т. Павлова (1957), согласно которой пиодермии в зависимости от возбудителя традиционно разделяют по этиологическому принципу – стафилодермии и стрептодермии, а также смешанные – стрептостафилодермии. По клиническому течению заболевания выделяют острые и хронические формы; по глубине поражения – поверхностные и глубокие. По механизму возникновения принято различать первичные пиодермии (с этиологическим фактором – гноеродным возбудителем) и вторичные, возникшие на фоне уже существующего воспаления (атопический дерматит, экзема, чесотка) – вторичное инфицирование (рис. 1).
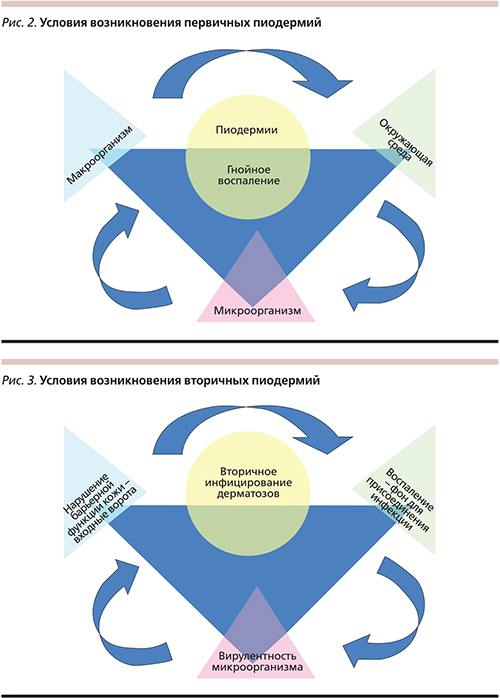
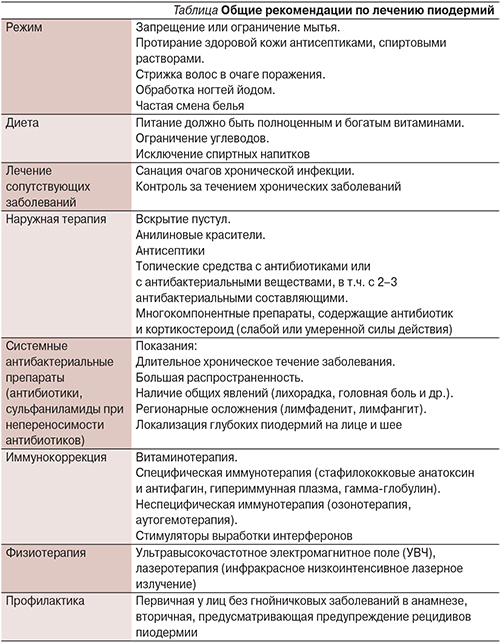
В любом случае для развития пиодермии необходимо сочетание трех факторов: вид патогена и его вирулентность, состояние макроорганизма, а также разнообразные эндогенные и экзогенные предрасполагающие факторы, снижающие барьерную и защитную функции кожи. При этом при первичных пиодермиях воспаление служит следствием (рис. 2), а при вторичном инфицировании – условием (фоном) для ее возникновения (рис. 3).
 В патогенезе развития первичных пиодермий ведущая роль отводится вирулентности микроорганизма. Возбудителями ИКМТ наиболее часто становятся стафилококки (Staphylococcus аureus, Staphylococcus epidermidis) и β-гемолитические стрептококки (Streptococcus pyogenes), реже – грамотрицательные микроорганизмы и зооантропофильные трихофитоны. Высокая вирулентность стафилококков и стрептококков связана с выработкой широкого спектра иммуномодулирующих белков, включая токсины (эксфолиатины, энтеротоксины), экзоэнзимы (коагулаза, лейкоцидин, стрептокиназа, гиалуронидаза стрептолизина, гемолизин и др.), которые облегчают проникновение патогенов в кожу, приводят к повреждению и нарушению метаболизма в тканях эпидермиса и дермы. Необходимо также отметить роль трансформации сапрофитных форм возбудителя (резидентная микрофлора кожи) в патогенные.
В патогенезе развития первичных пиодермий ведущая роль отводится вирулентности микроорганизма. Возбудителями ИКМТ наиболее часто становятся стафилококки (Staphylococcus аureus, Staphylococcus epidermidis) и β-гемолитические стрептококки (Streptococcus pyogenes), реже – грамотрицательные микроорганизмы и зооантропофильные трихофитоны. Высокая вирулентность стафилококков и стрептококков связана с выработкой широкого спектра иммуномодулирующих белков, включая токсины (эксфолиатины, энтеротоксины), экзоэнзимы (коагулаза, лейкоцидин, стрептокиназа, гиалуронидаза стрептолизина, гемолизин и др.), которые облегчают проникновение патогенов в кожу, приводят к повреждению и нарушению метаболизма в тканях эпидермиса и дермы. Необходимо также отметить роль трансформации сапрофитных форм возбудителя (резидентная микрофлора кожи) в патогенные.
В группе патогенных стафилококков особую эпидемиологическую значимость за последние десятилетия приобрел золотистый стафилококк (S. аureus), который помимо пиодермий может вызывать эндоваскулярную инфекцию, пневмонии, септический артрит, эндокардит, остеомиелит, а в педиатрической практике – поверхностные пиодермии и ургентные состояния [5]. Известно, что S. аureus обладает способностью быстро приобретать устойчивость к противомикробным препаратам, что представляет серьезную угрозу общественному здравоохранению во всем мире. Еще в середине 1990-х гг. в США был зарегистрирован всплеск т.н. MRSA-инфекций (Methicillin-resistant Staphylococcus aureus), вызванных резистентными к пенициллину, метициллину и другим β-лактамным антибиотикам штаммами S. аureus. Тогда же были выделены две группы резистентных стафилоккоков, имеющих различное эпидемиологическое значение: внутрибольничные штаммы метициллин-резистентного стафилококка (HA-MRSA – healthcare-associated Methicillin-resistant S. aureus) и внебольничные (СА-MRSA – сommunity-acquired Methicillin-resistant S. aureus), как раз последние и наиболее широко распространены в популяциях (до 90% всех стафилококков), могут вызывать первичные пиодермии у лиц разного возраста даже без фоновых факторов риска. Такая высокая вирулентность СА-MRSA обусловлена выработкой специфического цитотоксина – лейкоцидина Пантона–Валентина (PVL – Panton–Valentine leucocidina) и компонента генной регуляторной системы ACME (аргинин – катаболический подвижный элемент) [6].
Еще одним общепризнанным фактором развития резистентности бактерий, в т.ч. S. аureus, служит эмпирическое, бесконтрольное применение антибиотиков, т.к. в этом случае происходит отбор устойчивых бактерий синантропной микробиоты [5, 6]. Назначение системных антибиотиков приводит к качественному и количественному изменению нормальной микробиоты кожи, способствующему колонизации патогенных возбудителей, обмену внехромосомными генетическими элементами (плазмидами R) и контаминации уже устойчивыми штаммами.
Вторым условием развития ИКМТ является реактивность макроорганизма, состоятельность его адаптивных и регуляторных систем, нарушения в которых могут быть обусловлены перенесенными в преморбидный период соматическими заболеваниями или нарушенными в результате хронического соматического заболевания.
В первую очередь это касается иммунной и эндокринной систем, нарушения в которых, как правило, носят вторичный (приобретенный) характер и формируются на фоне сопутствующих заболеваний (метаболический синдром, сахарный диабет, недостаточная активность гипофизарно-надпочечниковой системы, щитовидной, половых желез), что прежде всего способствует снижению механизмов адаптивного иммунитета. Немаловажное значение в развитии ИКМТ имеют очаги хронических инфекций в различных органах: пародонтоз, кариес, гингивит, тонзиллит, фарингит, инфекции урогенитального тракта, дисбактериоз, кишечные интоксикации, снижающие антибактериальную резистентность организма и способствующие развитию специфической сенсибилизации. Особое эпидемиологическое значение имеет периодическое носительство Staphylococcus epidermidis, Staphylococcus pyogenes vax. аureus, отмеченное среди 60% здорового населения на коже и слизистых оболочках. При этом доказано, что штаммы S. аureus, обитающие на слизистой оболочке носоглотки, более патогенны, чем находящиеся на коже, т.к. у постоянных носителей здесь происходит накопление наиболее вирулентных и резистентных к антибиотикам штаммов с дальнейшей диссеминацией на кожные покровы [7]. Существенную роль в хронизации процесса играют нарушения в центральной и вегетативной нервных системах, стрессы, эмоциональное или физическое перенапряжение, которые приводят к истощению резервных возможностей организма и снижают защитные свойства. В то же время при хронической пиодермии безусловна роль различных врожденных или приобретенных иммунодефицитных состояний (ВИЧ-инфекция, прием глюкокортикостероидов, цитостатиков и иммунодепресантов), затрагивающих различные звенья антибактериальной защиты организма.
Третьим фактором в развитии первичных ИКМТ служит неблагоприятное воздействие окружающей среды, реализующееся через нарушение целостности жиро-рогового слоя и ощелачивания поверхности кожи, что способствует размножению микробов и создает «входные ворота» для проникновения инфекции. К основным неблагоприятным внешним факторам относятся перегревание с повышением потоотделения или длительное охлаждение, способствующее нарушению микроциркуляции и снижению пото- и салоотделению, повышенная влажность, приводящая к мацерации кожи, повышенное загрязнение, в т.ч. профессиональными факторами (маслами, цементом, угольной пылью), вызывающее микротравматизацию кожи.
Диагностика и клиническая картина пиодермий
Диагностика пиодермии базируется на клинических проявлениях ИКМТ, эпидемиологическом анамнезе и объективных методах, в большей степени необходимых при назначении лечения (микроскопия и культуральное исследование – посев на питательные среды). Диагноз первичной пиодермии, как правило, не вызывает затруднений, в большинстве случаев проведения дифференциальной диагностики требуют вторично инфицированные дерматозы, а также глубокие пиодермии, которые приходится дифференцировать с васкулитами, группой акнеформных дерматозов, буллезными дерматозами и другими заболеваниями. Клинические проявления стафилодермий, как правило, связаны с первичной локализацией патологического процесса в сально-волосяном фолликуле и характеризуются появлением поверхностных форм: остиофолликулитом, фолликулитом или стафилококковым (вульгарным) сикозом, или глубокими формами (фурункул, карбункул). Гидраденит, который долгое время относили к глубоким стафилодермиям, теперь рассматривают как проявление акне с характерным поражением апокриновых желез. Для стафилодермий характерно образование пустулы, в центре которой формируется полость, заполненная гнойным экссудатом, по периферии располагается зона эритематозно-отечной воспалительной кожи. При глубоком нагноительном процессе формируется рубец. Поверхностные стрептодермии клинически проявляются импетиго (заеды, околоногтевая фликтена), стрептодермией крупных складок, сухой стрептодермией (простой лишай лица).
К глубоким относится вульгарная эктима. Стрептококковые пиодермии чаще развиваются на гладкой коже, вокруг естественных отверстий (полости рта, носа) и начинаются с образования фликтены – поверхностно расположенного пузыря с дряблой складчатой покрышкой, внутри которого содержится серозно-гнойное содержимое. Тонкие стенки фликтены быстро вскрываются, и содержимое изливается на поверхность кожи, ссыхаясь в медово-желтые слоистые корочки. Процесс склонен к распространению по периферии в результате аутоинукуляции. Клиническими проявлениями смешанных пиодермий являются контагиозное (вульгарное) импетиго и хроническая язвенная пиодермия.
За рубежом ИКМТ подразделяют по клиническому течению и патогенезу развития нагноительного процесса.
Так, выделяют следующие три группы:
- первичные пиодермии, которые вызываются S. aureus и β-гемолитическими стрептококками (преимущественно группы А) и развиваются на неизмененной коже (фолликулит, импетиго, рожистое воспаление);
- вторичные пиодермии, развивающиеся на фоне сопутствующей соматической патологии (например, пролежни, диабетическая язва стопы, инфекции после укусов животных, послеоперационные раневые и посттравматические инфекции), а также на фоне дерматозов, сопровождающихся зудом (аллергический дерматит, экзема, чесотка и т.д.);
- глубокие некротические инфекции, представляющие наиболее тяжелую форму ИКМТ (целлюлит полимикробной этиологии – синергидный целлюлит, некротизирующий фасциит, мионекроз – газовая гангрена).
Терапевтические мероприятия при пиодермиях
От своевременной диагностики и проведения адекватного этиопатогенетического лечения пиодермий во многом зависит эффективность проводимой терапии и прогноз заболевания. К основным принципам терапии относятся использование комплексных методов этиопатогенетической терапии, направленных на элиминацию возбудителя, а также иммунных препаратов, способствующих нормализации функциональной активности иммунной системы больного, индивидуальный подход к выбору препаратов системного и топического действий в зависимости от тяжести клинических проявлений, длительности и особенности течения пиодермии, биологии возбудителя, сопутствующих заболеваний и характера иммунных расстройств. Избирательный подход к терапии больных обеспечивается полноценным учетом анамнеза, клинических и лабораторных данных. Основные клинические рекомендации по лечению пиодермий представлены в таблице.
Основным и единственным методом этиотропного лечения больных ИКМТ остаются антибиотики. При острых поверхностных нераспространенных процессах (импетиго, фолликулиты, паронихии) терапия может быть ограничена местным применением антибиотиков и антисептиков.
Показаниям к назначению системной антибиотикотерапии:
- глубокие формы пиодермий фурункулы (особенно с локализацией на лице и шее), карбункул, гидраденит, рожистое воспаление, целлюлит;
- наличие симптомов общей интоксикации в виде лихорадки, головной боли, слабости, а также развития регионарных осложнений (лимфаденит, лимфангит);
- распространенный процесс;
- длительное хроническое рецидивирующее течение.
Перед назначением антибактериального препарата желательно производить посев гноя с определением чувствительности выделенного микроорганизма к различным антибиотикам и по результатам исследования назначать соответствующий препарат. Однако на практике это не всегда выполнимо. Как показывает анализ современной литературы и собственный клинический опыт, сегодня наиболее часто в лечении бактериальных инфекций кожи используются следующие группы антибиотиков: макролиды; цефалоспорины (1–4-го поколений); тетрациклины; фторхинолоны. Пенициллин и его дюрантные препараты в современной практике применяются достаточно редко, т.к. подавляющее число штаммов пиококков приобрело способность продуцировать фермент β-лактамазу (пенициллиназу), подавляющую антибактериальную активность пенициллина. Тетрациклины, аминогликозиды также используются значительно реже, что связано и с резистентностью микроорганизмов и с наличием противопоказаний. Фторхинолоны при пиодермиях используются только при неэффективности других групп антибиотиков.
На сегодняшний день именно группа макролидов отвечает всем современным требованиям к выбору антибиотика: широкий спектр антимикробного действия и минимально выраженная антибиотикорезистентность к микробным агентам, высокий профиль безо-пасности, отсутствие клинически значимого взаимодействия с другими лекарственными препаратами, минимальный риск развития аллергических реакций, удобство применения для пациента (наличие пероральной формы, удобного режима дозирования) и доступная цена.
Макролиды используются в клинической практике уже более 50 лет, первым природным антибиотиком из этой группы был эритромицин. На сегодняшний день существует три поколения макролидов, которые отличаются по происхождению (природные и полусинтетические) и химической структуре в зависимости от числа атомов углерода в макроциклическом лактонном кольце:
- первое: эритромицин, олеандомицин;
- второе: спирамицин, рокситромицин, джозамицин, кларитромицин и др.;
- третье: азитромицин.
В современной клинической практике преимущественно используются макролиды 2-го и 3-го поколений. Антибактериальный эффект макролидов основан на нарушении синтеза рибосомальных белков микробной клетки, что приводит к ингибированию процесса репликации возбудителя. Макролиды в низких концентрациях оказывают бактериостатическое, в высоких – бактерицидное действия, обусловливающих целесообразность их назначения в острой фазе воспаления [8]. Данная группа относится к «тканевым антибиотикам», т.е. при распределении в организме они накапливаются преимущественно не в кровяном русле, а в тех органах и тканях, где имеется воспаление, тем самым создавая высокие концентрации препарата. Хорошо распределяясь в организме, макролиды способны проникать через гистогематологические барьеры, за исключением гематоэнцефалического, значительно превосходя в этом β-лактамные антибиотики [9].
Одним из современных эффективных антибиотиков является рокситромицин (Эспарокси, Германия), который относится к макролидам второго поколения. Препарат принимается однократно в сутки в дозе 300 мг или по 150 мг 2 раза в сутки, длительность курса подбирается индивидуально с учетом клинической картины. Назначение с интервалом 12 часов обеспечивает поддержание эффективных концентраций в крови в течение 24 часов. При длительном применении 150 мг 2 раза в сутки или 300 мг 1 раз в сутки равновесная концентрация в крови достигается между 2-м и 4-м днями. Липофильность молекулы рокситромицина обеспечивает помимо высокого уровня всасывания в кишечнике еще и отличное проникновение препарата в ткани [8, 9]. Быстрое проникновение его из крови в ткани обеспечивается также низким уровнем связывания с белками крови, что дает возможность достигать быстрого терапевтического эффекта при инфекциях, поражающих клетки и ткани [10]. Высокая концентрация препарата в области поражения позволяет активно воздействовать на патогенный очаг, тем самым обеспечивая быстрый клинический эффект и скорейшее выздоровление [10, 11]. Современные макролиды (в частности, рокситромицин) проявляют эффективность в отношении многих микроорганизмов, что обусловливает их высокую востребованность в дерматовенерологической практике [12].
Немаловажное значение в реализации антибактериальной активности рокситромицина (как и других макролидов 2–3-го поколений) имеет его взаимодействие с нейтрофилами. Благодаря своей способности проникать внутрь нейтрофилов и создавать в них высокие концентрации он положительно влияет на основные функции данных клеток, стимулируя хемотаксис, активность фагоцитоза и киллинга [8]. Таким образом, помимо противомикробного действия он обладает умеренной противовоспалительной активностью. Активируя клетки макрофагального ряда, рокситромицин способен проникать в них и при миграции фагоцитирующих клеток в очаг воспаления поступать туда вместе с ними [10, 12].
Рокситромицин оказывает минимальное влияние на нормальную микрофлору человеческого организма и не вызывает дисбиоза. Поэтому он рассматривается не только как высокоэффективный, но и как достаточно безопасный антибиотик. Побочные эффекты при его приеме в целом встречаются редко. Наиболее частыми побочными эффектами служат симптомы со стороны желудочно-кишечного тракта (тошнота, тяжесть в эпигастральной области), как правило, выраженные умеренно, не требующие отмены препарата и быстро проходящие при приеме лекарства после еды [11].

Под нашим наблюдением находились 38 пациентов с различными клиническими формами пиодермий (рис. 4), среди них 24 женщины и 14 мужчин в возрасте от 14 до 52 лет (медиана – 26,4±4,7 года), которым была показана системная антибиотикотерапия.
Острый процесс отмечен у 21 (55,3%) пациента, с хронической пиодермией были 17 (44,7%) больных. Все пациенты получали комплексное лечение, включившее прием рокситромицина в дозе 150 мг 2 раза в сутки или 300 мг 1 раз в сутки на протяжении 7 дней при всех клинических формах, за исключением рожистого воспаления, когда прием препарата был увеличен до 10 дней. В результате комплексной терапии при острой пиодермии клиническое выздоровление было констатировано у 95% пациентов, у 1 (5%) пациента с множественными фурункулами на 3-и сутки эффект отсутствовал, в связи с чем ему была изменена тактика лечения. У пациентов с хроническими формами пиодермии эффективность составила 88,2%, у 2 (11,8%) пациентов с рожистым воспалением в отдаленный период наблюдений (6 месяцев) вновь отмечен рецидив заболевания. Однако данные по лечению пациентов с рожистым воспалением в этом случае позволяют рассматривать их как положительные; так, рецидивы при данной патологии в большей степени обусловлены фоновыми заболеваниями, степень компенсации которых не всегда может быть под контролем, а возникновение рецидивов в отдаленный период как раз и свидетельствует о необходимости проведения адекватного лечения у смежных специалистов.
Побочные эффекты в виде тошноты и субъективных ощущений отмечены среди 7,9% пациентов, однако данные явлениея носили проходящий характер и не требовали отмены препарата. Аллергических реакций не было отмечено ни в одном из клинических случаев.
Таким образом, рокситромицин обладает широким спектром антимикробного действия, высокой бактериостатической активностью по отношению к чувствительным к нему инфекциям, высокую биодоступность с избирательным действием в очаге воспаления, имеет минимум побочных эффектов и удобный режим приема. Следовательно, препарат отвечает современным требованиям рациональной антибиотикотерапии и может быть рекомендован к эффективному применению в клинической практике для лечения различных клинических форм пиодермий.



