Введение
Во всем мире на рак молочной железы (РМЖ) приходится около 30% случаев рака у женщин, а отношение смертности к заболеваемости составляет 15% [1]. Почти 60–75% вновь диагностированных эпизодов РМЖ являются положительными по рецепторам эстрогена (ЕР), в этих случаях назначается эндокринная терапия, например, тамоксифеном (ТАМ) или ингибиторами ароматазы [2]. Эндокринная терапия в течение 5–10 лет является стандартным методом лечения женщин с ER-положительным РМЖ [3].
Несмотря на проводимую эндокринную терапию, примерно у 30% пациенток с РМЖ наблюдается рецидив заболевания в течение 15 лет после лечения, что указывает на широкую вариабельность клинического ответа на лечение ТАМ. Описано, что как негенетические (возраст, пол), так и генетические факторы влияют на высокую вариабельность ответа на ТАМ.
FDA (Food and Drug Administration) одобрило два препарата для профилактики РМЖ у женщин из группы высокого риска: ТАМ и ралоксифен. Указанные препараты уменьшают риск развития рака на 38% за 10 лет [4].
Несмотря на доказанные преимущества, использование ТАМ часто ограничивается из-за побочных эффектов. Побочные эффекты эндокринотерапии ТАМ снижают качество жизни больных РМЖ и неблагоприятно влияют на соблюдение режима лечения [5].
Оценка медицинской проблемы осложнений эндокринотерапии ТАМ
Наиболее распространенными НЛР при приеме ТАМ являются приливы, гинекологические симптомы (сухость влагалища, выделения из влагалища), депрессия, забывчивость, изменение сна, увеличение массы тела и снижение либидо [6, 7]. Кроме того, что на фоне адьювантной терапии РМЖ тамоксифеном – селективным модулятором ЭР возрастает риск развития гиперплазии эндометрия (ГЭ), поскольку ТАМ действует как антагонист ЭР на ткань молочной железы и как агонист – на эндометрий [8].
Так как отсутствуют точные данные о морфодинамике развития рака эндометрия, изменения, которые предшествуют ему, усложняют его раннюю диагностику и рациональную терапию. По мнению большинства исследователей, фоновым состоянием эндометрия наиболее часто является гиперпластический эндометрий, в котором в условиях длительной гиперэстрогении могут возникать диспластические изменения. Существует мнение, что дисплазия эндометрия развивается в результате длительной гормонотерапии [9, 10].
В настоящее время особенно актуальна проблема гиперпластических процессов и рака эндометрия на фоне длительного приема ТАМ, т.к. заболеваемость эндометрия связана с продолжительностью приема ТАМ [11].
Основными методами диагностики ГЭ являются ультразвуковое исследование (УЗИ) органов малого таза, взятие аспирата из полости матки с последующим цитологическим исследованием, гистероскопия, раздельное диагностическое выскабливание и морфологическая оценка полученного материала. Несмотря на низкую специфичность УЗИ при дифференциальной диагностике патологии эндометрия, развившуюся на фоне приема ТАМ, она остается самым доступным и легковыполнимым исследованием. Следовательно, эхографию по-прежнему следует считать ведущим методом ранней диагностики патологии эндометрия у больных РМЖ [12].
По мнению ряда авторов, наблюдение у акушера-гинеколога и регулярное проведение УЗИ органов малого таза показаны только женщинам, принимающим ТАМ и находящимся в постменопаузе. Согласно консенсусу ESMO-ESGO-ESTRO у женщин в постменопаузе, принимающих ТАМ, дополнительное обследование требуется только при обнаружении толщины эндометрия более 11 мм или при наличии кровянистых выделений из половых путей [13].
Согласно клиническим рекомендациям, одобренным Минздравом РФ, прием ТАМ и возраст старшее 55 лет являются факторами риска развития рака тела матки [14]. Многие авторы выступают за проведение ежегодного скрининга путем проведения трансвагинального УЗИ. По данным литературы, 50% женщин, длительно получавших ТАМ, отмечали какие-либо неблагоприятные явления в отношении эндометрия [15]. ТАМ удваивает риск развития рака эндометрия у женщин в постменопаузе, риск может быть и выше и зависит от продолжительности приема препарата. Однако возможен скрининг пациентов с РМЖ на наличие аномалий эндометрия во время приема ТАМ. Авторы клинических рекомендаций предлагают начинать гинекологическое обследование женщин с РМЖ, находящихся на эндокринотерапии ТАМ, с оценки состояния эндометрия до начала приема препарата с использованием трансвагинального УЗИ. Пациентки, не предъявляющие жалоб на гинекологические симптомы и имеющие нормальную толщину эндометрия, до лечения должны проходить ежегодный скрининг с помощью трансвагинальной сонографии через 2–3 года после начала приема ТАМ. При утолщении эндометрия требуется проведение гистероскопии, т.к. единственным признаком при трансвагинальном УЗИ, позволяющим исключить ГЭ, является тонкое линейное М-эхо [15].
По данным S. Sinawat et al., распространенность аномально утолщенного эндометрия (более 5 мм при трансвагинальном УЗИ) была значительно выше у пациенток, получавших ТАМ (58,57% против 10,71; p=0,0001). Пациентки, проходившие лечение ТАМ, имели относительный риск (ОР) развития аномально утолщенного эндометрия, равный 5,61 (95% доверительный интервал [ДИ]: 2,65–11,86). Авторы утверждают, что существует реальная необходимость гинекологического наблюдения за такими пациентками для раннего выявления неопластических изменений эндометрия, которые могут возникать в результате применения ТАМ [16].
Важное исследование было проведено Soojeong Choi et al. в Южной Корее в период с 2010 по 2015 г. [17]. В исследование были включены 60 545 женщин с РМЖ. У 140 (0,23%) пациенток развился рак эндометрия в течение периода исследования. Среди подгруппы с доброкачественными состояниями эндометрия отношение частоты инвазивных диагностических процедур к заболеваемости раком эндометрия было выше у лиц моложе 40 лет, чем у лиц в возрасте 60 лет и старше. Таким образом, молодые женщины, перенесшие РМЖ, с доброкачественными заболеваниями эндометрия, ассоциированными с приемом ТАМ, имеют более высокий риск развития рака эндометрия по сравнению с женщинами, не принимающими ТАМ.
С целью улучшения раннего выявления рака эндометрия и избежания ненужных инвазивных процедур наблюдение врачом-гинекологом должно быть адаптировано к риску рака эндометрия у молодых женщин, перенесших РМЖ. По мнению ряда авторов, больным РМЖ, получающим терапию ТАМ, кроме регулярного гинекологического наблюдения необходимо проводить тщательный ультразвуковой мониторинг за состоянием эндометрия [18].
В работе, анализирующей важность эндокринной терапии, R.T. Chlebowski et al. подчеркнули необходимость хорошей приверженности лечению (определяемой как >80%) для достижения более низкой частоты рецидивов РМЖ [19]. J.H. Chirgwin et al. сообщили об ухудшении клинического исхода РМЖ среди групп пациенток с более низкой приверженностью лечению (ОР=1,61, 95% ДИ: 1,08–2,38; p=0,02). В большинстве случаев побочные эффекты были основной причиной низкой приверженности терапии ТАМ [20].
Таким образом, большинство исследователей сходятся во мнении о необходимости регулярного наблюдения женщин, принимающих ТАМ, у акушера-гинеколога.
Особенности I фазы метаболизма ТАМ
ТАМ относится к препаратам со сложным метаболизмом. В первой фазе метаболизм ТАМ происходит с участием ферментов цитохрома Р-450 (см. рисунок).
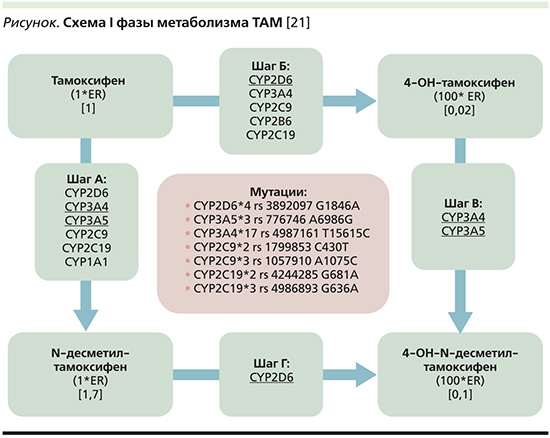
ТАМ метаболизируется в его первичные метаболиты, такие как N-десметил-ТАМ (NDM-ТАМ) и 4-гидрокси-ТАМ. После этого происходит второе превращение его первичных метаболитов в активный метаболит 4-гидрокси-N-десметил-ТАМ (эндоксифен) [22].
Превращение ТАМ в N-дисметил-ТАМ происходит преимущественно благодаря CYP3A4 и CYP3A5, меньший вклад вносят такие ферменты, как CYP1A1, CYP1A2, CYP1B1, CYP2C9, CYP2C19 и CYP2D6 [23]. Затем N-дисметил-ТАМ с помощью CYP2D6 превращается в эндоксифен. Еще один путь метаболизма ТАМ под действием CYP2D6, CYP2C19, CYP2C9, CYP2B6 начинается с превращения в 4-ОН-ТАМ, который затем с помощью CYP3A4/5 превращается в эндоксифен [24]. Таким образом, с помощью CYP2D6 образуются эндоксифен и 4-ОН-ТАМ, два наиболее активных метаболита ТАМ, но активность многих ферментов влияет на метаболизм ТАМ [25].
Фармакогенетический подход к терапии ТАМ
Важным фактором, предрасполагающим к возникновению НЛР, в т.ч. ГЭ, при приеме ТАМ выступает фармакогенетика. Различия в генах, кодирующих ферменты CYP2D6, CYP2C9 и CYP2C19, а именно CYP2D6*4, CYP2C9*2, CYP2C9*3, CYP2C19*2, CYP2C19*3, а также полиморфного маркера гена ABCB1 (С3435Т), кодирующего транспортный белок гликопротеина-Р, могут быть основным фактором предрасположенности к возникновению побочных эффектов при приеме ТАМ, что в свою очередь приводит к снижению приверженности пациенток терапии [26].
Среди генетических факторов наиболее изученным была вариация гена CYP2D6, кодирующего метаболический фермент печени CYP2D6. Хотя он присутствует почти во всех метаболических превращениях ТАМ, однако CYP2D6 является единственным ферментом, который превращает N-дисметил-тамоксифен в эндоксифен. Поэтому CYP2D6 считается критическим ферментом метаболизма ТАМ [27]. «CYP2D6/ТАМ» был признан второй по важности парой «ген/тип препарата», согласно опросу, проведенному членами Американского общества клинической фармакологии и терапии в 2010 г., что указывает на важность генотипа CYP2D6 в опосредовании терапевтических эффектов ТАМ [28].
Во многих исследованиях были проанализированы клинические последствия генотипа CYP2D6 и его взаимо-связь с эффективностью ТАМ, описана важность генотипирования по CYP2D6 из-за худшего клинического исхода среди пациентов с отсутствием или пониженной активностью фермента CYP2D6 [29–31], однако другие авторы не смогли найти такую связь [32, 33].
Следует отметить, что существует множество исследований, демонстрирующих связь между генотипом CYP2D6 и исходом лечения ТАМ, хотя CYP2C9, CYP3A5 и другие ферменты также вносят вклад в метаболизм ТАМ [25, 34]. Наиболее изученной является связь между генотипом CYP2D6 и клиническим ответом на терапию ТАМ. М. Günaldi et al. в своем исследовании отмечают, что у медленных метаболизаторов происходит достоверное увеличение случаев ГЭ, а у быстрых метаболизаторов чаще диагностируется атрофия эндометрия (p=0,019) [35]. Подобные результаты получили A.S. Dieudonné et al.: в их исследовании аллельные варианты CYP2D6, характерные для медленных метаболизаторов, были ассоциированы с увеличением толщины эндометрия (более 5 мм) [36]. Однако другие исследования не подтвердили эту взаимосвязь [37]. Полиморфизмы гена CYP2D6 вносят основной вклад в изменчивость переносимости и эффективности ТАМ, но они по-прежнему объясняют только около 39–42,3% вариабельности концентраций эндоксифена. По этой причине генотипирование CYP2D6 в текущей форме может быть слишком упрощенной стратегией для персонализации лечения ТАМ [38].
Несмотря на то что было проведено много исследований, посвященных данному вопросу, пока нет ясного представления о влиянии различных полиморфизмов гена CYP2D6 на эффективность и переносимость лечения ТАМ. Отсутствует единая точка зрения на значимость определения фенотипа CYP2D6. По мнению ряда авторов, это может иметь смысл при строгом отборе пациенток [39], с другой стороны, по данным опубликованного в 2013 г. мета-анализа [40], – это нецелесообразно. Однако с учетом сложности метаболизма ТАМ можно заключить, что не только CYP2D6 может влиять на исходы лечения, но и другие цитохромы наравне с ним [41].
Наибольшую роль в реакции гидроксилирования ТАМ в 4-гидрокси-ТАМ тамоксифен, а также в реакциях превращения 4-гидрокси-ТАМ в эндоксифен и ТАМ в Н-десметил-ТАМ играет фермент CYP2C19 [27, 42]. В исследовании J. Gjerde et al. показано, что отношение 4-OH-ТАМ/ТАМ находится в прямой зависимости от уровня метаболической активности фермента CYP2C19 (p=0,004) [43]. В 2014 г. был опубликован мета-анализ, посвященный ассоциации полиморфизмов генов CYP2C19 и выживаемости пациенток с РМЖ. Результаты мета-анализа показывают, что генотип CYP2C19 связан с безболезненной выживаемостью пациенток с РМЖ, получающих ТАМ (ОР=0,54, 95% ДИ: 0,34–0,84; p=0,013). У пациенток с аллельными вариантами CYP2C19*2 и CYP2C19*17 зарегистрировано увеличение безболезненной выживаемости [44].
Одним из самых важных ферментов в метаболизме лекарственных препаратов является CYP3A5. Аллели CYP3A5*3 и CYP3A5*6 ассоциированы со сниженной активностью ферментов, что, возможно, может приводить к снижению концентрации активных метаболитов ТАМ и, соответственно, снижению эффективности лечения в отсутствие значимых НЛР [45, 46]. Результаты исследований, касающихся этой темы, оказались противоречивыми. По данным ряда авторов, не обнаружено достоверной связи между носительством аллели CYP3A5*3 и продолжительностью общей и безрецидивной выживаемости, а также с выраженностью приливов и других НЛР [42, 47]. Но многовариантный анализ, проведенный Р. Wegman et al., показал увеличение безрецидивной выживаемости пациенток в постменопаузе, гомозигот по CYP3A5*3, принимающих ТАМ в течении 5 лет [48].
В последних исследованиях по фармакогенетике ТАМ обращается внимание не только на метаболические, но и на транспортные пути ТАМ. Белок-переносчик ABCB1 был идентифицирован как потенциальный маркер для прогнозирования НЛР, вызванных ТАМ [49]. В исследовании K. Kiyotani, T. Mushiroda, C.K. Imamura et al. изучалось совместное взаимодействие генотипов CYP2D6 и ABCB1 при терапии РМЖ и было обнаружено, что у промежуточных метаболизаторов по CYP2D6, которые являются носителями ACB1 C3435T CC, наблюдается повышенный риск рецидива (p=0,002) [50]. В исследовании I. Sensorn, E. Sirachainan, M. Chamnanphon et al. было показано, что пациенты, которые являются гетерозиготными носителями ABCB1 C3435T, имели значительно более короткую безрецидивную выживаемость, чем пациенты с гомозиготным генотипом 3435 CC (p=0,041 и p=0,043 соответственно) [51]. В исследовании S. Argalacsova, O. Slanar et al. показана статистически достоверная связь между полиморфизмом ABCB1 rs1045642 и НЛР при приеме ТАМ, но только для гинекологических и вазомоторных НЛР [52].
Заключение
Несмотря на разнородность исследований, все авторы отмечают зависимость концентрации активных метаболитов ТАМ от генотипа CYP2D6. Однако генотип CYP2D6 является лишь одним из факторов, влияющих на переносимость и эффективность терапии ТАМ. Необходимо дальнейшее исследование других ферментов, таких как CYP3A5, CYP2C19, CYP2C9, белка ABCB1, а также их сочетанного влияния на концентрацию эндоксифена, переносимость препарата и исходы лечения.
Ввиду разноречивых данных исследований NCCN (National Comprehensive Cancer Network) и ASCO (American Society of Clinical Oncology) в настоящий момент не рекомендуют применять определение генотипа CYP2D6 в рутинной клинической практике при назначении ТАМ. Однако уже существуют рекомендации по выбору режима гормональной терапии, основанные на результатах генотипирования CYP2D6. Такие рекомендации были разработаны и опубликованы группой ученых из Голландии DPWG (Dutch Pharmacogenetics Working Group). Из-за повышенного риска рецидива РМЖ при приеме ТАМ авторы рекомендуют пациенткам в постменопаузе, которые относятся к группе медленных или промежуточных метаболизаторов, назначать ингибиторы ароматазы [53].
Огромный вклад в эффективность терапии ТАМ вносит приверженность лечению, т.е. строгое следование рекомендациям врача по выбору препарата и режима его дозирования. Возникновение НЛР является основной причиной самопроизвольной отмены препарата пациентками, что неминуемо ведет к прогрессированию РМЖ. Однако в настоящий момент не разработаны алгоритмы наблюдения, не обозначены в полной мере факторы риска, увеличивающие вероятность НЛР при приеме ТАМ, возникновение которых неминуемо будет вести к снижению приверженности пациенток терапии. Расходятся и мнения экспертов относительно диагностики и тактики ведения пациенток при выявлении гиперпластических процессов эндометрия.
Полное понимание влияния тех или иных ферментов метаболизма и белков транспортеров ТАМ на концентрации активных метаболитов, переносимость препарата и исходы лечения позволит персонализировать лечение пациенток с РМЖ. Необходимо также учитывать и негенетические факторы, которые могут изменять фармакокинетику и фармакодинамику ТАМ, и на их основе рассчитывать прогностические модели развития НЛР на ТАМ.
Ввиду обилия противоречивых данных необходимо проведение дальнейших крупных проспективных исследований и определение групп и факторов риска, а также составление алгоритмов по генотипированию и ведению пациенток с разной активностью ферментов метаболизма ТАМ [41]. Таким образом, комплексный подход к оценке НЛР на ТАМ с учетом данных фармакогенетического тестирования и разработанные на основе этого прогностические модели, включающие как генетические, так и негенетические детерминанты ответа, могут способствовать дальнейшему улучшению предсказания индивидуального ответа на ТАМ [22] и возможности разработки системы поддержки принятия решений врачом-гинекологом пациенток с РМЖ, находящихся на эндокринотерапии.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы: «Персонифицированный подход к амбулаторному ведению акушерами-гинекологами пациенток, принимающих тамоксифен».



