Введение
Хроническая обструктивная болезнь легких (ХОБЛ) представляет собой широко распространенное заболевание, занимающее 4-е место в мире среди причин смертности, которое возможно предупредить и достичь устойчивой ремиссии при применении адекватной терапии и реабилитационных мероприятий [1–2]. В основе патогенеза ХОБЛ лежит ограничение воздушного потока и развитие воспалительного ответа бронхиального дерева [3], способствующее возникновению респираторных симптомов, таких как одышка, хронический кашель, снижение переносимости физических нагрузок, общая слабость.
ХОБЛ коморбидна с остеопорозом [4], кардиоваскулярной патологией [5], раком легких [6], депрессией [7], когнитивными дисфункциями [8,9], гастроэзофагеальной рефлюксной болезнью [10], хронической болезнью почек [11], сахарным диабетом [12] и другой патологией.
Системный воспалительный процесс, связанный с продукцией провоспалительных цитокинов, таких как интерлейкин-2 (ИЛ-2), -4, фактор некроза опухоли-α (ФНО-α), С-реактивный белок (СРБ), способствует снижению минеральной плотности костной ткани [13], приводящей в конечном итоге к развитию остеопении и остеопороза, которым придается особая медико-социальная значимость, т.к. иногда манифестация остеопороза начинается с низкоэнергетического патологического перелома, т.е. с высоты собственного роста. Поэтому одной из самых актуальных коморбидных патологий у больных ХОБЛ считается остеопороз [4].
Однако стоит заметить, что частота развития остеопороза, выражение степени его тяжести находятся в прямой зависимости не только от средовых, но и от ряда генетических факторов [14, 15]. Свой вклад вносит полиморфизм гена рецептора витамина D (VDR, rs1544410) [14], гена рецептора кальцитонина (САLCR, rs1801197) [16, 23], гена лактазы [17] и др. Исследования показали, что для манифестации остеопороза ключевую роль играет полиморфизм различных генов [18], а не одиночный нуклеотидный полиморфизм и его сочетание с модифицируемыми факторами риска [19].
VDR занимает место на коротком плече 12-й хромосомы (12q13.1), имеет множество полиморфных последовательностей и в кодирующих, и в некодирующих участках гена, что способствует изменению его функции за счет активации экспрессии гена [15]. Функция VDR состоит в обеспечении трансляции действия 1,25-дигидрооксивитамина D3 [20]. При замене нуклеотида гуанина на аденин в некодирующей области гена, затрагивающей BsmI-рестрикционный сайт (аллели b/B), проявляются молекулярные эффекты мутации: аллель В приводит к возникновению риска переломов как вертебральной, так и невертебральной локализации, а аллели bb – к первичному гиперпаратиреоидизму. Вышеперечисленные эффекты приводят к нарушению гомеостаза кальция и фосфора в организме [21].
САLCR принадлежит к семейству рецепторов, связанных с G-белком [22]. САLCR (локализация 7q21.3) кодирует изоформу-1 рецептора для гормона кальцитонина. Замена нуклеотида цитозина на тимин, приводящая к замене аминокислоты пролина (CCG) на лейцин (CTG) в белке, снижает чувствительность клеток-мишеней к действию кальцитонина, что приводит кмснижению плотности костной ткани [16, 23].
Цель исследования: определение наличия корреляционных связей между плотностью костной ткани и генетическими, воспалительными и метаболическими маркерами пациентов с ХОБЛ и остеопорозом.
Методы исследования
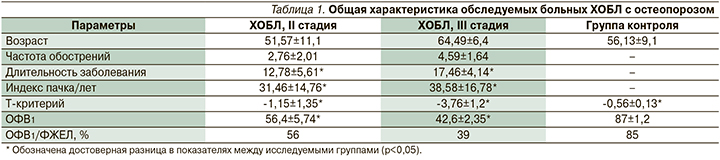
В исследовании приняли участие 80 человек, 46 (57,5%) мужчин и 34 (42,5%) женщины в возрасте от 55 до 70 лет±15 лет, имеющих в анамнезе ХОБЛ (стаж заболевания от 4 лет), коморбидную с остеопорозом. Индекс массы тела – 29,36±5,94 кг/м2, рост – 168,54±4,57 см. Курили 56 (70%) пациентов, индекс пачка/лет составил 30,06±17,84. Исследование проходило на базе БУЗ ВО ВГКБ № 20, БУЗ ВО «ВГКП № 1», БУЗ ВО ВГКБСМП № 10. По спирометрической классификации ХОБЛ, пациенты были разделены на две группы. В первую группу (45 человек) вошли пациенты со среднетяжелой степенью тяжести ХОБЛ (II стадия): ОФВ1 50%≤ОФВ1<80%, ОФВ1/ФЖЕЛ<0,7 (70%); во вторую (35 человек) – пациенты с тяжелой степенью тяжести ХОБЛ (III стадия): ОФВ1 30%≤ОФВ1<50%, ОФВ1/ФЖЕЛ<0,7 (70%). Прирост ОФВ1 после ингаляции β2-агониста короткого действия составил менее 12% (менее 200 мл) по сравнению с исходными данными. Степень тяжести ХОБЛ выставлялась на основании критериев Глобальной стратегии диагностики, лечения и профилактики ХОБЛ (GOLD, 2021) [1]. Пациенты обеих групп указали на постоянную боль в спине и костях. Диагноз остеопороза был подтвержден с помощью клинических, рентгенологических и денситометрических методов обследования, согласно Федеральным клиническим рекомендациям по диагностике, лечению и профилактике остеопороза (2017) [24]. Была проанализирована минеральная плотность костной ткани проксимального отдела бедра и поясничных позвонков L1–L5 по данным рентгеновской денситометрии. Исследование проведено на базе АУЗ ВО «Воронежский областной клинический консультативно-диагностический центр» (ВОККДЦ). Были вычислены значения Т-критерия в процентах и величинах стандартного отклонения (SD) [25]. Согласно критериям ВОЗ, значения минеральной плотности костной ткани, отклоняющиеся по Т-критерию менее чем на -1 SD, расцениваются как норма, значения от -1 SD до -2,5 SD – как остеопения, превышающие -2,5 SD – как остеопороз. Для характеристики тяжести боли применили методику ВАШ (визуальная аналоговая шкала) в см и баллах. Максимальная выраженность «очень сильная боль» оценивалась в 70–100 баллов. Умеренный болевой синдром соответствовал 45–70 баллам. Незначительная выраженность болевого синдрома (слабая боль) или его отсутствие равнялась 0–30 баллов. Для рентгенодиагностики выполнялись две боковые рентгенограммы грудного и поясничного отделов. Также пациентам провели рентгенографическое обследование грудного и поясничного отделов позвоночника в двух проекциях. Общая характеристика больных ХОБЛ с остеопорозом представлена в табл. 1.
Согласие пациентов на участие в исследовании оформлено в виде информированного добровольного согласия на медицинское вмешательство. Всем пациентам произведен забор венозной крови в вакуумные пробирки, содержавшие двукалиевую соль этилендиаминтетраацетата (ЭДТА К2), предпочтительную и рекомендованную Международной комиссией по стандартизации в гематологии. Далее происходил процесс выделения структуры ДНК для определения полиморфизма VDR3 и CALCR. Генетическое исследование проводилось в ООО «Лаборатория МедЛаб», Санкт-Петербург.
Состояние костного метаболизма оценивали по уровню маркера резорбции костной ткани – бета-терминальному С-телопептиду коллагена первого типа (β-СТх). Всем пациентам определили базальную секрецию паратирео-идного гормона (ПТГ). Определение вышеуказанных показателей осуществлено с помощью электрохемилюминесцентного метода тест-системами cobas.
В контрольную группу вошли 20 здоровых человек, сопоставимых по полу и возрасту, без вредных привычек.
Достоверность полученных результатов подтверждали с помощью программы Statistica 13.2. Достоверный результат интерпретировали при p<0,05. Определяли критерий χ2 (по Фишеру). Проводился корреляционный анализ с учетом коэффициента корреляции (R), который считался положительным, если увеличение значения одной переменной в целом соответствует увеличению значения другой переменной, и отрицательным, если увеличение значения одной переменной в целом соответствует уменьшению значения другой переменной. Для независимых величин он равен нулю. Для оценки риска использовался показатель относительного риска (RR).
Исследование состояло из трех этапов.
- 1-й этап – генетическое исследование пациентов на предмет выявления полиморфизма генов.
- 2-й этап – определение уровня воспалительных цитокинов сыворотки крови и маркеров метаболизма костной ткани.
- 3-й этап – выявление корреляционных связей между плотностью костной ткани и генетическими, воспалительными и метаболическими маркерами.
В исследование не включались пациенты с сочетанными заболеваниями бронхолегочной системы (бронхиальная астма, пневмония, туберкулез и др.), принимавшие системные глюко-кортикостероиды, со злокачественными опухолями различной локализации, нестабильными гемодинамическими параметрами, с сатурацией (SpO2) <90%, требовавшей респираторной поддержки [26], а также принимавшие антирезорбтивную терапию.
Результаты исследования
При пальпации трубчатых костей пациентов обеих групп определялась боль в лучевых костях, костях голеней, ключицах, телах позвонков поясничного отдела, что подтвердило наличие клиники остеопороза, однако у больных ХОБЛ III стадии значение ВАШ было достоверно выше (табл. 2).

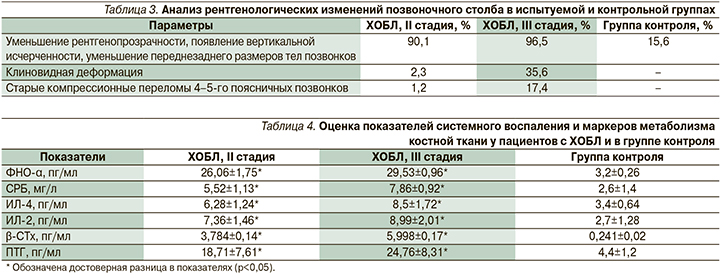
Также пациентам испытуемой и контрольной групп провели рентгенографию грудного и поясничного отделов позвоночника. У 90% пациентов с ХОБЛ и остеопорозом было выявлено уменьшение рентгенопрозрачности, появление вертикальной исчерченности, уменьшение переднезаднего размеров тел позвонков грудного и поясничного отделов, их клиновидная деформация, 10% пациентов подтвердили старые компрессионные переломы 4–5-го поясничных позвонков. Эти данные коррелировали с анамнезом пациентов (появление сильной боли в поясничном отделе). В контрольной группе констатировалась только вертикальная исчерченность тел позвонков и снижение рентгенопрозрачности (табл. 3).
Нами был произведен анализ распределения и выявлены статистически достоверные различия распределения частоты аллелей генотипов и аллелей генов VDR3, CALCR у пациентов, страдаюших ХОБЛ, и контрольной группы. Распределение частоты аллелей генотипов и аллелей генов VDR3 у пациентов с ХОБЛ выглядело следующим образом: генотип ВВ составил 24,2%, Bb – 49,1%, bb – 26,7% (p<0,05). Причем для аллеля B VDR3 – 39,1%, для b же аллеля – 60,9% (p<0,001, χ2=7,2). При исследовании группы контроля выяснилось, что гомозигота по b-аллелю гена рецептора витамина D обнаружена не была, встречаемость генотипов Bb составила 29,7%, ВВ – 70,6% (p<0,05). Из приведенных выше данных можно сделать вывод: у пациентов, страдающих ХОБЛ, достоверно чаще обнаруживаются гомо- и гетерозиготы b-аллеля VDR3, неполноценные в функциональном отношении. Критерий относительного риска (RR) для больных ХОБЛ с остеопорозом носителей Вb и bb-аллелей VDR3 составил 3,6 (р<0,0001). В контрольной группе RR составил 18 (р<0,005).
При анализе распределения частоты аллелей генотипов и аллелей генов CALCR от пациентов с ХОБЛ получены следующие данные: генотип ТТ – 19,4%, ТС – 26,7%, СС – 53,9% (p<0,05). Частота аллеля Т составила 35%, С – 65% (p<0,05, χ2=6,8). В группе контроля распределение произошло следующим образом: ТТ – 57,5%, ТС – 34,1, СС – 8,4% (p<0,05). Поэтому можно сделать вывод: у лиц, страдающих ХОБЛ, наблюдается высокая частота встречаемости патологического генотипа СС. Критерий относительного риска (RR) для больных ХОБЛ с остеопорозом носителей аллеля СС составил 4,3 (p<0,05). Среди лиц группы контроля достоверно чаще встречается генотип ТТ, функционально полноценный (p<0,05).
Анализ показателей биомаркеров системного воспаления у пациентов с ХОБЛ выявил их высокое содержание в сыворотке крови у пациентов с ХОБЛ по сравнению с группой контроля. У пациентов с ХОБЛ II и III стадий заболевания получены достоверные отличия по уровню СРБ, ФНО-α, ИН-2 и ИН-4 по сравнению с группой контроля (р<0,05). При оценке содержания β-СТх и ПТГ у пациентов с ХОБЛ II и III стадий заболевания получены достоверные отличия по их уровню по сравнению с группой контроля (р<0,05) (табл. 4), что свидетельствует о нарушении метаболизма костной ткани.
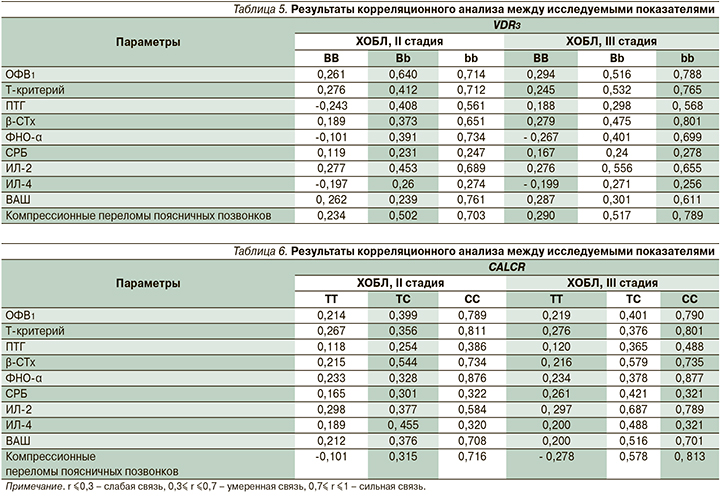
Завершающим этапом нашего исследования было проведение корреляционного анализа между выявленными генетическими маркерами у пациентов ХОБЛ с остеопорозом и исследуемыми показателями (табл. 5, 6).
Обсуждение результатов
С учетом важной роли генетических факторов в развитии остеопороза [14–16] и частого коморбидного его сочетания c ХОБЛ [16, 23] проведено исследование полиморфизма генов VDR3 и CALCR у больных ХОБЛ с остеопорозом и выявлена высокая частота встречаемости патологических аллелей: Bb – 49,1%, bb – 26,7% для VDR3 (χ2=7,2, RR=3,6, p<0,01) и ТС – 26,7%, СС – 53,9% для CALCR (χ2=6,8, RR=4,3, p<0,05), что позволяет говорить об их функциональной значимости в развитии предрасположенности к формированию в будущем остеопенического синдрома, что согласуется с рядом исследований [20, 21].
Уровни маркеров системного воспаления и метаболизма костной ткани были достоверно выше в группе пациентов с ХОБЛ и остеопорозом, причем имелась четкая тенденция к увеличению сывороточных концентраций ФНО-α, СРБ, ИЛ-4, -2, β-СТх и ПТГ при утяжелении стадии ХОБЛ (р<0,05).
У пациентов, имеющих патологические аллели исследуемых генов, выявлена достоверная сильная корреляционная связь с ОФВ1: для ХОБЛ II стадии VDR3 rbb=0,714, для ХОБЛ III стадии VDR3 rbb=0,788, для ХОБЛ II стадии CALCR rCC=0,789, для ХОБЛ III стадии CALCR rCC=0,790; с маркерами резорбции костной ткани (β-СТх): для ХОБЛ III стадии VDR3 rbb=0,801, для ХОБЛ II стадии CALCR rCC=0,734, для ХОБЛ III стадии CALCR rCC=0,735; с ФНО-α: для ХОБЛ II стадии VDR3 rbb=0,734, для ХОБЛ III стадии VDR3 rbb=0,699, для ХОБЛ II стадии CALCR rCC=0,876, для ХОБЛ III стадии CALCR rCC=0,877; с уровнем ИЛ-2: для ХОБЛ II стадии VDR3 rbb=0,689, для ХОБЛ III стадии VDR3 rbb=0,655, для ХОБЛ III стадии CALCR rCC=0,789; с выраженностью болевого синдрома: для ХОБЛ II стадии VDR3 rbb=0,761, для ХОБЛ III стадии VDR3 rbb=0,611, для ХОБЛ II стадии CALCR rCC=0,708, для ХОБЛ III стадии CALCR rCC=0,701; с компрессионными переломами поясничных позвонков: для ХОБЛ II стадии VDR3 rbb=0,703, для ХОБЛ III стадии VDR3 rbb=0,789, для ХОБЛ II стадии CALCR rCC=0,716, для ХОБЛ III стадии CALCR rCC=0,813; с показателями Т-критерия: для ХОБЛ II стадии CALCR rCC=0,811, для ХОБЛ III стадии CALCR rCC=0,801. Полученные нами данные сопоставимы с результатами исследований Wu Yougen, Li Yinghua, Е.А Кочетковой., О.Ю. Григорьевой [17, 27], обнаруживших, что у пациентов с ХОБЛ достоверно чаще встречаются функционально неполноценные аллели генов, имеющие прогностическое значение в отношении развития остеопороза. Также они сопоставимы с данными В.В. Провозюк, Н.П. Масик [28], свидетельствующих, что у пациентов с ХОБЛ с увеличением тяжести и стадии заболевания наблюдется появление в крови маркеров резорбции костной ткани, говорящих о развитии остеопороза.
Заключение
Полученные результаты позволили сделать следующие выводы:
- При проведении исследования по участию полиморфизма генов VDR3 и CALCR в развитии остеопороза у больных ХОБЛ выявлены различия частотного распределения изученных генотипов между группами больных ХОБЛ различной степени тяжести с остеопорозом и здоровых лиц в сторону накопления аллелей с высоким критерием относительного риска остеопороза. Для гена VDR3 это аллель bb, для гена CALCR – это СС.
- Выявлены корреляционные связи между показателями ОФВ1, Т-критерием, показателями системного воспаления (ИЛ-2, ФНО-α), уровнем маркеров распада костной ткани (β-СТх, ПТГ) и полиморфизмами функционально неполноценных генов, что позволяет судить о совместном влиянии данных параметров на показатели плотности костной ткани. Выявленные нарушения костного метаболизма на фоне выраженного системного воспаления находятся в прямой зависимости от стадии заболевания и имеют тенденцию к увеличению с утяжелением стадии ХОБЛ.
- Полученные данные подтверждают важную роль генетических, метаболических, воспалительных факторов в развитии остеопороза при ХОБЛ, что может быть важно для выявления предрасположенности к данному заболеванию на раннем этапе наблюдения за больными.
Вклад авторов. Васильева Л.В. – дизайн, написание и редактирование текста. Беззубцева Е.Н. – поиск литературных источников, написание текста, редактирование. Евстратова Е.Ф. – редактирование текста. Гостева Е.В. – редактирование текста. Зубкова И.Б. – поиск литературных источников, написание текста, редактирование.
Все авторы внесли существенный вклад в подготовку работы, прочли и одобрили финальную версию статьи перед публикацией.



