Сегодня во всем мире большое внимание врачей вызывает остеопороз (osteoporosis; греч. osteon – греч. кость; poros – пора, отверстие; os – разрешение, рарефикация кости) в связи с широкой распространенностью заболевания, отрицательным влиянием на качество и продолжительность жизни людей, а также улучшающимися возможностями диагностики этой патологии [1, 2]. Для остеопороза характерно уменьшение массы и изменение микроархитектоники костной ткани, что приводит к снижению прочности кости, из-за чего со временем многим пациентам приходится испытывать осложнения этого заболевания – остеопоротические переломы. Актуальность проблемы остеопороза в медицине вызвана прежде всего социальными и экономическими последствиями остеопоротических переломов [1, 3, 4].
Первичный остеопороз – это самостоятельное заболевание, которое развивается в любом возрасте, но чаще встречается среди женщин в постменопаузальном периоде. В общей структуре остеопороза на долю вторичных форм приходится от 15 до 20 % и в большинстве случаев это проявление других заболеваний или следствие применения лекарственных средств, отрицательно влияющих на костную ткань. Важно помнить, что при вторичном остеопорозе потенциальный риск переломов сопоставим с таковым при первичной форме. Причины вторичного остеопороза многочисленны [2–5].
Наряду с основными кальцийрегулирующими гормонами: паратиреоидный гормон, кальцитонин, 1,25-дигидрокси витамин D3, кальцитриол, активное влияние на костное ремоделирование оказывают половые стероиды, гормон роста, кортизол, инсулин, тиреоидные гормоны и различные локальные факторы роста. Отсюда неудивительно, что при заболеваниях эндокринной системы значительно увеличен риск остеопороза и связанных с ним переломов костей скелета. К наиболее тяжелым формам вторичного остеопороза относится стероидный, или глюкокортикоид-индуцированный, остеопороз [5–7].
Длительный избыток глюкокортистероидов (ГКС) любой природы (эндо- или экзогенный) способен приводить к развитию остеопороза и его осложнений. Впервые в 1932 г. Х. Кушинг предположил связь между повышением хрупкости костей и гиперактивностью надпочечников [8]. Хотя эндогенный гиперкортицизм (болезнь, или синдром Иценко–Кушинга) – достаточно редкая патология; остеопоротическое поражение костей скелета встречается более чем у половины больных при болезни Иценко–Кушинга и других формах эндогенного гиперкортицизма.
Более частую проблему представляет остеопороз как одно из опасных последствий лечения фармакологическими дозами ГКС (ятрогенный гиперкортицизм). Несмотря на неоспоримую пользу, эти лекарственные средства несут потенциальный риск, особенно при нерациональном их применении. В лечебной практике ГКС используются более полувека и по-прежнему остаются самыми сильными противовоспалительными препаратами [6, 7, 9]. Считается, что регулярно их принимают около 0,5–1,0 % населения планеты [9, 10]. В то же время это самая частая форма вторичного остеопороза, связанного с приемом лекарственных препаратов. О колоссальном значении обсуждаемой проблемы свидетельствует тот факт, что остеопоротические переломы наблюдаются среди 30–50 % пациентов, получающих терапию синтетическими ГКС. Кроме того, при этой форме вторичного остеопороза прочность костной ткани начинает снижаться уже на ранних этапах фармакотерапии [11, 12, 13]. Атравматичные переломы среди больных, принимающих ГКС, встречаются в 2–3 раза чаще, чем в популяции [7, 14]. Принято считать, что потеря костной массы, вызванная синтетическими ГКС, нарастает по мере возрастания суточной и кумулятивной доз, а также длительности применения [7, 9, 11]. Так, при увеличении дозы препарата на каждые 10 мг относительный риск переломов возрастает на 62 % [15]. Однако до сих пор остается неясным, существует ли относительно безопасная доза ГКС. Более того, даже прием минимальных доз преднизолона (2,5 мг) не исключает отрицательного воздействия на костную ткань и способствует снижению минеральной плотности кости (МПК) [16]. Наиболее высокий риск существует для больных, принимающих ГКС в дозе 7,5 мг/сут и более в эквиваленте к преднизолону [17].
Снижение костной массы, вызванное фармакологическими дозами ГКС, имеет бифазный характер. Наиболее существенное снижение МПК наблюдается в течение первых 6–12 месяцев лечения и может составлять 5–27 %/год. В последующие годы терапии потеря костной ткани, как правило, замедляется до 2 % год, но все же постепенно неуклонно прогрессирует, приводя к выраженному снижению МПК и развитию переломов [3, 6, 18].
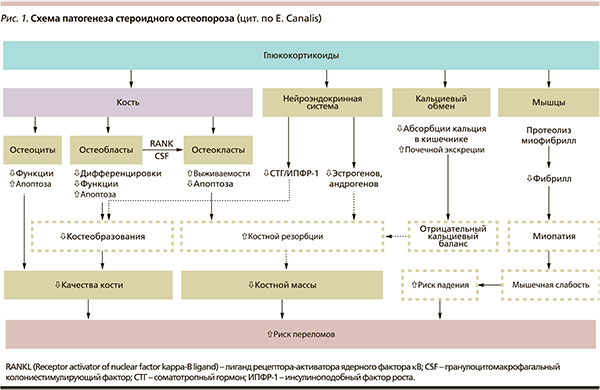
В патогенезе стероидного остеопороза можно выделить несколько основных механизмов, связанных с избытком ГКС различной природы (рис. 1). Давно известно, что глюкокортикоиды обладают негативным влиянием на кальциевый гомеостаз: уменьшают абсорбцию кальция в кишечнике, способствуют снижению тубулярной реабсорбции кальция и возрастанию его потери с мочой. Кстати, снижение кишечной абсорбции кальция выявляется уже на первых неделях терапии глюкокортикоидами и имеет дозозависимый эффект [6, 12, 19]. Закономерно в ответ на снижение внеклеточной концентрации кальция наблюдается быстрое выделение ПТТ и активируется костная резорбция. Активируя остеокласты, повышение уровня ПТГ увеличивает костную резорбцию [19, 20].
Как патогенетический механизм стероидного остеопороза заслуживает внимания нарушение метаболизма витамина D, которое играет ведущую роль в снижении абсорбции кальция в кишечнике. Принято считать, что основной механизм, обеспечивающий всасывание 90 % кальция, представляет собой витамин-D-зависимый активный транспорт кальция через энтероциты. Среди причин, лежащих в основе нарушения метаболизма витамина D на фоне применения ГКС, обсуждается снижение экспрессии VDR-рецепторов для витамина D, а также подавление образования иРНК витамина D. В дополнение к этому ГКС подавляют образование активной формы витамина D в почках [6, 19, 21].
Стероидный остеопороз возникает в результате действия на костную ткань и костные клетки избыточного количества ГКС, что опосредуется через внутриклеточные рецепторы на остеокластах и остеобластах. Известно, что костная ткань представляет собой активную динамическую систему, в которой постоянно происходят процессы резорбции старой кости и образования новой [5]. Избыток ГКС отрицательно влияет на оба процесса, составляющих основу костного ремоделирования: приводит к усилению костной резорбции и к замедлению костеобразования. ГКС обладают многоплановым действием на костную ткань [7, 12]. R.S. Weinstein и соавт. при исследовании костных биоптатов пациентов со стероидным остеопорозом показали, что эти лекарственные средства вызывают гибель остеобластов и остеоцитов [22, 23].

При избытке ГКС замедляется созревание клеток – предшественников остеобластов, угнетается остеобластогенез и подавляется активность остеобластов. В дополнение к этому возрастает ингибирующее действие ПТГ на зрелые остеобласты, что в целом приводит к подавлению костеообразования [20, 24]. Эта точка зрения поддерживается результатами гистоморфометрических исследований, которые показали, что в результате прямого действия ГКС на костеобразование в каждом цикле ремоделирования количество обновленной ткани сокращается на 30 % [25]. Имеются данные о том, что ГКС обладают способностью подавлять синтез костного морфогенного белка и Cbfa1-2 (Core-binding factor a1-2) – основных факторов остеобластогенеза. Под влиянием ГКС подавляется синтез коллагена 1-го типа остеобластами неколлагеновых протеинов и уменьшается образование костного матрикса [7, 26, 27].
Патогенетические механизмы, лежащие в основе стероидного остеопороза, продолжают активно изучаться. Стало известно, что ГКС подавляют продукцию остеопротегерина, который противодействует процессу дифференциации и активизации остеокластов, способствует формированию костной ткани, а также усиливает выработку RANKL белков (receptor activator of nuclear factor kappa-B ligand), что приводит к стимуляции созревания и повышению резорбтивной активности остеокластов [3, 7, 12]. Считается, что соотношение RANKL и остеопротегерина является важной детерминантой костной резорбции [3, 12].
Кроме того, ГКС обладают непрямым действием на костную ткань, что опосредовано локальными факторами. Так, ГКС подавляют образование и секрецию инсулиноподобного фактора-1, который играет важную роль в поддержании костной массы, и увеличивают синтез связывающих его белков, что приводит к снижению костеобразования [21, 28].
Обсуждается такой механизм остеопороза, как ухудшение кровоснабжения кости на фоне применения ГКС или гиперсекреции их надпочечниками. В качестве возможной причины рассматривается снижение уровня простагландина Е2, вызванное избытком этих гормонов. Одной из функций простагландина Е2 является стимуляция синтеза фактора роста эндотелиальных клеток, играющего важную роль в костном кровотоке [21, 29]. Следует отметить, что ГКС вызывают катаболические изменения в мышечной ткани. Уменьшение синтеза мышечного белка приводит к снижению массы мышц и мышечной слабости. При этом миопатия преимущественно поражает проксимальные мышцы нижних конечностей и плечевого пояса, повышает риск падений и переломов [3, 5, 25].
Определенный вклад в подавление костеобразования при гиперкортицизме вносит подавление секреции ЛГ/ФСГ, снижение продукции тестостерона у мужчин и эстрадиола у женщин. Дефицит половых стероидов, обладающих анаболической активностью, создает предпосылки к снижению МПК. Следует также помнить, что применение ГКС подавляет активность системы гипоталамус–гипофиз–надпочечники, а следствием этого является ингибирование продукции надпочечниковых андрогенов – основного источника эстрогенов у женщин в постменопаузе [6, 12].
Итак, становится понятным, что при стероидном остеопорозе увеличение костной резорбции не сопровождается компенсаторным усилением костеобразования. Напротив, в этой ситуации имеет место подавление формирования кости и как результат происходит быстрая потеря костной массы, что обусловливает развитие и прогрессирование остеопороза; частота атравматичных переломов у пациентов, получающих ГКС, составляет 30–50 % [12–15].
 Хорошо известно, что одним из характерных проявлений гиперкортицизма является остеопороз, который проявляется снижением костной массы и патологическими переломами костей [5, 12, 28]. Потери костной ткани различной выраженности присутствуют у таких больных, как правило, в совокупности с другими хорошо известными проявлениями гиперкортицизма. Принято считать, что снижение костной массы при стероидном остеопорозе происходит неравномерно в различных участках скелета. Избыток ГКС оказывает преимущественное воздействие на трабекулярные (губчатые) кости, поэтому у пациентов чаще наблюдаются переломы тел позвонков, ребер и костей таза. В свою очередь компактная кость вовлекается в патологический процесс позднее [5, 6, 25]. Хотя первым проявлением стероидного остеопороза могут быть остеопоротические переломы, часто они протекают бессимптомно. Представляется интересным исследование Angeli и соавт., в котором изучали распространенность позвонковых переломов среди пациентов, получавших ГКС по поводу различных аутоиммунных заболеваний. Так, 37 % таких пациентов имели по крайней мере один асимптоматический компрессионный перелом позвонка, а более чем 14 % – два и более асимптоматических переломов [30].
Хорошо известно, что одним из характерных проявлений гиперкортицизма является остеопороз, который проявляется снижением костной массы и патологическими переломами костей [5, 12, 28]. Потери костной ткани различной выраженности присутствуют у таких больных, как правило, в совокупности с другими хорошо известными проявлениями гиперкортицизма. Принято считать, что снижение костной массы при стероидном остеопорозе происходит неравномерно в различных участках скелета. Избыток ГКС оказывает преимущественное воздействие на трабекулярные (губчатые) кости, поэтому у пациентов чаще наблюдаются переломы тел позвонков, ребер и костей таза. В свою очередь компактная кость вовлекается в патологический процесс позднее [5, 6, 25]. Хотя первым проявлением стероидного остеопороза могут быть остеопоротические переломы, часто они протекают бессимптомно. Представляется интересным исследование Angeli и соавт., в котором изучали распространенность позвонковых переломов среди пациентов, получавших ГКС по поводу различных аутоиммунных заболеваний. Так, 37 % таких пациентов имели по крайней мере один асимптоматический компрессионный перелом позвонка, а более чем 14 % – два и более асимптоматических переломов [30].
Процесс развития стероидного остеопороза при эндогенном гиперкортицизме характеризуется медленным нарастанием потери костной массы и деформации тел позвонков. У многих пациентов, особенно при большой длительности заболевания, уменьшается рост из-за компрессии позвонков на фоне остеопороза. При этом увеличивается грудной кифоз и происходит наклон таза кпереди. Важно, что переломы костей скелета возникают при значениях МПК – более высоких, нежели переломы при постменопаузальном или сенильном остеопорозе [7, 12, 25]. Иначе говоря, «порог переломов» (снижение значения МПК до такого уровня, при достижении которого увеличивается риск переломов костей скелета) у пациентов, получающих ГКС, ниже, чем у тех, кто не получал их. Важно помнить, что длительное лечение ГКС нарушает взаимодействие в гипоталамо-гипофизарно-надпочечниковой системе и приводит к атрофии надпочечников.
В клинической практике следует помнить о негативных последствиях длительного неконтролируемого приема ГКС и связанных с ним побочных явлений, среди которых особое место занимает остеопороз [6, 7, 11]. Вопреки этому при лечении многих заболеваний часто имеет место вынужденный длительный прием этих лекарственных средств. Наиболее приняты два режима назначения ГКС: постоянный, ежедневный, и интермиттирующий приемы. Результаты лечения обоими методами показали, что интермиттирующий режим назначения ГКС не предотвращает потерю костной ткани [3, 25]. Поэтому большое значение в прогнозировании возможности развития глюкокортикоид-индуцированного остеопороза имеет оценка факторов риска. Среди указанных факторов кумулятивная доза ГКС рассматривается как наиболее важная детерминанта, определяющая выраженность потерь костной массы (табл. 1) [7, 12, 28]. Это в свою очередь позволит формировать группу риска больных в отношении развития стероидного остеопороза.
Очевидно, что наиболее эффективный подход к профилактике стероидного остеопороза – это отмена ГКС, что редко возможно для пациентов с хроническими воспалительными и аутоиммунными заболеваниями. Профилактика стероидного остеопороза облегчается при использовании минимальных доз этих препаратов и для пациентов без факторов риска остеопороза [7, 13, 21]. Как уже отмечалось, наиболее быстрая потеря костной массы на фоне лечения ГКС развивается в течение первых 6–12 месяцев от начала лечения [3, 6]. Поэтому профилактику стероидного остеопороза следует начинать как можно раньше. Всем больным, принимающим ГКС, рекомендуется прием кальция и витамина D [13, 25, 28].
Снижение костной массы – частое проявление эндогенного гиперкортицизма. Поэтому первостепенной задачей остается своевременная диагностика заболевания. В лечении стероидного остеопороза важное место отводится этиотропной терапии, поскольку прогноз потерь костной массы зависит от успеха лечения этого заболевания. К тому же при излечении эндогенного гиперкортицизма, прекращении приема ГКС возможно восстановление костной массы, что указывает на обратимость нарушений костной структуры при этой патологии [5, 32, 33]. Большое значение в лечении стероидного остеопороза, как, впрочем, и любой другой формы, имеют рекомендации по образу жизни: пациентам советуют бросить курить, сократить потребление алкоголя, расширить физическую активность с учетом их состояния [1, 4].
В качестве фармакологических средств лечения стероидного остеопороза в клинической практике во всем мире используются бисфосфонаты (БФ) – препараты, созданные на основе неорганических пирофосфатов [5, 34]. Основным фармакологическим эффектом БФ является снижение костного ремоделирования с более выраженным угнетением костной резорбции, чем костеобразования, а также снижение частоты активации ремоделирования, что обосновывает их применение при стероидном остеопорозе. Ключевой механизм действия БФ заключается в прямом ингибировании активности остеокластов, их подвижности, а также блокировании связывания остеокластов с костной тканью [1, 4].
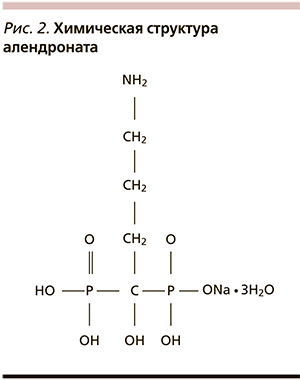
Антирезорбционная активность отдельных препаратов этой группы существенно варьируется, что связано с особенностями химической структуры [1, 12]. Азотсодержащие БФ (алендронат) являются более сильными ингибиторами остеокластической активности и остеолизиса, чем препараты, не содержащие в своей структуре атомов азота. Присутствие атома азота в боковой цепи объясняет особый механизм действия азотсодержащих БФ, связанный со способностью ингибировать процесс модификации белков в остеокластах, что ведет к апоптозу зрелых клеток и подтверждается появлением специфических изменений в клетке и структуре ядра. Действие азотсодержащих БФ, кроме того, ведет к потере клетками – предшественниками остеокластов способности дифференцировки и созревания, что в дальнейшем приводит к уменьшению популяции остеокластов [34, 35]. В дополнение к этому эти лекарственные средства оказывают анаболические эффекты: блокируют апоптоз остеобластов и остеоцитов и стимулируют образование новой кости [36].
В ряду БФ современный и хорошо изученный представитель группы аминобисфосфонатов алендронат наделен всеми необходимыми клинически значимыми свойствами этого класса лекарственных средств (рис. 2). Еженедельный прием 70 мг алендроната хорошо переносится и сейчас является стандартом схемы применения. Препарат следует принимать натощак за 30–60 минут до приема пищи, запивая стаканом воды; необходимо сохранять вертикальное положение тела в течение получаса после приема.
Еженедельное применение алендроната позволяет избегать или сокращать частоту побочных эффектов, традиционно свойственных этому классу. К числу побочных эффектов БФ при пероральном использовании относятся прежде всего нарушения со стороны желудочно-кишечного тракта: тошнота, рвота, диспепсические явления, абдоминальные боли, изъязвления слизистой оболочки пищевода и желудка [5, 34]. Для снижения риска раздражающего действия на слизистую оболочку пищевода не следует разжевывать или рассасывать таблетку, также не следует принимать лежачее положение, по крайней мере на протяжении получаса после приема препарата. Следует учесть, что риск побочных явлений со стороны желудочно-кишечного тракта повышается при одновременном назначении вместе с нестероидными противовоспалительными средствами. При уровне клубочковой фильтрации > 35 мл/мин коррекции дозы не требуется. При нарушении функции почек со скоростью клубочковой фильтра-ции < 35 мл/мин назначение препарата не рекомендуется.
В клинической практике алендронат эффективно используется для лечения практически всех форм остеопороза, включая стероидный остеопороз. Поскольку у больных с гиперкортицизмом часто встречается гипокальциемия, одним из условий эффективного лечения остеопороза алендронатом является обязательная коррекция нарушения до начала терапии БФ. Дополнительно следует рекомендовать препараты кальция и витамин D.
Клиническая эффективность алендроната была подтверждена данными ряда многоцентровых исследований по изучению влияния препарата на МПК и качество кости, риск развития новых переломов и переносимость препарата. При лечении алендронатом значительно увеличивалась МПК в разных отделах скелета, особенно в поясничном отделе позвоночника, одновременно было выявлено достоверное уменьшение числа новых переломов позвонков [37–40].
В заключение следует отметить, что одним из тяжелых проявлений эндогенного гиперкортицизма и серьезных последствий длительного лечения ГКС является снижение костной массы с развитием остеопороза. Своевременно назначенная терапия алендронатом – наиболее мощным ингибитором костной резорбции – способствует замедлению или прекращению потерь костной массы, повышению МПК и позволяет снижать частоту переломов костей.