Дисциркуляторная энцефалопатия (ДЭП) – хроническая прогрессирующая форма цереброваскулярной патологии, характеризующаяся многоочаговым или диффузным поражением головного мозга и проявляющаяся комплексом неврологических и нейропсихологических расстройств [1, 10, 11]. Термин
“дисциркуляторная энцефалопатия” был предложен Г.А. Максудовым и В.М. Коганом более 50 лет назад и до сих пор вызывает дискуссии [9]. Тем не менее концепция ДЭП продолжает выглядеть эвристически привлекательной до настоящего времени, хотя представления об этом состоя-нии эволюционируют по мере развития знаний о цереброваскулярной патологии.
Реальные показатели распространенности и заболеваемости ДЭП остаются неизвестными. Несомненно, что в нашей стране имеет место гипердиагностика ДЭП, которой способствует отсутствие четких общепризнанных критериев ее диагностики. По данным западных авторов, умеренные и выраженные когнитивные нарушения цереброваскулярной природы, которые могут служить эквивалентом ДЭП, выявляются у 16,5 % лиц старше 60 лет [16, 32]. По данным аутопсии, те или иные сосудистые изме-
нения, чаще всего микроваскулярной природы, обнаруживаются примерно у трети пожилых лиц, что может соответствовать реальной распространенности ДЭП в этой возрастной группе [31].
Дисциркуляторная энцефалопатия как цереброваскулярный
синдром
ДЭП можно рассматривать как отдельный цереброваскулярный синдром, отличающийся от другого частого цереброваскулярного синдрома – инсульта – рядом признаков (табл. 1). В отличие от инсульта, являющегося формой острой цереброваскулярной патологии, при котором обычно происходит очаговое поражение мозга, ДЭП характеризуется двумя основными особенностями: более постепенным развитием (часто с длительным периодом клинически “скрытого” течения) и мультифокальностью поражения мозга.
Таблица 1. Сравнительная характеристика инсульта и дисциркуляторной энцефалопатии.
Вместе с тем клинические различия инсульта и ДЭП относительны, т. к. в их основе может лежать одно и то же заболевание мозговых сосудов (с этой точки зрения инсульт и ДЭП можно рассматривать как два цереброваскулярных синдрома, которые могут быть проявлением одного и того же заболевания). Но если в основе большинства случаев инсульта лежит поражение крупных мозговых артерий, прежде всего их атеросклероз, то в основе ДЭП чаще лежит поражение мелких мозговых сосудов (церебральная микроангиопатия) [4, 30, 32]. Тем не менее нередко наблюдается сочетание инсульта и ДЭП. Более того, ДЭП повышает риск инсульта и негативно влияет на его прогноз, ограничивая
возможности компенсации развившегося дефекта и повышая риск геморрагических осложнений при проведении методов лечения инсульта (в частности, тромболиза и антикоагулянтной терапии). Последнее особенно касается пациентов с распространенным лейкоарезом (по данным компьютерной [КТ] или магнитно-резонансной [МРТ] томографии) и множественными микрокровоизлияниями, выявляющимися в эхоградиентном (Т2) режиме МРТ [30].
Этиология дисциркуляторной энцефалопатии
Основным этиологическим фактором церебральной микроангиопатии, лежащей в основе большинства случаев ДЭП, является артериальная гипертензия, вызывающая артериосклероз (липогиалиноз, фибриноидный некроз или микроатероматоз) мелких пенетрирующих артерий и артериол (гипертоническая артериопатия) [1]. У больных, не страдающих артериальной гипертензией, поражение мелких артерий может быть связано с сенильным артериосклерозом, наследственными ангиопатиями (например, CADASIL – cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy), амилоидной ангиопатией (семейной или спорадической), воспалительными ангиопатиями (системными или первичными церебральными васкулитами), лучевой ангиопатией или другими причинами [5, 7, 32]. Дополнительные факторы развития ДЭП включают атеросклероз крупных и средних мозговых сосудов, сахарный диабет, артериальную (в т. ч. ортостатическую) гипотензию, нарушение венозного оттока, повышение вязкости крови, сердечную недостаточность [10, 31].
Патогенез дисциркуляторной энцефалопатии
Важную роль в развитии ДЭП играет нарушение функционирования нейроваскулярных единиц, объединяющих в единую функциональную систему нейроны, астроциты и клетки мелких сосудов. Благодаря сопряжению их активности реализуется феномен функциональной гиперемии: увеличение перфузии активированного участка мозга. Это процесс опосредован рядом вазоактивных ионов (прежде всего калия и кальция), метаболическими факторами (прежде всего оксидом углерода, гипоксией, лактатом, аденозином и особенно оксидом азота), некоторыми нейромедиаторами (глутаматом, дофамином, ацетилхолином).
Нарушение функционирования нейроваскулярных единиц приводит к расстройству механизмов ауторегуляции мозгового кровообращения и нарушению целостности гематоэнцефалического барьера [14]. Одним из важнейших звеньев этого процесса является эндотелиальная дисфункция на уровне мелких сосудов, вызывающая снижение их реактивности и, соответственно, дефицит перфузии активных участков мозга, а также снижающаяся эффективность традиционных вазоактивных средств [8, 23].
Показано, что артериальная гипертензия, которая является одним из основных факторов развития ДЭП, не только изменяет структуру церебральных сосудов, вызывая гипертрофию и ремоделирование сосудистой стенки, способствует развитию атеросклероза крупных сосудов и липогиалиноза мелких сосудов, но и может блокировать феномен функциональной гиперемии. Это сопровождается снижением прироста перфузии в теменной коре и таламусе при выполнении когнитивных тестов, что коррелирует с ухудшением их результатов.
Повышение проницаемости гематоэнцефалического барьера сопровождается экстравазацией компонентов плазмы как непосредственно в артериальную стенку (что способствует ее утолщению и дезинтеграции), так и в прилегающие области мозга с развитием периваскулярного отека (что может
быть одним из механизмов поражения белого вещества), а также процессами асептического воспаления. В белом веществе появляются обширные зоны неполных инфарктов с демиелинизацией, утратой олигодендроцитов и аксонов [1, 7, 20].
Морфологический субстрат дисциркуляторной энцефалопатии
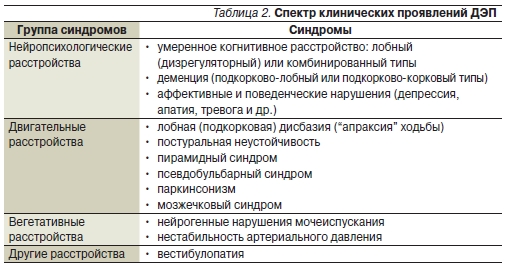
В основе ДЭП могут лежать различные варианты морфологических изменений, преимущественно связанные с патологией мелких мозговых артерий: Ядром клинических проявлений ДЭП являются когнитивные нарушения, которые лучше других проявлений коррелируют с объемом пораженной мозговой ткани и зачастую определяют тяжесть состояния [3, 22]. Тем не менее у части больных основной причиной инвалидизации могут становиться и другие клинические проявления, прежде всего нарушения ходьбы и равновесия.
Стадии дисциркуляторной энцефалопатии
В своем развитии ДЭП проходит три стадии [9], ориентировочные признаки которых приведены в табл. 3.
Таблица 3. Ориентировочные признаки основных стадий ДЭП.
Для первой стадии характерен легкий когнитивный дефицит, преимущественно вовлекающий регуляторные когнитивные функции и внимание и выявляющийся при помощи соответствующих нейропсихологических тестов. На той же стадии возможны легкая или умеренная депрессивная
симптоматика, легкие изменения походки (в виде замедления, укорочения шага, неустойчивости) или
субъективно ощущаемая постуральная неустойчивость. Псевдобульбарные нарушения отсутствуют (за исключением рефлексов орального автоматизма). Пациент сохраняет бытовую независимость.
Вторая стадия характеризуется клинически значимым когнитивным снижением, соответствующим критериям умеренного когнитивного расстройства. У больного могут отмечаться клинически значимая депрессия, умеренно выраженные лобная дизбазия или постуральная неустойчивость, четкие псевдобульбарные проявления в виде дизартрии и эмоциональной расторможенности. Повседневная активность может быть ограничена преимущественно за счет наиболее сложных инструментальных ее видов.
Третья стадия характеризуется наличием деменции, выраженных нарушений ходьбы и равновесия, в значительной степени ограничивающих мобильность пациента и часто приводящих к падениям; выраженных псевдобульбарных нарушений, включающих также хотя бы умеренную дисфагию. Повседневная активность ограничена за счет ее базисных видов. Соответственно, больной становится
зависимым от посторонней помощи.
Критерии диагностики дисциркуляторной энцефалопатии
На рис. 1 представлен алгоритм диагностики ДЭП. Его ключевые элементы – выявление признаков цереброваскулярной патологии и доказательство причинно-следственной связи между ней и неврологическими или нейропсихологическими расстройствами, отмечаемыми у больного.
Рисунок 1. Алгоритм диагностики дисциркулярной (хронической прогрессирующей) сосудистой энцефалопатии.
Рубрики Международной классификации болезней 10-го пересмотра (МКБ-10) для кодирования случаев ДЭП представлены в табл. 4.
Таблица 4. Дисциркуляторная энцефалопатия в МКБ-10.
Лечение дисциркуляторной энцефалопатии
Лечение ДЭП должно проводиться комплексно и прежде всего включать меры по предупреждению дальнейшего повреждения мозговых сосудов и вещества мозга, улучшению и стабилизации когнитивных функций, коррекции других клинических проявлений заболевания (рис. 2).
Рисунок 2. Лечение дисциркулярной энцефалопатии.
Наиболее эффективной мерой по предупреждению дальнейшего прогрессирования заболевания, особенно на его ранней стадии, является воздействие на сосудистые факторы риска, прежде всего адекватная антигипертензивная терапия [19, 21, 25, 29]. При проведении антигипертензивной терапии важно избегать чрезмерного снижения артериального давления, особенно пожилым больным с обширным поражением белого вещества или двусторонними стенозами магистральных артерий головы [1, 3]. Применение ингибиторов ангиотензинпревращающего фермента (АПФ) и антагонистов ангиотензиновых рецепторов повышает реактивность мелких церебральных сосудов и может рассматриваться как наиболее обоснованное [35].
Применение статинов позволяет корригировать гиперлипидемию, замедлять развитие атеросклеротического стеноза крупных мозговых артерий, снижает вязкость крови (что особенно важно при диффузном поражении мелких мозговых артерий), предупреждает прогрессирование ишемической болезни сердца (ИБС). Способность статинов, чаще всего используемых для коррекции гиперлипидемии, улучшать функцию эндотелия и реактивность мелких сосудов, препятствовать воспалительным изменениям, отложению амилоида в веществе мозга, нарушению гематоэнцефалического барьера делает эту группу препаратов исключительно перспективной в лечении ДЭП и требует широкомасштабных исследований их эффективности по данному показанию. В некоторых (но не всех) недавних исследованиях показана способность статинов не только снижать
риск повторного инсульта, но и тормозить прогрессирование диффузного поражения белого вещества [10, 23].
Применение статинов показано прежде всего при высоком исходном уровне липидов (если концентрация липопротеидов низкой плотности [ЛПНП] в крови превышает 3,36 ммоль/л или 130 мг%), однако при наличии атеросклеротических бляшек в экстра- или интракраниальных мозговых сосудах
или ИБС лечение показано, если уровень ЛПНП превышает 2,6 ммоль/л (100 мг%), а для пациентов с высоким риском кардио- и цереброваскулярных поражений (например, при сочетании сахарного диабета или метаболического синдрома с ИБС) – если уровень ЛПНП превышает 70 мг%. Большое
значение имеют также адекватная коррекция сахарного диабета, метаболического синдрома, поддержание физической активности.
Для пациентов, перенесших инсульт или транзиторную ишемическую атаку, а также имеющих выраженный атеросклеротический стеноз магистральных артерий головы или сосудистые очаги при КТ или МРТ, целесообразен длительный прием антиагрегантов (например, ацетилсалициловой кислоты в дозе 50–75 мг/сут). Улучшение кровообращения в системе мелких мозговых сосудов может быть также обеспечено с помощью препаратов, улучшающих функцию эндотелия (ингибиторы АПФ, статины, холиномиметики). При высоком уровне гомоцистеина целесообразно назначение фолиевой кислоты, витаминов В6 и В12, однако до сих пор в контролируемых исследованиях не удалось доказать способность этой меры предупреждать новые цереброваскулярные эпизоды или прогрессирование когнитивного дефицита.
Необходима адекватная коррекция сопутствующей соматической патологии, в частности сердечной и
дыхательной недостаточности, гипотиреоза и т. д., а также аффективных нарушений, прежде всего тревоги и депрессии. Препаратами выбора при лечении сосудистой депрессии являются селективные ингибиторы обратного захвата серотонина (СИОЗС) или селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН). При этом следует учитывать относительную резистентность сосудистой деменции к антидепрессантам и возможность некоторых препаратов СИОЗСН (например, венлафаксина) повышать артериальное давление [34].
Для больных с уже развившейся деменцией в контролируемых исследованиях доказана способность ингибиторов холинэстеразы (галантамин, донепезил, ривастигмин) и парциального агониста глутаматных рецепторов мемантина улучшать состояние когнитивных функций [13, 15, 17]. По-видимому, ингибиторы холинэстеразы и мемантин наиболее эффективны в тех случаях, когда сосудистая патология сопровождается альцгеймеровскими изменениями в мозге. Тем не менее эти препараты могут быть эффективными и для пациентов с “чисто” сосудистой деменцией. На более ранней стадии ДЭП (при легких и умеренных когнитивных нарушениях) обнадеживающие результаты
получены при применении препаратов Гинго билоба и агониста дофаминовых рецепторов пирибедила по отдельности или в комбинации [6, 18].
При лобной дисбазии, особенно с нарушением инициации ходьбы и застываниями, эффективна лечебная гимнастика с коррекцией шага и снижением риска падений, иногда полезны препараты амантадина, леводопы, ингибиторов моноаминоксидазы типа В. При насильственном смехе и плаче
применяют антидепрессанты (трициклические, СИОЗС), препараты леводопы. При вестибулярной дисфункции показана гимнастика, тренирующая вестибулярный аппарат и способность поддерживать равновесие, в сочетании с медикаментозными средствами, например бетагистином, никотиновой
кислотой. При нарушении сна препараты выбора – мелатонин, позволяющий также нормализовать циркадные ритмы, в более выраженных случаях - агонисты бензодиазепиновых рецепторов (например, золпидем), или малые дозы тразодона. Шум в ушах и снижение слуха чаще всего не имеют отношения к ДЭП и связаны с дегенерацией слухового нерва, тем не менее они часто наблюдаются у больных ДЭП. Их коррекция – трудная задача, иногда полезны малые дозы клонозепама, амитриптилина или миртазапина. При гиперактивном мочевом пузыре предпочтительнее использовать препараты троспия хлорида, плохо проникающего через гематоэнцефалический барьер и не блокирующего холинергические системы мозга [10, 11, 23, 28].



