Алкогольная болезнь печени (АБП) – клинико-морфологическое понятие, включающее несколько вариантов повреждений паренхимы печени вследствие злоупотребления алкоголем – от стеатоза до алкогольного гепатита (АГ, стеатогепатита – СГ), приводящего к развитию последовательных стадий: фиброза, цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК). Патологические состояния, ассоциированные с алкоголем, разделяют на две основные категории: расстройства употребления алкоголя и расстройства, вызванные употреблением алкоголя. Расстройства употребления алкоголя включают злоупотребление алкоголем (или чрезмерное употребление алкоголя) и алкогольную зависимость, или алкоголизм. Расстройства, вызванные употреблением алкоголя, – это его неблагоприятные медицинские последствия: алкогольное поражение внутренних органов (включая АБП) и алкогольное поражение нервной системы (в т.ч. алкогольная полиневропатия), а также психические расстройства (например, алкогольные психозы) [1]. У большинства больных АБП наблюдается слабовыраженная зависимость от алкоголя, редко возникает похмельный синдром, что и позволяет им употреблять спиртные напитки на протяжении многих лет. Стертое течение АБП вплоть до формирования цирроза очень характерно именно для таких пациентов. Это приводит к отсутствию возможности оказания своевременной помощи и предотвращения цирроза.
В данной статье наше основное внимание будет уделено неблагоприятным медицинским последствиям, возникающим из-за злоупотребления алкоголем, в частности АБП.
АБП является одной из основных хронических заболеваний печени во всем мире. Алкоголь является частым кофактором у пациентов с другими заболеваниями печени, например, такими, как вирусный гепатит С, печеночная энцефалопатия (ПЭ), СГ, ЦП, ГЦК и др. Алкоголь оказывает влияние более чем на 200 заболеваний. Наибольшее число смертей, связанных с употреблением алкоголя, отмечается от сердечно-сосудистых, желудочно-кишечных заболеваний (главным образом ЦП) и раковых образований. В табл. 1 представлены основные соматические и психические заболевания, связанные с алкоголем [2].

Эпидемиология
По данным Всемирной организации здравоохранения, 3,3 млн смертей (6% от всех смертей в мире) связаны с употреблением алкоголя. Злоупотребление алкоголем – основной фактор риска примерно в 50% случаев ЦП [3]. По данным официальной статистики Российской Федерации, алкоголь входит в число основных факторов смерти в российской популяции, составляя 11,9%. Отмечено, что причиной смерти от заболеваний органов пищеварения в 50–80% случаев послужил ЦП, преимущественно алкогольной и вирусной этиологии [1].
АБП представляет собой широкий спектр расстройств от стеатоза печени до более тяжелых форм повреждения печени, включая АГ, ЦП и ГЦК (рис. 1). Стеатоз – это ранняя реакция на употребление алкоголя, развивается у большинства (более 90%) хронически принимающих алкоголь. Тяжелые формы АБП, такие как фиброз и цирроз, развиваются примерно у 30% сильно пьющих пациентов. В некоторых случаях у пациентов, хронически употребляющих алкогольные напитки, развивается АГ, который также приводит к тяжелым осложнениям, таким как печеночная недостаточность, портальная гипертензия, ПЭ и ГЦК. Тот факт, что АБП развивается не у всех, хронически употребляющих алкоголь, указывает на то, что в развитии заболевания задействованы другие факторы (наследственность, состав микробиоты, коморбидность и др.). Выявлено несколько факторов риска для развития АБП (рис. 1).
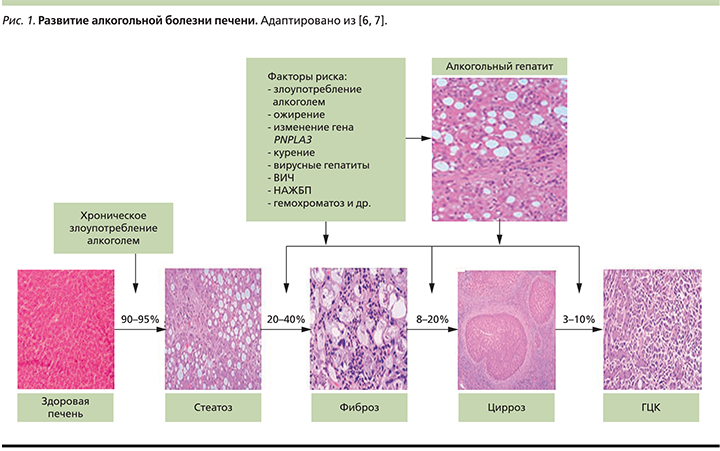
В последнее время уделяется много внимания генетическим факторам риска АБП. Результаты недавних исследований показывают, что вариации пататин-подобного домена, содержащего 3-ю фосфолипазу (PNPLA3 – patatin-like phospholipase domain-containing protein), влияют на развитие алкогольного цирроза у пациентов, хронически принимающих алкоголь [4–6]. Длительное употребление алкоголя пациентами с вирусными гепатитами В или С, вирусом иммунодефицита человека (ВИЧ), гемохроматозом приводит к синергическим эффектам по ускорению прогрессирования заболеваний печени.
Гепатотоксичные дозы алкоголя: для мужчин более 40–80 г/сут в пересчете на чистый этанол, что составляет 100–200 мл водки (крепость 40 об%), 400–800 мл сухого вина (10 об%), 800–1600 мл пива (5 об%); для женщин доза в 2 раза меньше – более 20 г этанола в сутки [1].
Патогенез АБП
Поступление алкоголя в организм человека осуществляется через энтероциты тонкой кишки в портальную венозную систему, где он вызывает повышение эндотоксиальной абсорбции. Алкоголь в крови стимулирует купферовские клетки. Эндотоксины также стимулируют купферовские клетки, вырабатывающие цитокины и свободные радикалы. Вследствие этого усиливается лейкоцитарная инфильтрация и активизируется процесс воспаления печени с возможным формированием гепатита.
Процесс повреждения печени начинается в зоне, расположенной вокруг центральной вены. Эта область отвечает за оксигенацию крови и имеет высокую концентрацию цитохромов CYP 2Е1. Провоспалительные цитокины и воспаление клеток часто находят в крови у пациентов, страдающих АГ. Хотя цитокины и подтверждают алкогольное поражение печени, важным также является и повышение концентрации в крови интерлейкина-8 (ИЛ-8), а также фактора некроза опухоли, которые коррелируют с прогнозом заболевания. Эти медиаторы отвечают за повреждение, активацию и лейкоцитарную адгезию. Купферовские клетки (макрофаги в печени) также включены в процесс повреждения, продуцируя воспалительные и фиброгенетические цитокины, активизирующиеся алкоголем. Хроническая алкогольная интоксикация критически повышает всасываемость алкоголя в тонкой кишке и всасывание эндотоксинов в портальной крови. Это приводит к еще большему гепатоцеллюлярному повреждающему действию цитокинов и свободных радикалов, поступающих из стимулированных алкоголем купферовских клеток.
На рис. 2. представлены механизмы повреждения печени при АГ, лежащие в основе активации врожденного и адаптивного иммунитетов.
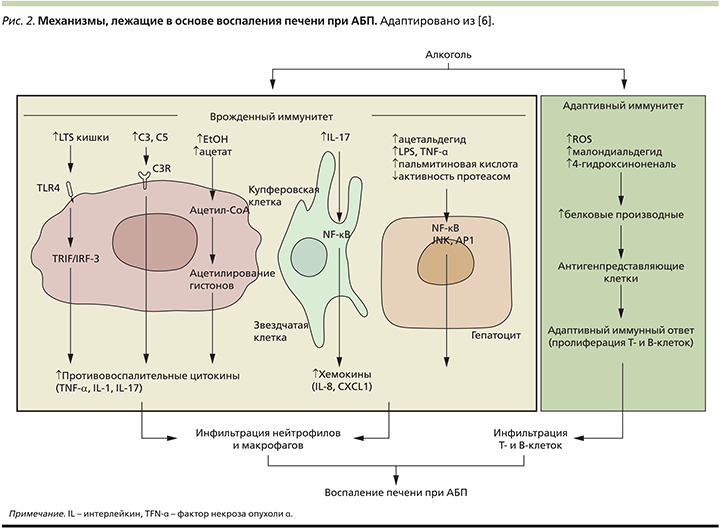
Активация врожденного иммунитета. Паренхимальная инфильтрация нейтрофилов и макрофагов служит характерной чертой АБП, обусловлена опосредованной этанолом активацией врожденного иммунитета и последующей индукцией провоспалительных цитокинов и хемокинов. Употребление алкоголя регулирует множество факторов, которые активируют купферовские клетки, звездчатые клетки и гепатоциты, что приводит к повышенному продуцированию цитокинов и хемокинов. Воздействие алкоголя также снижает активность протеасом и повышает экспрессию ИЛ-8 в гепатоцитах. В частности, злоупотребление алкоголем вызывает нарушение микробиоты кишечника (развитие дисбиоза, бактериального роста, увеличение проницаемости кишечника), что приводит к транслокации липополисахаридов (LPS) бактерий из кишечника в печень. Эти изменения влияют друг на друга и в итоге способствуют увеличению уровней LPS, наблюдаемых в анализах пациентов с АБП.
В совокупности активация компонентов врожденного иммунитета не только инициирует алкогольное повреждение печени, но также вызывает гепатопротекторные, регенеративные и противовоспалительные реакции, которые могут снизить индуцированное гепатоцеллюлярное повреждение [6].
Активация адаптивного иммунитета. AБП ассоциируется с инфильтрацией CD4 и CD8 T-клеток в печени. Длительное употребление алкоголя приводит к росту свободных радикалов (ROS). При этом увеличивается окислительный стресс, приводящий к выработке продуктов перекисного окисления липидов (ПОЛ), таких как малондиальдегид и 4-гидроксиноненаль. Эти соединения могут модифицировать многие белки, вызывая образование производных белка, которые сужат антигенами для активации адаптивного иммунного ответа. Повышение продуктов ПОЛ приводит к накоплению T- и B-клеток в печени. У пациентов с АГ наблюдается увеличенное количество циркулирующих антител по сравнению с аддуктами пероксидации липидов и увеличенным числом T-клеток в печени, что указывает на то, что активация адаптивного иммунитета участвует в патогенезе АБП. Следует отметить, что точные механизмы, с помощью которых адаптивный иммунный ответ индуцирует гепатоцеллюлярное повреждение и воспаление у пациентов с АГ, до конца не изучены [6].
Клиническое течение АБП
Стеатоз (алкогольная жировая дистрофия печени, жировая инфильтрация печени, жировой гепатоз) – начальная стадия АБП, обратимое состояние, при котором гепатоциты накапливают капли триглицеридов. Жировая инфильтрация печени развивается приблизительно у 90% лиц, употребляющих около 60 г этанола в сутки [1].
Алкогольный стеатоз печени обычно имеет бессимптомное течение, но у пациентов могут возникать неспецифичные жалобы, такие как усталость, тошнота или дискомфорт в верхнем правом квадранте живота.
У 70% госпитализированных пациентов со стеатозом выявляется гепатомегалия и треть из них имеют изменения биохимических показателей [8]. Алкогольный стеатоз принято интерпретировать как обратимую, прогностически благоприятную стадию АБП, тем не менее это не может служить поводом для пациента к дальнейшему употреблению алкоголя [9].
АГ (алкогольный СГ) – прогрессирующее воспалительно-дистрофическое поражение печени, которое может развиваться на любой стадии АБП, чаще – на фоне стеатоза, иногда – на фоне уже сформировавшегося ЦП, при длительном систематическом употреблении алкоголя. Частота выявления АГ у госпитализированных пациентов с АБП составляет от 10 до 35%. Среди больных алкогольным ЦП на долю пациентов с АГ приходится около 20% [1].
Алкогольный ЦП — финальная стадия АБП. Риск развития алкогольного ЦП повышается пропорционально увеличению дозы принимаемого алкоголя и длительности его употребления. В случае сохранения функции печени самочувствие больных может оставаться удовлетворительным, ряд пациентов предъявляют жалобы на общую слабость, утомляемость, снижение работоспособности, боль и ощущение тяжести в области правого подреберья. При декомпенсации портальной гипертензии и функции печени появляются соответствующие клинические признаки: желтуха, ПЭ, геморрагический синдром, отечно-асцитический синдром.
Диагностика АБП
Основой для диагностики АБП является установление прямой этиологической роли алкоголя для конкретного пациента, ввиду чего ключевое значение имеет сбор анамнеза. К сожалению, у пациентов данной группы имеется склонность скрывать факт злоупотребления спиртными напитками. В таком случае целесообразно проведение опроса родственников пациента или использование специального анкетирования (например, опросники CAGE, AUDIT, AUDIT-С и др.) [1, 7, 9].
Диагноз АБП обычно подозревается при документированном регулярном потреблении алкоголя в пересчете на чистый этанол >20 г/сут у женщин и >30 г/сут у мужчин при наличии клинических и/или гистологических показателей, указывающих на повреждение печени. Неинвазивная модель для дифференциальной диагностики АБП с НАЖБП основана на четырех параметрах: средний корпускулярный объем (MCV), отношение аспарагиновой аминотрансферазы (AСT) к аланиновой аминотрансферазе (AЛT), индекс массы тела и пол [10].
Неинвазивная диагностика АБП. Биохимические исследования могут быть весьма полезными в диагностике АБП, но при учете только этих показателей невозможно точно определить тяжесть процесса и его этиологию. Уровни АСТ и АЛТ редко превышают 300 ЕД/мл. У больных АБП соотношение АСТ/АЛТ часто превышает 2. Уровни аминотрансфераз, превышающие 300 ЕД/мл у пациента, злоупотребляющего алкоголем, могут быть следствием наличия повреждения ткани печени другой этиологии.
У больных АБП уровни щелочной фосфатазы (ЩФ) часто находятся в пределах нормы или незначительно повышены. Уровни γ-глютаматтранспептидазы (ГГТП) обычно увеличиваются у много пьющих алкоголь независимо от наличия болезни печени. Специфичность ГГТП ограничена, т.к. большинство лекарственных средств вызывают повышение уровня этого фермента. Кроме того, ГГТП повышается при большинстве заболеваний печени.
В табл. 2 представлены типичные лабораторные признаки АБП.

Для АГ характерны лейкоцитоз и тромбоцитопения. Хроническое злоупотребление также часто сопровождается гипертриглицеридемией, гиперурикемией, гипокалиемией, гипомагнемией и увеличением корпускулярного объема эритроцита. Карбогидратный трансферрин может быть специфичным признаком при АБП, но это исследование недостаточно чувствительно, что ограничивает его использование для диагностики АБП.
Для подтверждения факта систематического злоупотребления алкоголем в клинической практике применяют два показателя: углеводно-дефицитный (десиализированный) трансферин (УДТ) и ГГТП. При употреблении алкоголя в количестве более 50 г/сут чувствительность УДТ 69%, специфичность 92%; для ГГТП эти показатели составляют 73 и 75% соответственно [1].
В настоящее время для определения стадии заболевания (выраженности фиброза) при АБП в клинической практике доступны следующие тесты:
- по биохимическим показателям сыворотки крови: индекс APRI (отношение значения АСТ к уровню тромбоцитов), ФиброТест, Фиброметр, Hepascore, AshTest;
- по измерению плотности ткани печени.
Визуализационные методы неинвазивной диагностики не являются основополагающими для установления генеза заболевания, однако играют значимую роль в определении стадии АБП, дифференциальной диагностике и выявлении осложнений данной патологии. Ультразвуковое исследование брюшной полости позволяет верифицировать гепатомегалию, косвенно оценить выраженность стеатоза печени и исключить поражение печени в результате других заболеваний. Метод непрямой эластографии помогает неинвазивно определить степень выраженности фибротических изменений в печени. Компьютерная томография и магнитно-резонансная томография применяются для идентификации ЦП, степени развития коллатерального печеночного кровотока, а также выявления субклинической формы асцита и сопутствующей патологии [9].
Инвазивная диагностика АБП. Биопсия печени – самый чувствительный и точный тест для оценки степени повреждения ткани печени и фиброза. А у пациентов с бессимптомным течением она остается единственным методом, позволяющим точно определить наличие СГ. Однако в клинической практике не всем пациентам с АБП требуется проведение биопсии печени с последующим морфологическим исследованием. Обычно противопоказанием к выполнению этой манипуляции служит высокий риск развития кровотечений из-за часто встречающихся нарушений коагуляции. При выполнении биопсии печени пациентам, у которых выявлено низкое содержание тромбоцитов или увеличение протромбинового времени, необходимо использовать трансъюгулярный, а не привычный чрескожный доступ [1].
Оценка тяжести течения АГ и краткосрочный жизненный прогноз
Разработаны различные прогностические модели, которые позволяют выявить пациентов с высоким риском ранней смерти при заболеваниях печени (табл. 3).
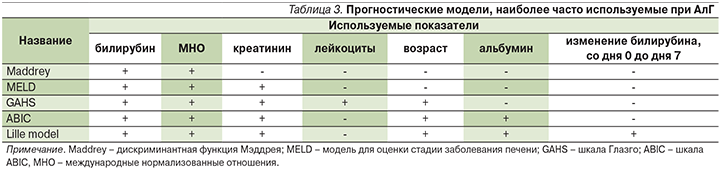
Дискриминантная функция Мэддрея (ДФМ) была первой оценочной шкалой, которая надежно определяла больных АГ с максимальным риском смерти в краткосрочной перспективе и до настоящего времени остается наиболее широко используемой в клинической практике и клинических испытаниях. Она представляется в виде следующей формулы:
ДФМ=4,6×(ПВпациента-ПВконтроля)+СБ,
где: ПВ – протромбиновое время (с); СБ – уровень сывороточного билирубина (мг/дл). Значение ДФМ ≥32 принято в качестве критерия тяжелого АГ [11].
Недавно появилось несколько прогностических шкал, таких как модель для оценки стадии заболевания печени (MELD), оценки жизненного прогноза при АГ (GAHS –Glasgow Аlcoholic Hepatitis Score), ABIC (Age, serum Bilirubin, INR, and serum Creatinine) и Lille model.
Формула для шкалы MELD:
MELD=11,2×ln (МНО)+9,57×ln (креа-тинин, мг/дл)+3,78×ln (билирубин, мг/дл)+6,43,
где: ln — натуральный логарифм.
Неблагоприятный прогноз для жизни ассоциирован со значением индекса MELD>18. Чем выше значение индекса, тем тяжелее протекает заболевание печени [12].
В оценочной шкале GAHS используются пять переменных: возраст, билирубин в сыворотке, мочевина крови, протромбиновое время (МНО) и число лейкоцитов периферической крови (табл. 4).
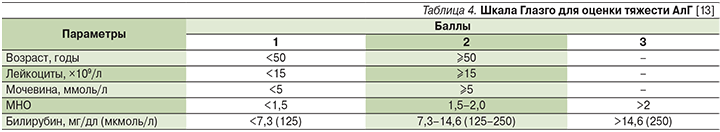
Интерпретация результатов: 8 баллов – неблагоприятный прогноз для жизни, более 9 – выживаемость к 28-му дню составляет 46%, к 84-му – 40% [13].
Шкала ABIC включает такие параметры, как возраст, уровни СБ и креатинина, МНО. Шкала позволяет выделить группы пациентов низкого, среднего и высокого рисков летального исхода через 90 дней (выживаемость – 100%, 70 и 25% соответственно) [14].
Формула для шкалы ABIC:
ABIC=Возраст×0,1+СБ×0,08+СК×0,3+МНО×0,8,
где: СБ — концентрация сывороточного билирубина (мг/дл); СК — концентрация сывороточного креатинина (мг/дл).
Интерпретация результатов: АBIC≤6,71 – низкий риск летального исхода; ABIC 6,71–9,0 –средний риск; ABIC>9,0 – высокий риск.
Шкала Lille используется для оценки эффективности и целесообразности продолжения лечения АГ глюкокортикостероидами (ГКС). Результат определяется по 6 переменным: возраст, креатинин, альбумин, протромбиновое время (МНО), билирубин в день начала приема ГКС, билирубин на 7-й день приема ГКС [15].
Формула для шкалы Lille:
Lille=3,19-0,101×возраст+0,147×А0+0,0165×(СБ1-СБ7)-0,206×ПН-0,0065×СБ0-0,0096×МНО,
где: А0 — альбумин в день 0 (г/л); СБ0, СБ1, СБ7 — сывороточный билирубин в 0, 1-й и 7-й дни соответственно; ПН – коэффициент, связанный с наличием или отсутствием почечной недостаточности: при уровне сывороточного креатинина ниже 115 мкмоль/л (1,3 мг/дл) или клиренсе креатинина менее 40 мл/мин ПН=0 (нет почечной недостаточности); при превышении указанных выше величин диагностируют почечную недостаточность (коэффициент ПН=1).
Интерпретация результатов: R≤0,16 – полный ответ; R=0,16–0,56 – частичный ответ; R≥0,56 – отсутствие ответа.
В настоящее время также предлагается использование эффективного прогностического алгоритма краткосрочной смертности при АГ, который основывается на комбинации моделей MELD и Lille [16].
Лечение АБП
Воздержание от алкоголя является одной из основных терапевтических мер при любой форме и стадии АБ. Продолжение приема алкоголя значительно ухудшает жизненный прогноз пациента: существует риск прогрессирования заболевания печени, развития выраженного фиброза и цирроза, осложнений портальной гипертензии, гепатоцеллюлярной карциномы и др.
Питание. У подавляющего большинства лиц, злоупотребляющих алкоголем, выявляют алиментарные нарушения. Наиболее часто наблюдаются выраженная белковая недостаточность, дефицит тиамина, фолиевой кислоты, пиридоксина, цинка, витаминов А и D.
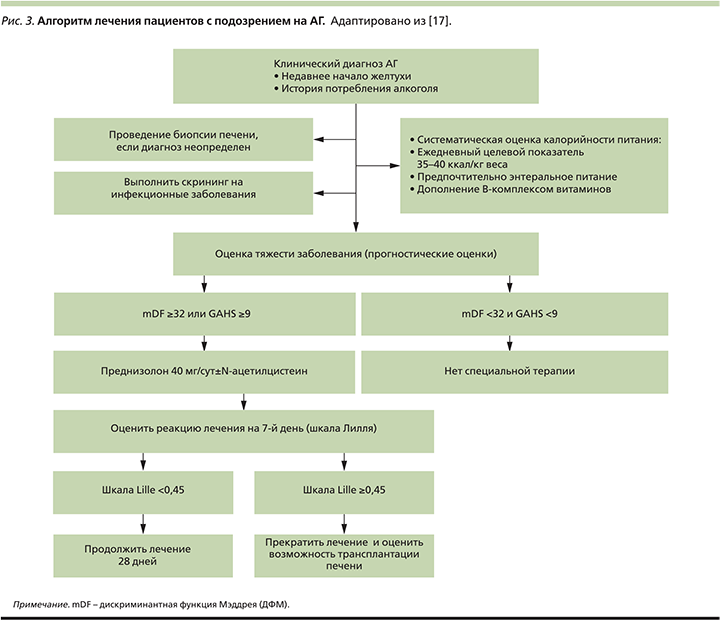
Недостаточное питание при АГ обычно приводит к циррозу. В нескольких исследованиях подчеркивается, что недоедание и белковая недостаточность присутствуют почти у каждого пациента с тяжелой формой АГ и связано с плохим прогнозом [17]. Поэтому необходимо провести тщательную оценку состояния питания и пациенты должны стремиться к ежедневному потреблению энергии ≥35–40 ккал /кг веса и 1,2–1,5 г/кг белка (рис. 3).
Медикаментозная терапия. Кон-цепции фармакотерапии АБП основаны на воздействии на патогенетические компоненты данной патологии. Наиболее часто применяют иммуносупрессивные, антицитокиновые и антиоксидантные препараты.
Терапия первой линии для пациентов с АГ тяжелого течения (индекс Мэддрея ≥32, MELD≥18, GASH≥8) – преднизолон, который назначают для приема внутрь в дозе 40 мг/сут на период 28 дней. Оценку эффективности терапии проводят на 7-й день от ее начала с помощью шкалы Lille (рис. 3). Если по шкале Lille результат <0,45, то лечение преднизолоном в указанной дозе продолжают в течение 28 дней с последующей полной отменой препарата в течение 28 дней. При результате по шкале Lille≥0,45 лечение преднизолоном прекращают ввиду его неэффективности. Доказательная база применения ГКС основывается на результатах рандомизированных плацебо-контролируемых исследований, проведенных за последние 40 лет. Во многих из этих исследований констатировано снижение летальности при лечении ГКС. Противопоказанием к применению ГКС служат желудочно-кишечное кровотечение, активная инфекция, почечная недостаточность и сахарный диабет 2 типа [9].
Пентоксифиллин – препарат терапии второй линии для лечения АГ тяжелого течения. Его назначают в дозе 400 мг 3 раза в сутки внутрь пациентам, у которых установлены противопоказания к терапии преднизолоном [1].
N-ацетилцистеин в комбинации с ГКС способен улучшать краткосрочную выживаемость (28 дней болезни) пациентов с АГ тяжелого течения по сравнению с монотерапией ГКС.
Пациенты с АГ средней тяжести (индекс Мэддрея<32) не нуждаются в лечении ГКС. Им необходимо воздержание от приема алкоголя и полноценное питание. Из лекарственных препаратов могут применяться адеметионин (S-аденозилметионин, SAMe), эссенциальные фосфолипиды, комбинированные препараты, урсодезоксихолевая кислота, L-орнитин L-аспартат.
В тех случаях, когда АБП сопровождается развитием выраженной ПЭ, лечение включает устранение разрешающих (триггерных) факторов, проведение мероприятий, направленных на снижение образования аммиака в кишечнике (диета со сниженным содержанием белка, назначение антибиотиков, слабительных) и стимуляцию процессов обезвреживания аммиака [18]. Поскольку при ЦП наибольший вклад в развитие гипераммониемии вносит нарушение механизмов детоксикации аммиака в организме, применение препаратов, стимулирующих процессы детоксикации, представляется наиболее действенным. Назначение L-орнитина-L-аспартата (Гепа-Мерц), который стимулирует детоксикацию аммиака как в печени, так и в мышечной ткани, занимает важнейшее место в лечебных мероприятиях при ПЭ.
Препарат включает два важнейших действующих вещества: орнитин (субстрат цикла мочевой кислоты, функциональная способность которого при циррозе печени значительно ограничена) и аспартат (превращается в глутамат в реакциях трансаминирования). Образующийся глутамат, связывая аммиак, преобразуется в глутамин [19]. Таким образом, аммиак обезвреживается в орнитиновом цикле в перипортальных гепатоцитах и в реакции синтеза глутамина из глутамата, которая протекает в перивенозных гепатоцитах и мышечной ткани. Применение L-орнитина L-аспартата в комплексном лечении пациентов с алкогольным заболеванием печени эффективно устраняет боль и астеновегетативные синдромы, вызванные алкогольной энцефалопатией. При его применении в терапии ПЭ, вызванной алкоголем, отмечается нормализация биохимических тестов печени (АЛТ, АСТ, билирубина, щелочной фосфатазы и результатов тимолового теста), которые отражают синдромы цитолиза и холестаза [20–25].
Стандартная схема применения L-орнитина L-аспартата при ПЭ предусматривает внутривенное капельное введение 20–30 г препарата в течение 7–14 дней с последующим переходом на пероральный прием 9–18 г/сут. Для достижения более быстрого и стойкого результата возможна комбинация внутривенного и перорального способов применения. При длительном применении препарат эффективно предотвращает рецидивы ПЭ, что способствует повышению качества жизни больных [26].
Следует отметить, что назначение L-орнитина L-аспартата может быть рекомендовано врачами для лечения начальных стадий заболевания АБП – стеатозов и СГ. Режим дозирования: по 1 пакетику гранул препарата 3 раза в сутки после еды. Продолжительность курса лечения определяется врачом индивидуально в зависимости от тяжести заболевания.
Заключение
Злоупотребление алкоголем является одной из основных причин поражения печени. Однако, несмотря на значительные успехи в понимании патогенеза заболевания, диагностика и лечение АБП по-прежнему представляют собой сложный мультифакторный процесс. Подробное изучение анамнеза пациента и использование эффективных диагностических методов служит залогом успеха в постановке диагноза. Строгий отказ или значительное уменьшение количества принимаемого алкоголя является основой лечения и улучшает прогноз на любой стадии АБП. Персонализированный подбор схемы лечения пациентов с АБП, основанной на использовании современных лекарственных препаратов, улучшающих функции печени, позволяет уменьшить клинические проявления заболевания и нормализовать биохимические показатели функции печени, а в конечном итоге добиться снижения тяжести заболевания и летальности при АБП.



