Ацетилсалициловая кислота (АСК) на протяжении многих десятилетий сохраняет лидирующие позиции в отношении профилактики сердечно-сосудистых осложнений, развивающихся вследствие артериального тромбоза [1]. Число пациентов, которые с профилактической целью в течение длительного времени принимают препараты, содержащие АСК, огромно. Высокая эффективность АСК для улучшения прогноза больных с различными проявлениями атеросклероза, к сожалению, имеет оборотную сторону: такое лечение сопряжено с повышением риска геморрагических осложнений и негативным влиянием на слизистую верхних отделов желудочно-кишечного тракта.
С учетом большой значимости этой проблемы, затрагивающей интересы десятков миллионов людей во всем мире и имеющей большое экономическое значение, стратегия и тактика применения АСК непрерывно корректируются на основе доказательств, получаемых из крупных рандомизированных исследований.
Наиболее острая дискуссия в последние годы развивается вокруг возможностей применения АСК для первичной профилактики сердечно-сосудистых заболеваний (ССЗ). До сих пор рекомендации различных экспертных сообществ остаются довольно противоречивыми в этом вопросе. Мнения колеблются в диапазоне от «назначать всем пациентам старше 50 лет» (ACCP, 2012) [2] до полного отрицания возможностей использования АСК пациентами без доказанного ССЗ (Европейские рекомендации по предотвращению сердечно-сосудистых заболеваний, 2016) [3].
Более взвешенную позицию, согласующуюся с большинством европейских и американских руководств, занимают отечественные эксперты: АСК может быть назначена пациентам без клинически выраженного атеросклероза, но с высоким риском смерти от ССЗ [4]. Этот риск предложено рассчитывать по широко используемой в нашей стране шкале SCORE, а большая угроза смерти в течение 10 лет (≥10%) для таких пациентов может определяться помимо обычных факторов риска (пол, возраст старше 50 лет, курение, гиперлипидемия) наличием сахарного диабета и нарушением функции почек. В случае если высокий риск обусловлен тяжелой артериальной гипертензией (АГ), назначение АСК возможно только после достижения жесткого контроля над АГ для снижения вероятности внутричерепных кровоизлияний. Таким образом баланс риска и пользы от назначения АСК поддерживается на оптимальном уровне, поскольку в «целевую группу» попадают пациенты с высокой вероятностью развития (или манифестации субклинического) атеросклероза, для которых небольшое увеличение риска геморрагических осложнений оправданно.
Возможно, взгляды на применение АСК для первичной профилактики изменятся в течение ближайших пяти лет после завершения четырех крупных исследований в этом направлении: двух у пациентов с сахарным диабетом [5, 6], одного у пожилых больных [7] и одного у пациентов с умеренным сердечно-сосудистым риском [8].
Для больных с уже развившимся атеросклеротическим поражением целесообразность использования АСК с целью вторичной профилактики сердечно-сосудистых осложнений не вызывает сомнений. Многочисленные клинические исследования, на основе которых неоднократно проводились мета-анализы, убедительно показывают возможность существенного снижения вероятности инфаркта миокарда, инсульта и смерти от ССЗ при длительном применении низких доз АСК [9, 10].
Основные рекомендации по применению антиагрегантной терапии с целью вторичной профилактики приведены в табл. 1. Можно отметить, что любое из проявлений атеросклероза определяет показания к фактически пожизненному назначению АСК, за исключением редких случаев ее непереносимости, когда используется более дорогой клопидогрел. Ситуации, значительно повышающие риск тромбообразования (острый коронарный синдром, чрескожное вмешательство, имплантация стента, аортокоронарное шунтирование), требуют усиления антиагрегантного воздействия и назначения т.н. двойной антитромбоцитарной терапии (ДАТ). К основному препарату (АСК) добавляют антиагрегант с другим механизмом действия – клопидогрел или тикагрелор. Продолжительность ДАТ определяется соотношением риска геморрагических и тромботических осложнений у больного, видом имплантированного стента и составляет от месяца до года. Удобна в использовании шкала DAPT (табл. 2), позволяющая на основе простых критериев (сумма баллов >2) оценить необходимость продления ДАТ более 12 месяцев после перенесенного острого коронарного события.
На практике профилактическое применение АСК происходит не в полном соответствии с клиническими рекомендациями. Многочисленные зарубежные работы, в которых исследуется ситуация в реальном здравоохранении, показывают, что многие больные, которым АСК показана, препарат не принимают (или его не назначают). Напротив, нередко АСК назначается без веских оснований, особенно это касается первичной профилактики [1, 11, 12]. К сожалению, отечественных работ, анализирующих адекватность применения АСК, обнаружить не удалось.

Одним из объяснений того, что эти простые рекомендации так непросто реализовать на практике, помимо плохой информированности врачей и, соответственно, пациентов является вероятность развития побочных эффектов. Появление кровотечений, даже небольших, или неприятных желудочно-кишечных симптомов способно значительно снизить комплаенс больного и привести к отмене препарата. В направлении снижения частоты побочных эффектов АСК было предпринято много шагов. Первым стало определение оптимальной дозы препарата, сохраняющей достаточную ингибирующую активность в отношении тромбоксана и при этом достаточно безопасной. Этот вопрос на сегодняшний день можно считать решенным, в многочисленных клинических исследованиях эта доза была установлена: 75–150 мг однократно в сутки [9]. Тем не менее продолжает обсуждаться возможность применения других режимов дозирования АСК (например, прием препарата через день, иногда в больших дозах), оптимальное время суток [13]. Поскольку эти гипотезы нуждаются в проверке проспективными исследованиями, маловероятно, что в обозримом будущем можно ождиать каких-либо изменений в этом отношении [14].
Следующим шагом стало создание препаратов АСК, покрытых кишечно-растворимой оболочкой (КРА). Идея о том, что смещение места всасывания препарата снизит частоту желудочно-кишечных нежелательных реакций, интуитивно понятна и находит отклик среди врачей и пациентов. Однако данные клинических исследований не смогли однозначно подтвердить превосходство такого подхода над одновременным применением АСК и противоязвенных препаратов – ингибиторов протонной помпы, H2-блокаторов, антацидов [16]. Популярность этой стратегии привела к созданию т.н. буферных форм АСК (БА), содержащих два компонента в одной таблетке. Увеличить безопасность длительного применения АСК за счет снижения риска развития гастро- и энтеропатии можно и с помощью предварительного проведения эрадикации H. pylori [16, 17].
Полученные в ходе клинических исследований безопасности КРА и БА данные противоречивы, что связано с отличиями дизайна исследования (вид сравниваемых препаратов, режим дозирования, выбранные конечные точки, способ их подтверждения). Так, в одном из исследований было показано, что, по данным эндоскопии, частота эрозивного поражения слизистой желудка достоверно реже развивалась у пациентов, принимавших с целью вторичной профилактики КРА (100 мг/сут, n=101), чем БА (81 мг/сут, n=98): 37,6 против 60,7% соответственно, р=0,0015. При этом язвенное поражение наблюдалось одинаково часто [18].
В другом исследовании с эндоскопической верификацией достоверных отличий в частоте поражений слизистой в группах КРА (150 мг/сут, n=25) и обычной АСК (150 мг/сут, n=22) не было [19]. Еще одно исследование позволило установить, что пациентам, получающим КРА, чаще назначают ингибиторы протонной помпы, чем тем, кто лечится БА (25,4 и 14,4%). Риск появления гастрита, дуоденита, язв слизистой оболочки и мелены был выше в группе КРА в 6- и 12-месячной перспективе [20].
По данным капсульной эндоскопии частота развития эрозий и язв слизистой тонкого кишечника была достоверно ниже в группе БА (n=15), чем у больных, получавших КРА (n=55) (46,7 против 72,7% [р=0,057] и 6,7 против 38,2% [р=0,026] соответственно) [21]. Эти два направления модификации лекарственной формы АСК, естественно, не способны снизить частоту геморрагических осложнений, поскольку их развитие служит следствием прямого эффекта препарата вне зависимости от того, как именно он был доставлен [15]. Отсутствие отличий в вероятности появления желудочно-кишечных кровотечений при применении КРА и БА было подтверждено в ходе клинических исследований [22]. К счастью, эти осложнения терапии АСК развиваются существенно реже, чем желудочно-кишечные.
Наиболее популярным буферным препаратом АСК является Кардиомагнил. Любопытно, что при широкой известности среди как врачей, так и пациентов многие неправильно относят его к КРА. На самом деле Кардиомагнил представляет собой сочетание АСК и невсасываемого антацида – гидроксида магния, за счет которого снижается частота желудочно-кишечных осложнений [23]. Так, при проведении трехмесячной терапии Кардиомагнилом 150 мг/сут (n=40) и КРА 150 мг/сут (n=40) у пациентов со стабильной стенокардией или постинфарктным кардиосклерозом, имеющих как минимум 1 фактор риска развития гастропатии, вызванной применением нестероидных противовоспалительных препаратов (язвенная болезнь в анамнезе, хроническая сердечная недостаточность II–III функциональных классов, выраженный атеросклероз периферических артерий, сахарный диабет), частота развития эрозивных поражений слизистой оболочки желудка и двенадцатиперстной кишки, по данным эзофагогастродуоденоскопиии, составила 22,5 и 65% соответственно, р<0,05. В группе КРА выраженность и продолжительность диспептических жалоб были достоверно выше. Язвенные дефекты не были выявлены ни в одной группе. Фармакоэкономический анализ, учитывавший не только прямые затраты на АСК, но и коррекцию развивающейся диспепсии, также продемонстрировал преимущества Кардиомагнила [24].
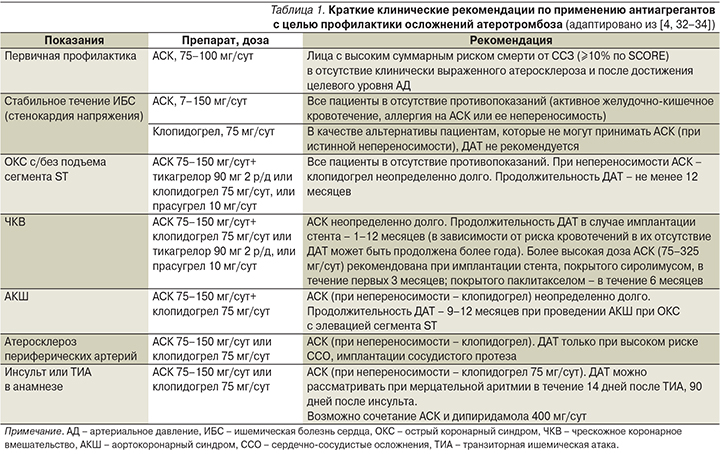
При прямом сравнении эффективности и безопасности обычной АСК (n=286), КРА n=36) и Кардиомагнила (n=57) было показано, что в последней группе частота жалоб со стороны желудочно-кишечного тракта была наименьшей [25]. Желудочно-кишечные кровотечения зафиксированы не были. Это исследование интересно еще и сопоставлением эффективности различных форм АСК в подавлении агрегации тромбоцитов. Наибольший эффект в этом отношении достигался при применении желудочно-растворимых форм АСК (обычной и Кардиомагнила), а не кишечно-растворимой. Эти наблюдения подводят к обсуждению очень важных отличий в фармакокинетике желудочно-растворимых форм АСК и КРА. На рис. 1 хорошо видно, что при приеме желудочно-растворимых форм АСК всасывание препарата начинается быстрее, чем при приеме КРА. Это обеспечивает более быстрое достижение высокой концентрации АСК в крови и, следовательно, более быстрое подавление агрегации тромбоцитов. Кроме того, после приема желудочно-растворимой АСК препарат находится в крови существенно меньшее время, что может снизить повреждающий эффект на слизистую оболочку желудочно-кишечного тракта.
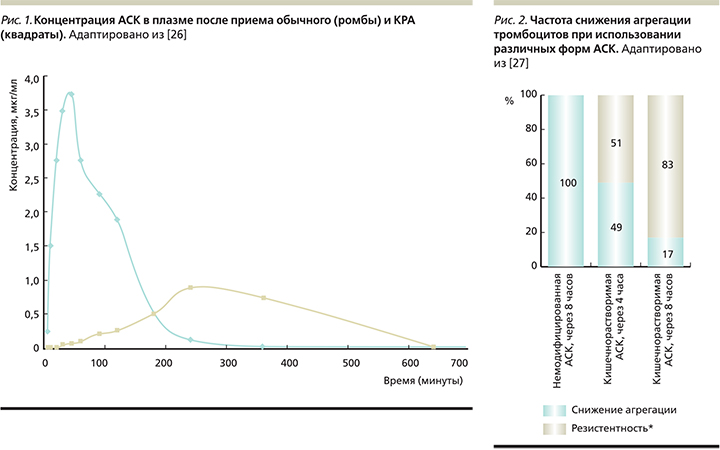
Возможно, именно этим можно объяснить более частое развитие псевдорезистентности к АСК при использовании КРА. В исследовании на 400 здоровых добровольцах было показано, что через 4 часа после приема КРА почти у половины пациентов функциональная активность тромбоцитов не снижалась. Через 8 часов должного эффекта не было у 17% больных (рис. 2) [27]. Это может приводить к недостаточной прогностической эффективности принимаемого препарата и повышать риск развития сердечно-сосудистых осложнений [28].
За последнее время накоплена масса данных, позволяющих более серьезно рассматривать низкие дозы АСК в качестве средства профилактики онкологических заболеваний, прежде всего одного из наиболее частых – колоректального рака [29, 30]. Однако пока не будут завершены исследования в этом направлении, применять препарат по этому показанию рано. В случае если противоопухолевые эффекты АСК будут доказаны, взгляды на соотношение риска и пользы ее использования для первичной профилактики ССЗ могут несколько измениться. Профилактика сердечно-сосудистых осложнений при атеросклерозе складывается не только из снижения вероятности тромбоза, но и из воздействия на гиперлипидемию и собственно атеросклеротическую бляшку с помощью статинов. Кроме того, использование ингибиторов ангиотензин-превращающего фермента также позволяет улучшать прогноз больных ишемической болезнью сердца. Поскольку большое количество пациентов одновременно принимают препараты трех групп, набирает популярность идея создания «polypill» – лекарственной формы, содержащей три эти компонента одновременно [31]. Такая стратегия поможет увеличить приверженность больных к лечению и, возможно, улучшить их прогноз.
Таким образом, АСК удерживает лидирующую позицию в предотвращении осложнений атеротромбоза. Четкое следование клиническим рекомендациям по ее использованию позволяет эффективно и безопасно проводить длительную профилактику. Преимущества буферных форм АСК (Кардиомагнил) рационально обоснованы и доказаны клиническими исследованиями.



