Согласно данным ВОЗ, сердечно-сосудистые заболевания (ССЗ) – основная причина смерти во всем мире. Каждый год от ССЗ умирают 17,5 млн человек, что составляет 31% всех случаев смерти в мире. По прогнозам, эти болезни останутся основной отдельной причиной смерти [1].
В последние годы активно исследуется значение системы врожденного иммунитета в патогенезе ишемического инсульта (ИИ) и инфаркта миокарда (ИМ). Активация клеток врожденной иммунной системы происходит через особые трансмембранные рецепторы – Toll-подобные рецепторы (TLR), некоторые из которых локализуются на поверхности клеток (например, TLR2, TLR4), а другие расположены внутриклеточно на эндосомальных мембранах (например, TLR3, TLR7, TLR8). Практически все клетки организма несут TLR (включая кардиомиоциты, фибробласты, гепатоциты и клетки головного мозга) [2]. Система TLR включает лиганды TLR, сами рецепторы, молекулы, осуществляющие трансдукцию сигнала, – адаптерные белки (MyD88, IRAK и др.), а также эффекторные молекулы, которые вырабатываются в результате активации TLR и опосредуют их дальнейшие эффекты [3, 4]. В недавних работах было показано, что микро-РНК могут влиять на активность TLR, регулируя экспрессию мРНК TLR, способствуя прямой активации рецептора, а также связыванию TLR с TLR-специфическими компонентами сигнального пути [5].
Данные генетических исследований подтвердили значимость TLR для формирования и прогрессирования атеросклероза [4, 6, 7]. Уменьшение экспрессии их адаптерной молекулы MyD88 у мышей сопровождается в эксперименте образованием меньшего числа атеросклеротических бляшек и снижением в них уровней цитокинов, химокинов и молекул адгезии.
Экспрессия TLR4 значительно повышена в месте атеросклеротического повреждения артериальной стенки и на всех типах клеток, входящих в состав атеромы [8]. Активация TLR4 оказалась взаимосвязанной с повышением нестабильности покрышки бляшки [9]. Повышенные уровни TLR2 и TLR4 обнаружены также у пациентов со стабильной и нестабиль-ной стенокардией на мононуклеарных клетках периферической крови [10].
Анализ результатов клинических исследований по изучению взаимосвязи полиморфизма гена tlr4 и риска развития ИМ показал наличие меньшего риска развития ИМ у лиц – носителей Asp 299Gly аллеля этого гена [11].
По данным D.A. Enquobahrie и соавт. [12], замена нуклеотида rs1927911 на малом аллеле гена tlr4 ассоциируется с риском возникновения нефатального ИМ, а взаимосвязи полиморфизма гена tlr4 и риска развития ИИ не наблюдается. Напротив, достоверная ассоциация между носительством аллеля C119A гена tlr4 и риском развития ИИ установлена в популяции этнических китайцев в Тайване [13].
В экспериментальных работах было показано, что «выключение функции» гена tlr4 или применение специфических ингибиторов TLR4, например, таких, как RP105, сопровождается протективным эффектом для острой ишемии миокарда [14, 15]. По данным немецких исследователей, у мышей с нокаутом гена tlr4 развитие инфаркта сопровождается меньшим ремоделированием левого желудочка (ЛЖ) и большей выживаемостью [17].
Потеря функции гена tlr4 в экспериментальных моделях ИИ также сопровождалась уменьшением выраженности повреждения мозга. После окклюзии средней мозговой артерии у мышей с нокаутированием гена tlr4 формируется меньший по объему очаг ишемии, что сопровождается уменьшением выраженности неврологического дефицита [18]. Позже L. Andresen и соавт. в экспериментальной работе показали, что применение антител к TLR4 (Anti-TLR4-Antibody MTS510) снижает объем инфаркта и отек мозга [19]. Интересной терапевтической мишенью также представляется провоспалительный цитокиновый медиатор HMGB1 (high-mobility group protein B1), чья экспрессия возрастает при активации TLR2 [20].

В нескольких исследованиях продемонстрированы различия эффектов активации TLR в патогенезе ишемического повреждения головного мозга [21]. По мнению C.S. Jack и соавт. [22], активация различных типов TLR в центральной нервной системе зависит от типа активируемых клеток, специфичности лиганда и наличия или отсутствия сигналов от других рецепторов. Так, было показано, что активация внутриклеточного TLR3, возможно, играет нейропротективную роль [23]. Тогда как активация нейрональных TLR4 сопровождается в целом негативным эффектом, вплоть до гибели клетки, а активация TLR микроглии вносит ведущий вклад в воспалительную реакцию в зоне пенубры [24].
Представленные литературные данные подтверждают важную роль TLR4 в ишемическом повреждении миокарда и головного мозга и позволяют рассматривать эти рецепторы в качестве возможной терапевтической мишени. Toll-подобные рецепторы-4 (TLR4) имеют практически повсеместную распространенность в организме человека, экспрессируясь на разнообразных типах клеток и взаимодействуя с массой разнообразных лигандов, в т.ч. эндогенного происхождения, высвобождающихся при повреждении тканей [25], что делает возможным исследование экспрессии TLR4 в клетках периферической крови при ИМ и инфаркте головного мозга.
Цель исследования: оценка уровня экспрессии поверхностных TLR4-клеток периферической крови (моноцитов и гранулоцитов), ее динамики и клинической значимости у больных атеротромботическим ИИ по сравнению с пациентами с острым ИМ и контрольной группой.
Материал и методы
В исследование были включены 94 пациента с Q-образующим ИМ (первая основная группа) и 58 – с атеротромботическим ИИ (вторая основная группа), установленным в соответствии с критериями TOAST – Trial of Org 10172 in Acute Stroke Treatment [26]. Все больные поступили в клинику в первые 24 часа от начала заболевания. Контрольную группу составили 62 пациента без эпизодов ишемического повреждения тканей в анамнезе на момент обследования и сопоставимые по полу, возрасту и фоновым заболеваниям с больными двух основных групп.
Методом проточной цитофлуориметрии определена экспрессия TLR4 на клетках периферической крови (мононуклеарах и гранулоцитах) на 1-е, 7 и 14-е сутки заболевания. У пациентов контрольной группы маркеры определены однократно. Фракция мононуклеаров периферической крови выделена стандартным методом центрифугирования клеток в градиенте плотности с применением раствора фиколлверографина (1,077–1,078 г/см3).
Изолированные пулы клеток инкубировали в течение 4 часов в среде RPMI-1640 («Sigma Aldrich», США) с добавлением 10%-ной эмбриональной телячьей сыворотки («ПанЭко», Россия), 2 мМ L-глутамина («Sigma Aldrich», США), при 370°С в атмосфере с 5%-ным СО2.
Оценка уровня экспрессии TLR4 на клетках периферической крови осуществлена после раститровывания клеток из расчета 300 тыс. на 1 мл, центрифугирования и отделения супернатанта. К осадку добавлены моноклональные антитела к TLR4 из расчета 10 мкл Ат на 300 тыс. клеток. После повторных центрифугирования и отмывки проведена проточная цитофлуориметрия. Все цитометрические измерения осуществлены на проточном цитофлуориметре FACScan («Becton Dickinson», США).
Результаты и обсуждение
У всех больных двух основных групп по сравнению с контрольными значениями в конце первых суток заболевания и в динамике было отмечено достоверное повышение уровня экспрессии поверхностных TLR4 на мононуклеарах периферической крови (рис. 1).
У больных ИМ по сравнению с группой контроля на 1-е сутки заболевания отмечена более выраженная, чем у больных ИИ, активация TLR4 на циркулирующих мононуклеарах, что, по-видимому, отражает более быстрое развитие системного воспаления при острой ишемии миокарда по сравнению с ишемией головного мозга. Повышенные значения уровня экспрессии TLR4 сохранялись в обеих группах больных к 7-м и 14-м суткам заболевания.
Обращает на себя внимание постепенное снижение значений экспрессии TLR4 в первой, основной, группе больных к 7-м и 14-м суткам и нарастание данного показателя у больных второй группы, хотя динамика изменений оказалась статистически значимой только у больных с ИМ с 1-х по 7-е сутки заболевания, когда снижение активности TLR4 составило 29% от исходного уровня (р<0,05). Обнаруженная повышенная экспрессия TLR4 на поверх-ности мононуклеаров периферической крови свидетельствует о вовлеченности механизмов врожденного иммунитета в развитие и течение острого ишемического повреждения независимо от его локализации в сердце или головном мозге.
У всех больных двух основных групп в конце первых суток заболевания и в динамике уровень экспрессии поверхностных TLR4 на популяции гранулоцитов периферической крови не имел статистически значимых отличий от контрольных значений (рис. 2).
Таким образом, у пациентов с ИМ и атеротромботическим ИИ экспрессия TLR4 на мононуклеарах превышает таковую рецептора на гранулоцитах в остром периоде заболевания.
При изучении клинической значимости активации TLR4 методом корреляционного анализа выявлена достоверная прямая взаимосвязь экспрессии TLR4 на мононуклеарах крови и частоты сердечных сокращений в первые сутки развития ИМ (r=0,81; p<0,05). Таким образом, отмечена связь между тахикардией и системным воспалительным ответом, вероятно обусловленная дисбалансом парасимпатической нервной системы и повышением тонуса симпатической.
По-видимому, имеющаяся при развитии ИМ повышенная активность нейрогуморальных систем, в частности симпатоадреналовой, отражается не только на параметрах гемодинамики, но и на степени выраженности воспалительной реакции и иммунного ответа.
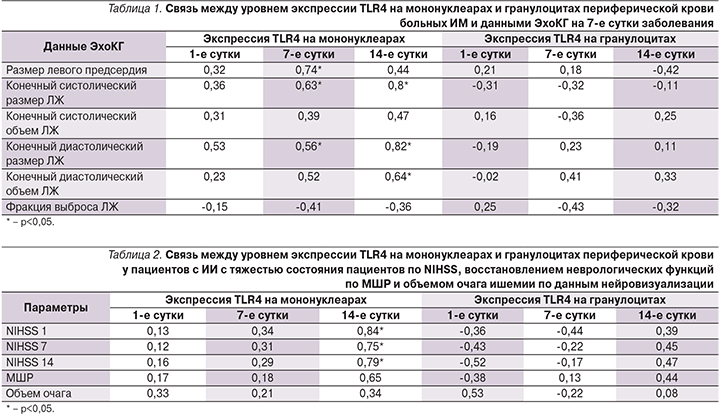
По данным корреляционного анализа обнаружена статистически значимая достоверная прямая корреляция между экспрессией TLR4 на мононуклеарах на 7-е и 14-е сутки заболевания и размерами левых отделов сердца у больных ИМ. При этом обнаружена достоверная прямая взаимосвязь между экспрессией TLR4 на 14-е сутки ИМ и значением конечного систолического и диастолического размеров ЛЖ (r=0,8; p<0,05, r=0,82; p<0,05 соответственно) (табл. 1).
Таким образом, наблюдалась взаимосвязь степени активации TLR4 и выраженности ремоделирования ЛЖ у больных ИМ. Полученные клинические данные согласуются с результатами экспериментальных работ A. Riad и соавт. [17] и L. Timmers и соавт. [27], в которых у мышей после перевязки коронарных артерий отмечена взаимосвязь уровня активации TLR4 и выраженности постинфарктного ремоделирования ЛЖ. Достоверных связей между размерами полостей сердца, по данным ЭхоКГ, выполненной на 1–2-е сутки заболевания, выявлено не было.
У больных атеротромботическим ИИ при проведении корреляционного анализа установлена статистически значимая достоверная прямая корреляция экспрессии TLR4 на мононуклеарах на 14-е сутки и степенью тяжести состояния пациентов по NIHSS (National Institutes of Health Stroke Scale) на 1-е (r=0,84; p<0,05), 7-е (r=0,75; p<0,05) и 14-е (r=0,7; p<0,05) сутки заболевания, что свидетельствует о клинической значимости активации экспрессии TLR4 в патогенезе ИИ. Других достоверных корреляций экспрессии TLR4 на мононуклеарах по данным клинико-инструментального обследования больных второй основной группы, в частности, объем очага ишемии по данным нейровизуализирующих методов, и степень функционального восстановления по модифицированной шкале Рэнкина (МШР) не выявлено (табл. 2).
Выявленная зависимость уровня отсроченной экспрессии данных рецепторов (на 14-е сутки), степени тяжести пациентов и отсутствия подобных взаимосвязей в более ранние сроки свидетельствует о том, что избыточная или длительная активация данных рецепторов требует супрессии.
По-видимому, в первые дни формирования очага ишемического повре-ждения активация TLR4 способствует реализации адекватного воспалительного ответа на повреждение и инициации процессов тканевой репарации. Длительная или чрезмерная акти-вация TLR4-рецепторов на моноцитах, лимфоцитах, кардиомиоцитах и других клетках, участвующих в процессах постинфарктного и постинсультного заживления, сопровождается избыточным накоплением эффекторных молекул, что сопровождается дополнительным повреждением тканей [28].
Уровень экспрессии TLR4 на периферических гранулоцитах не был достоверно взаимосвязан с какими-либо данными клинико-инструментального обследования у больных ИМ и атеротромботическим ИИ.
Заключение
Проведенное нами исследование выявило повышение уровня TLR4 на мононуклеарах у пациентов с ИМ и атеротромботическим ИИ, в то время как экспрессия TLR4 на гранулоцитах не имела статистически значимых отличий от контрольных значений. Полученные прямые достоверные корреляции уровня экспрессии TLR4 с тяжестью состояния пациентов с ИИ на 1-е, 7 и 14-е сутки и выраженностью постинфарктного ремоделирования у больных ИМ позволяют сделать вывод о вовлечении активации данных рецепторов в патогенез ИМ и атеротромботического ИИ у человека. Отсроченное повышение уровня экспрессии TLR4 в динамике ишемического повреждения миокарда и головного мозга может служить критерием тяжести течения заболевания, а также позволяет рассматривать эти рецепторы в качестве возможной терапевтической мишени.



