Респираторный дистресс-синдром (РДС) новорожденных представляет собой заболевание легких, которое при естественном течении возникает при рождении или сразу после него и нарастает по тяжести в течение первых двух суток жизни. Клинически РДС проявляется в виде цианоза, хрипящего дыхания, западения грудной клетки и тахипноэ. О развитии дыхательной недостаточности будут свидетельствовать изменения газового состава крови; диагноз может быть подтвержден путем рентгенографии органов грудной клетки, при ее проведении выявляется классическая картина затемнений по типу «матового стекла» и воздушные бронхограммы. У выживших детей регресс симптомов начинается через 2–4 дня. Респираторный дистресс-синдром связан с дефицитом сурфактанта в альвеолах, структурной незрелостью легких и, как правило, является болезнью недоношенных новорожденных. Верификация РДС затруднена при профилактическом применении сурфактанта и очень раннем проведении вентиляции с постоянным положительным давлением в дыхательных путях (СРАР). Согласно определению Vermont Oxford Neonatal Network, РДС диагностируется у детей с PaO2 < 50 мм рт. ст. (< 6,6 кПа) при комнатном воздухе, при наличии центрального цианоза при комнатном воздухе или при необходимости в дополнительном введении кислорода для поддержания PaO2 > 50 мм рт. ст. (> 6,6 кПа), а также при наличии классической рентгенологической картины органов грудной клетки. При современной тактике раннего проведения терапии клиническая симптоматика может не достигать картины классического определения РДС, и диагностика на основании факта введения сурфактанта может быть ошибочной (гипердиагностика). Согласно данным EuroNeoNet, в 2010 г. частота РДС составляла 92 % на сроке 24–25 недель беременности, 88 % – на 26–27-й неделе, 76 % – на 28–29-й и 57 % на 30–31-й неделе [1].
Несмотря на произошедший в последнее время прогресс в перинатальной помощи новорожденным детям с РДС, в отношении ряда терапевтических и профилактических стратегий при данном заболевании до настоящего время существуют противоречивые мнения. Получены убедительные данные, подтверждающие важную роль антенатального применения стероидов в профилактике РДС, однако до сих пор не ясно, превышает ли польза проведения повторных курсов для респираторных исходов риск нежелательных краткосрочных и долгосрочных исходов.
Многие методики, применяющиеся для стабилизации состояния недоношенных новорожденных при рождении, не имеют достаточной доказательной базы, включая введение кислорода и раздувание легких положительным давлением, и иногда могут вызывать неблагоприятные эффекты.
Заместительная терапия сурфактантом считается решающей в терапии РДС. Большинство аспектов применения сурфактанта было изучено в многоцентровых рандомизированных контролируемых исследованиях (РКИ), многие из которых проанализированы в систематических обзорах. Сурфактанты произвели революцию в респираторной поддержке в течение последних двух десятилетий – они снижали риск развития пневмоторакса и неонатальную смертность как при профилактическом применении [2], так и при проведении экстренной терапии [3] новорожденных с РДС или с риском РДС.
Было проведено много РКИ для определения лучшего сурфактанта, оптимального времени первого и повторного введений препарата, однако вопрос о выборе лучшего препарата, оптимальной дозе и времени введения детям с разным гестационным возра-стом остается не до конца решенным. Кроме того, очень раннее применение СРАР привело к изменению показаний к профилактическому введению сурфактанта.
Избыточное воздействие дополнительного кислорода на недоношенных детей четко связано с развитием ретинопатии недоношенных и бронхолегочной дисплазии (БЛД). Колебания насыщения кислородом крови (SaO2) также связаны с увеличением частоты развития ретинопатии недоношенных. Недавно был проведен ряд крупных исследований для определения эффективности и безопасности нижнего предела целевой SaO2 путем рандомизации детей в группы с целевой SaO2 85–89 % или 91–95 %. В первом опубликованном исследовании показано, что в группе детей с низкими значениями целевой SaO2 частота ретинопатии недоношенных среди выживших пациентов была в 2 раза ниже, однако риск летального исхода был на 4 % выше [4]. Промежуточный мета-анализ данных 2631 младенца из Великобритании, Австралии и Новой Зеландии в исследовании BOOST II подтвердил полученные результаты, несмотря на то что увеличение смертности было выявлено только среди детей с гестационным возрастом менее 27 недель [5].
Целью механической вентиляции (МВ) легких является обеспечение приемлемой концентрации газов крови при минимальных повреждениях легких и побочных эффектах для достижения оптимального дыхательного объема. Респираторная поддержка в виде МВ легких может спасти жизнь, однако может и вызвать повреждение легких, поэтому протоколы респираторной поддержки должны быть по мере возможности направлены на отказ от МВ путем использования неинвазивной респираторной поддержки, например СРАР.
Внутриутробная пневмония новорожденных может имитировать РДС. К наиболее частым этиологическим факторам внутриутробной пневмонии относятся стрептококки группы В, однако ее также могут вызывать Escherichia coli и другие микроорганизмы. Поэтому считается правильной практика проводить скрининг всех детей с РДС при помощи посева крови, а также обследовать детей на предмет наличия других симптомов сепсиса, таких как нейтропения или повышение концентрации С-реактивного белка, и начинать лечение антибиотиками до получения результатов исследований. Такая тактика рутинного использования антибиотикотерапии выглядит спорной, т.к. доказательства в ее поддержку отсутствуют, в то время как длительное эмпирическое применение антибиотиков к недоношенным детям связано с развитием нежелательных исходов, включая некротизирующий энтероколит (НЭК) [6, 7].
С целью достижения наилучших исходов для детей с РДС необходимо оказание оптимальной поддерживающей терапии, включая поддержание нормальной температуры тела, проведение надлежащей инфузионной терапии, парентерального питания, лечение открытого артериального протока (ОАП) и поддержку кровообращения для поддержания адекватной перфузии тканей.
Цель терапии РДС заключается в проведении вмешательств, которые смогут максимально увеличить выживаемость новорожденных и минимизировать возможные побочные эффекты. За прошедшие 40 лет с целью профилактики и лечения РДС было разработано и изучено в клинических исследованиях множество различных стратегий и видов терапии; многие из них в настоящее время изучаются в систематических обзорах. В настоящем документе [8] приведено обновление двух предыдущих рекомендаций, опубликованных в 2007-м [9] и 2010 г.
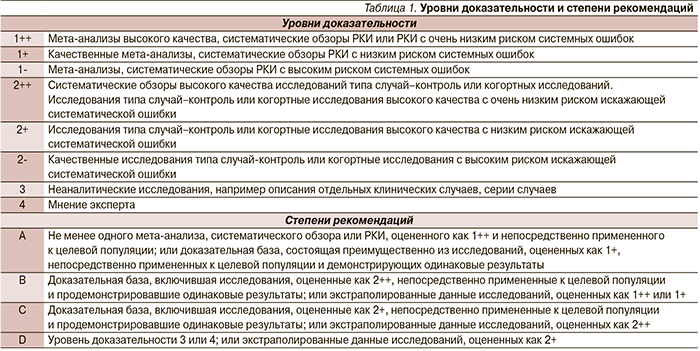
[10], после критического изучения наиболее современных данных, полученных к концу 2012 г. Повышены уровень доказательности и степень ряда рекомендаций. Использованные уровни доказательности и степени рекомендаций представлены в табл. 1.
Ниже приведены клинические рекомендации консенсуса и их степень.

Пренатальная помощь
Женщины с высоким риском преждевременных родов и рождения глубоконедоношенных детей должны быть переведены в перинатальные центры, имеющие опыт терапии РДС (С).
Клиницисты должны предлагать проведение одного курса пренатальной терапии кортикостероидами всем женщинам с риском преждевременных родов на сроке от 23 до полных 34 недель гестации (А).
Второй курс антенатальной терапии кортикостероидами может назначаться в том случае, если после проведения первого курса прошло более 2–3 недель и при возрасте ребенка < 33 недель гестации в случае возникновения других акушерских показаний (А).
Вопрос об антенатальной терапии кортикостероидами также необходимо рассматривать в отношении женщин, которым проводится плановое досрочное кесарево сечение (В).
Терапия антибиотиками должна проводиться беременным женщинам с преждевременным разрывом плодных оболочек, т.к. это снижает риск преждевременных родов (А).
Клиницисты должны рассматривать вопрос о кратковременном назначении токолитических средств, чтобы сделать возможным проведение полного курса пренатальной терапии кортикостероидами и/или госпитализировать беременную женщину в перинатальный центр (В).
Стабилизация состояния в родильном зале
При возможности следует отсрочить перевязку пуповины до 60 секунд, удерживая ребенка ниже матери для улучшения тока крови от плаценты к новорожденному (A).
При проведении реанимации необходимо контролировать поступление кислорода при помощи смесителя. Концентрация кислорода FiO2 21–30 % применяется для первоначальной стабилизации состояния, коррекция в сторону увеличения или уменьшения должна проводиться на основании данных пульсоксиметрии на правом запястье с момента рождения для получения информации о частоте сердечных сокращений и сатурации гемоглобина кислородом SaO2 (B).
Новорожденным, способным к самостоятельному дыханию, стабилизацию состояния начинают с проведения CPAP с давлением 5–6 см водного столба через маску или назальные канюли (A).
Интубация должна проводиться детям только при неэффективности вентиляции с положительным давлением через лицевую маску (A). Детям, нуждающимся в проведении интубации для стабилизации состояния, должно осуществляться введение сурфактанта (A).
Во время стабилизации состояния в родильном отделении к детям в возрасте < 28 недель гестации следует применять пластиковые мешки или герметичное обертывание под инфракрасными обогревателями для снижения риска гипотермии (A).
За детьми, состояние которых было стабилизировано под инфракрасными обогревателями, должен осуществляться контроль состояния в течение 10 минут во избежание перегревания (A).
Терапия сурфактантом
Новорожденным с РДС должно осуществляться введение натурального препарата сурфактанта (А).
Тактика раннего экстренного введения сурфактанта должна стать стандартом терапии, однако в ряде случаев введение сурфактанта должно осуществляться в родильном зале, например, глубоконедоношенным новорожденным, матерям которых не проводилась антенатальная терапия кортикостероидами, или в случае необходимости проведения интубации для стабилизации состояния (А).
Новорожденным с РДС должно осуществляться экстренное введение сурфактанта в начале заболевания. Проведение терапии по протоколу рекомендуется детям в возрасте < 26 недель гестации при необходимом FiO2 > 30 %, детям в возрасте > 26 недель при необходимом FiO2 > 40 % (B).

При терапии РДС введение порактанта альфа в начальной дозе 200 мг/кг более предпочтительно, чем применение порактанта альфа в дозе 100 мг/кг или берактанта (А).
Следует рассмотреть вопрос о целесообразности применения техники InSurE (INtubate–SURfactant–Extubate, Интубация–Сурфактант–Экстубация). Более доношенным новорожденным часто может быть выполнена экстубация с переводом на CPAP или на назальную вентиляцию с перемежающимся положительным давлением (NIPPV) сразу после введения сурфактанта, при этом необходимо проводить клиническую оценку относительно переносимости данной процедуры для каждого новорожденного (B).
Вторая, а иногда и третья дозы сурфактанта должны вводиться при сохранении признаков РДС, таких как сохраняющаяся потребность в кислороде и проведение МВ (А).
Для лечения новорожденных детей с РДС зарегистрировано несколько различных препаратов сурфактантов, включая синтетические (безбелковые) и натуральные, полученные из легких животных. Сурфактанты, в настоящий момент доступные на фармрынке Европы, приведены в табл. 2.
Дополнительное введение кислорода после стабилизации состояния
Для недоношенных детей, получающих кислород, целевой диапазон SaO2 должен находиться в пределах 90–95 % (В).
Следует избегать колебаний SaO2 в постнатальном периоде (С).
После введения сурфактанта следует избегать гипероксического пика посредством быстрого снижения FiO2 (C).
Неинвазивная искусственная вентиляция легких
Применение СРАР следует начинать с момента рождения ко всем младенцам с риском РДС, например, при гестационном возрасте до 30 недель, которым не требуется механическая вентиляция, и продолжать до оценки их клинического статуса (А)
Система для проведения СРАР не имеет большого значения, однако конструкция должна включать короткие биназальные канюли или маску и начальное давление должно составлять не менее 6 см H2O (А). Затем можно индивидуализировать уровень положительного давления в конце выдоха РЕЕР (positive and expiratory pressure) в зависимости от клинического состояния пациента, оксигенации и перфузии (D).
CPAP с ранним экстренным введением сурфактанта следует рассматривать как оптимальную тактику в отношении младенцев с РДС (А).
Данные исследования NIPPV можно учитывать при лечении детей, СРАР-терапия которых оказалась неэффективной, для снижения риска неэффективности экстубации; однако это может не приводить к значимым долгосрочным преимуществам (А).
Стратегии МВ
Механическую вентиляцию следует использовать для поддержания состояния младенцев в случаях, когда другие методы респираторной поддержки оказались неэффективными (В). Продолжительность МВ следует минимизировать для того, чтобы максимально снизить ее повреждающее действие на легкие (В).
Следует использовать вентиляцию с целевым дыхательным объемом, т.к. это сокращает продолжительность вентиляции и снижает частоту БЛД (А).
Высокочастотная осцилляторная вентиляция легких (HFOV) может быть эффективной в качестве экстренной терапии (B).
При прекращении МВ целесообразно допускать некоторую степень гиперкапнии при рН выше 7,22 (В).
Следует избегать гипокапнии, т.к. она связана с повышенным риском БЛД и перивентрикулярной лейкомаляции (В).
К младенцам с апноэ, а также для облегчения прекращения МВ следует применять кофеин (А). Надлежит также рассмотреть возможность применения кофеина ко всем младенцам с высоким риском необходимости МВ, например с весом при рождении менее 1250 г, которые находятся на неинвазивной вспомогательной искусственной вентиляции легких (В).
Для облегчения экстубации у младенцев, которые оставались на МВ через 1–2 недели после рождения, следует рассмотреть вопрос о применении короткого курса терапии дексаметазоном в низких или очень низких дозах с постепенным снижением дозы (A).
Профилактика сепсиса
Лечение антибиотиками младенцев с РДС часто начинают до исключения сепсиса, однако необходимо использовать стратегию, которая позволит сузить спектр и минимизировать нежелательное воздействие. Обычный режим терапии включает пенициллин или ампициллин в комбинации с аминогликозидами (D). Лечение антибиотиками следует прекращать как можно скорее – как только будет исключен сепсис (С).
В отделениях с высокой частотой инвазивных грибковых инфекций рекомендуется проводить профилактическое лечение флуконазолом детей с массой тела при рождении менее 1000 г или с гестационным возрастом ≤ 27 недель начиная с первого дня жизни в дозе 3 мг/кг 2 раза в неделю течение 6 недель (А).
Поддерживающая терапия
Контроль температуры тела, инфузионная терапия и нутритивная поддержка
Температуру тела следует поддерживать в диапазоне 36,5–37,5 ºC в течение всего времени (С).
При лечении большинства детей следует начинать с внутривенного введения жидкости в дозе 70–80 мл/кг/день на фоне пребывания в увлажненном инкубаторе, хотя некоторым очень глубоконедоношенным младенцам могут потребоваться более высокие дозы (D).
Инфузионная терапия должна подбираться индивидуально с учетом концентрации натрия в сыворотке крови и потери массы тела (D).
Потребление натрия в первые несколько дней жизни следует ограничивать и начинать его введение после начала диуреза под тщательным контролем водно-электролитного баланса (В).
Парентеральное питание следует начинать в первый день во избежание замедления роста и быстро увеличивать объем, начиная с 3,5 г/кг/день белка и 3,0 г/кг/день липидов по мере переносимости (С).
Минимальное энтеральное питание также следует начинать в первый день (В).
Контроль артериального давления, перфузии и ОАП
Лечение артериальной гипотензии рекомендуется в случае, когда имеется подтверждение в виде слабой перфузии тканей (С).
Концентрации гемоглобина должны поддерживаться в пределах нормального диапазона значений (D). Предполагаемое пороговое значение концентрации гемоглобина у новорожденных, находящихся на вспомогательном дыхании, составляет 120 г/л в 1-ю неделю, 110 г/л во 2-ю и 90 г/л в возрасте старше 2 недель после рождения.
В случае если принимается решение о попытке терапевтического закрытия ОАП, применение индометацина и ибупрофена обладает аналогичной эффективностью, однако при использовании ибупрофена получено меньше данных о развитии транзиторной почечной недостаточности и некротизирующего энтероколита (А).
Препараты, используемые для поддержки артериального давления у новорожденных детей, приведены в табл. 3.
Различные аспекты
При беременностях, сопровождающихся низким риском, плановое кесарево сечение не должно проводиться ранее чем в 39 недель беременности (В).
Ингаляционная терапия оксидом азота не обладает преимуществами при лечении недоношенных детей с РДС (А).
Терапия сурфактантом может применяться для улучшения оксигенации после легочного кровотечения, однако долгосрочные благоприятные эффекты отсутствуют (С).
Заместительная терапия сурфактантом при прогрессирующей БЛД приводит только к кратковременным благоприятным эффектам и не может быть рекомендована (С).
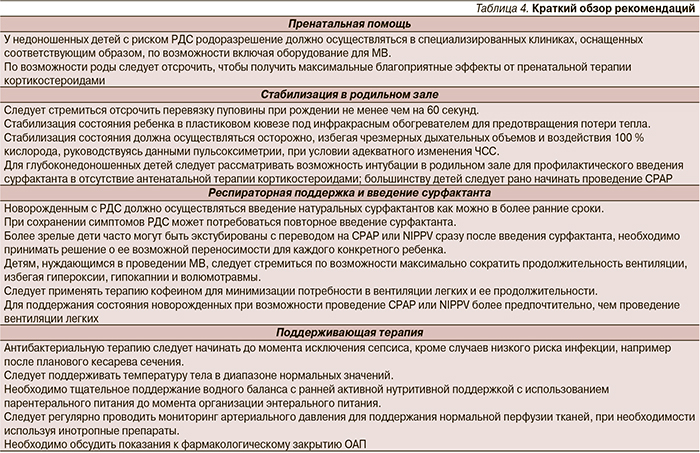
Рекомендации, посвященные основным положениям пренатальной помощи, стабилизации состояния в родильном зале, респираторной поддержке (искусственной вентиляции легких) и применению сурфактанта, а также поддерживающей терапии, суммированы в табл. 4. Эти рекомендации основаны на доказательствах, полученных в клинических исследованиях, систематических обзорах, а также на клиническом опыте по состоянию на конец 2012 г. Очередное обновление рекомендаций планируется через 3 года, т.е. в 2016 г.



