Введение
Псориатический артрит (ПсА) – гетерогенное и потенциально тяжелое ревматическое заболевание (РЗ), относящееся к группе серонегативных спондилоартритов, имеющее хронический системный и прогрессирующий характер, ассоциированный с псориазом. Распространенность ПсА колеблется от 0,6 до 1,0 % среди населения. Наиболее часто ПсА начинается в возрасте от 20 до 50 лет, при этом мужчины и женщины заболевают одинаково часто. В то же время по степени ухудшения качества жизни, стойкой утрате трудоспособности, тяжести течения и исходам заболевания ПсА не уступает ревматоидному артриту и анкилозирующему спондилоартриту. Уже в первые два года болезни у 47 % больных выявляются эрозии поверхностей суставов, при этом резко снижается уровень качества жизни больных, причиной чего являются суставной и кожный синдромы. Заболевание ПсА также сопряжено с повышением уровня смертности: на 59 % среди мужчин и на 65 % среди женщин, при этом основными причинами смерти служат сопутствующие ПсА метаболические нарушения, кардиоваскулярные заболевания, нефропатия с последующей хронической почечной недостаточностью, осложнения терапии (желудочные кровотечения, гепоцитопении, печеночная недостаточность) и злокачественные новообразования [1–3].
Анкилозирующий спондилоартрит (АС) – хроническое системное заболевание суставов с преимущественной локализацией процесса в крестцово-подвздошных сочленениях, суставах позвоночника и паравертебральных мягких тканях. Данная нозология характеризуется скачкообразным течением, при котором спонтанные ремиссии чередуются с обострениями. Первые симптомы АС малозаметны, выражаются частыми болями и скованностью в области таза и нижней части спины. Поздние же стадии АС могут сопровождаться замещением костной тканью межпозвонковых дисков, что приводит к фиксации позвоночника и значительно ограничивает подвижность пациентов [4].
Распространенность АС различается в зависимости от этнической группы и расы, в среднем данный показатель составляет 0,5 % (от 0,1 до 1,4 %) населения. Наиболее часто дебют заболевания отмечается в подростковом и юношеском возрасте, при этом мужчины болеют в 2–3 раза чаще женщин.
По эпидемиологическим данным, за 2011 г. в России были зарегистрированы 14 316 больных с впервые установленным диагнозом АС. При этом общее число больных этим заболеванием в том же году составило 79,58 тыс. человек [5–9].
 С учетом значительного влияния ПсА и АС на качество жизни больного можно сделать следующий вывод: данные заболевания затрагивают все сферы жизни – влияют на повседневную деятельность и возможности общения больного. ПсА и АС ложатся тяжелой экономической нагрузкой на систему национального здравоохранения. Расходы на каждого отдельного пациента на протяжении его жизни складываются в значительные экономические потери для общества в целом. Для борьбы с этими заболеваниями необходимо долгосрочное и дорогостоящее лечение. Ограниченность традиционных схем лечения ПсА и АС обусловливает острую необходимость в эффективном, безопасном и доступном лечении пациентов на острых стадиях заболевания. Наиболее значимые достижения в фармакотерапии РЗ связаны с внедрением в схемы лечения генно-инженерных биологических препаратов (ГИБП). Среди всех ГИБП, представленных на отечественном фармацевтическом рынке, только ингибиторы фактора некроза опухоли α (ФНО-α) обладают зарегистрированным показанием к применению при ПсА и АС. Данные препараты быстро подавляют симптомы воспаления и воздействуют на все основные проявления данных РЗ, обладая высокой терапевтической активностью как при краткосрочном, так и при длительном применении. Данная группа ГИБП способна прерывать или существенно замедлять рентгенологическое прогрессирование ПсА и АС. Данные о клинической эффективности и безопасности применения данной группы лекарственных средств (ЛС) показывают необходимость оценки возможности их применения с точки зрения фармакоэкономического анализа в условиях системы здравоохранения Российской Федерации.
С учетом значительного влияния ПсА и АС на качество жизни больного можно сделать следующий вывод: данные заболевания затрагивают все сферы жизни – влияют на повседневную деятельность и возможности общения больного. ПсА и АС ложатся тяжелой экономической нагрузкой на систему национального здравоохранения. Расходы на каждого отдельного пациента на протяжении его жизни складываются в значительные экономические потери для общества в целом. Для борьбы с этими заболеваниями необходимо долгосрочное и дорогостоящее лечение. Ограниченность традиционных схем лечения ПсА и АС обусловливает острую необходимость в эффективном, безопасном и доступном лечении пациентов на острых стадиях заболевания. Наиболее значимые достижения в фармакотерапии РЗ связаны с внедрением в схемы лечения генно-инженерных биологических препаратов (ГИБП). Среди всех ГИБП, представленных на отечественном фармацевтическом рынке, только ингибиторы фактора некроза опухоли α (ФНО-α) обладают зарегистрированным показанием к применению при ПсА и АС. Данные препараты быстро подавляют симптомы воспаления и воздействуют на все основные проявления данных РЗ, обладая высокой терапевтической активностью как при краткосрочном, так и при длительном применении. Данная группа ГИБП способна прерывать или существенно замедлять рентгенологическое прогрессирование ПсА и АС. Данные о клинической эффективности и безопасности применения данной группы лекарственных средств (ЛС) показывают необходимость оценки возможности их применения с точки зрения фармакоэкономического анализа в условиях системы здравоохранения Российской Федерации.
Результаты анализа эффективности
В соответствии с национальными рекомендациями по лечению РЗ лечение ПсА направлено в первую очередь на достижение ремиссии или минимальной активности заболевания, а также предупреждение рентгенологического прогрессирования болезни [10–12]. На данный момент в России среди ГИБП, применяемых в лечении ПсА, зарегистрированы только ингибиторы ФНО-α – адалимумаб, голимумаб, инфликсимаб и этанерцепт [13–22]. По данным мета-анализов, посвященных оценке клинической эффективности и безопасности применения ГИБП, а также в соответствии с рекомендациями EULAR (European League Against Rheumatism) ингибиторы ФНО-α обладают высокой эффективностью при лечении ПсА и не имеют значимых различий в эффективности и безопасности лечения данной нозологии [23–26].
В свою очередь целью лечения АС является улучшение качества жизни, выражающееся в купировании и уменьшении боли, скованности и утомляемости, улучшении функциональных возможностей, а также в предотвращении структурных повреждений. Как и при ПсА, в лечении АС разрешено применение следующих ингибиторов ФНО-α: адалимумаба, голимумаба, инфликсимаба и этанерцепта. По данным Положений о применении биологических препаратов в лечении РЗ, опубликованных в 2013 г., также нет значимого различия в эффективности и безопасности ГИБП, применяемых при лечении АС (по результатам 10 рандомизированных клинических исследований; уровень доказательности «А/В»). Отсутствие различий в клинической эффективности и безопасности ГИБП, применяемых в лечении ПсА и АС, также подтверждают данные мета-анализов рандомизированных плацебо-контролируемых клинических исследований [27–47].
Таким образом, в рамках данного фармакоэкономического исследования эффективность и безопасность изучаемых ГИБП были приняты равными, следовательно, согласно международным рекомендациям по проведению фармакоэкономических исследований, в качестве метода дальнейшего фармакоэкономического анализа был выбран метод «минимизация затрат», подразумевающий проведение сравнительной оценки двух и более лекарственных средств, характеризующихся идентичной эффективностью и безопасностью, но различной стоимостью применения.
Результаты анализа затрат
В ходе данного фармакоэкономического исследования были рассчитаны прямые медицинские затраты на лечение одного пациента, страдающего активным ПсА или АС, с массой тела 70 кг в течение 12 месяцев (отдельно для первого и последующих лет лечения), включающие:
- Стоимость биологической терапии активного ПсА или АС (ЛС этанерцепт, инфликсимаб, адалимумаб и голимумаб).
- Стоимость сопутствующих затрат на введение ЛС и визиты к врачу (изучаемые ГИБП различаются как по частоте, так и по способу введения).
- Стоимость эскалации дозы ГИБП на фоне выработки нейтрализующих антител к ЛС (для второго и последующих лет лечения).
Анализ стоимости ГИБП проводился на основании средней цены аукционов, состоявшихся в течение первых трех кварталов 2013 г., – база данных «Курсор»: торги по всей России (табл. 1). Источником данных о стоимости медицинских процедур служил прейскурант цен НИИ ревматологии РАМН от 01.09.2013.
На основании представленных выше данных о стоимости и режимах дозирования каждого из ГИБП, а также с учетом того факта, что данные ЛС не подлежат хранению и содержание ампул может быть использовано лишь для одной инъекции, была рассчитана стоимость разовой дозы ЛС (табл. 2).
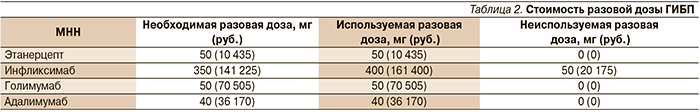
Как видно из данных, представленных в табл. 2, применение ГИБП инфликсимаб потребует использования бóльшей разовой дозы ЛС, чем необходимо пациенту, при этом неиспользованный остаток ЛС не подлежит хранению и должен быть утилизирован в соответствии с инструкцией по медицинскому применению.
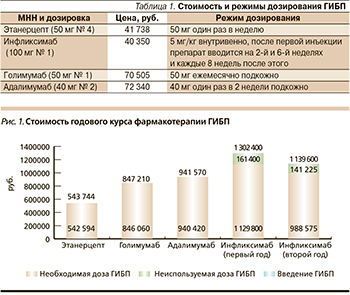
Далее в соответствии с инструкциями по медицинскому применению изучаемых ГИБП была рассчитана стоимость годового курса фармакотерапии, при этом учитывали, что на курс лечения ЛС этанерцепта будет израсходовано 13 упаковок препарата (52 инъекции), ЛС инфликсимаба – 32 упаковки (8 инъекций) на первом и 28 (7 инъекций) на втором году лечения, голимумаба – 12 (12 инъекций), адалимумаба – 13 упаковок (26 инъекций).
Результаты расчетов по оценке стоимости годового курса лечения представлены на рис. 1, из которого видно, что наименьшей стоимостью годового курса лечения ПсА и АС характеризуется ЛС этанерцепт с суммой затрат за годовой курс лечения, составившей 543 744 руб., из них 542 594 руб. составит стоимость необходимой дозы ГИБП и 1150 руб. – стоимость введения ЛС при первом посещении врача. Необходимо отметить, что в соответствии с инструкциями по медицинскому применению и в случае фармакотерапии ГИБП с подкожным путем введения инъекции ЛС могут проводиться пациентом самостоятельно или при помощи близких больного, в то время как инъекции ЛС инфликсимаб с внутривенным путем введения будут связаны с дополнительными издержками на визиты к врачу и проведение инъекций. Так, согласно прейскуранту цен НИИ ревматологии РАМН, стоимость подкожной инъекции составляет 150 руб., а стоимость внутривенной инъекции – 400, стоимость приема врача-ревматолога – 1000 руб.
Аналогичным образом сумма затрат на годовой курс лечения ГИБП голимумаб составит 847 210 руб., что включает 846 060 руб. – стоимость необходимой дозы ЛС и 1150 руб. – стоимость дополнительных издержек на подкожное введение ЛС. Стоимость годового курса лечения ГИБП адалимумаб, также вводимого подкожно, составит 941 570 руб. В свою очередь наибольшая стоимость годового курса лечения принадлежит ГИБП инфликсимабу – 1 302 400 руб. за первый год лечения, включая 1 129 800 руб. – стоимость необходимой дозы ЛС, 161 400 руб. (12,4 % от затрат на лечение) – стоимость неиспользованного ЛС и 11 200 руб. – внутривенное введение ЛС. В то же время в последующие годы лечения применение ЛС инфликсимаб потребует 1 139 600 руб., включая 988 575 руб. – стоимость необходимой дозы ГИБП, 141 225 руб. – стоимость утилизируемого ЛС и 9800 руб. – стоимость визитов к врачу и инъекций ЛС.
Анализ затрат на эскалацию дозы ГИБП
Согласно данным клинических исследований, изучаемые ГИБП обладают выраженными антигенными свойствами, что обусловливает образование в организме человека нейтрализующих антител, приводящих к снижению концентрации препарата в крови и как следствие – необходимости увеличения разовой дозы ЛС или его замены. В связи с вышесказанным в рамках данного фармакоэкономического исследования был проведен анализ дополнительных затрат, связанных с необходимостью эскалации дозы ГИБП для второго и последующих лет лечения ПсА и АС.
 В ходе информационного поиска данных о степени и частоте эскалации дозы ГИБП были обнаружены результаты клинических исследований M.K. DeVries (2009) и S. Arends (2010), продемонстрировавших отсутствие зависимости между уровнем нейтрализующих антител, влияющих на концентрацию ЛС этанерцепта в крови, и клиническим эффектом данной терапии больных АС. Авторы отмечают, что если у больных АС и отмечалась выработка антител к препарату этанерцепт, это не оказывало никакого влияния на эффективность лечения и не требовало коррекции дозы препарата. Таким образом, можно сделать вывод: терапия препаратом этанерцепт не связана с риском иммуногенности и последующими дополнительными издержками, вызванными эскалацией дозы ГИБП [48, 49].
В ходе информационного поиска данных о степени и частоте эскалации дозы ГИБП были обнаружены результаты клинических исследований M.K. DeVries (2009) и S. Arends (2010), продемонстрировавших отсутствие зависимости между уровнем нейтрализующих антител, влияющих на концентрацию ЛС этанерцепта в крови, и клиническим эффектом данной терапии больных АС. Авторы отмечают, что если у больных АС и отмечалась выработка антител к препарату этанерцепт, это не оказывало никакого влияния на эффективность лечения и не требовало коррекции дозы препарата. Таким образом, можно сделать вывод: терапия препаратом этанерцепт не связана с риском иммуногенности и последующими дополнительными издержками, вызванными эскалацией дозы ГИБП [48, 49].
Необходимость эскалации дозы ГИБП голимумаба была оценена в ходе двойного слепого плацебо-контролируемого клинического исследования пациентов с активным ПсА, проведенного A. Kavanaugh и соавт. (2009). Авторы сообщают, что из 146 пациентов, получавших ЛС голимумаб в дозе 50 мг раз в 4 недели, 28 (19,18 %) по причине снижения эффективности лечения были вынуждены перейти в группу лечения c увеличенной дозой ЛС – 100 мг раз в 4 недели [50].
Влияние выработки антител к ФНО-α у больных АС и ПсА, получавших ЛС инфликсимаб, было изучено в клиническом исследовании, включившем 94 пациента, которые проходили лечение с 1999 по 2010 г. По данным C. Plasencia, антитела к ЛС инфликсимаб были выявлены у 25,5 % пациентов, при этом у 18 (19 %) для достижения адекватного ответа на лечение на фоне выработки антител потребовалось сокращение интервала между введениями ЛС с 8 до 6–7 недель [51].
В то же время в ходе двойного слепого многоцентрового плацебо-контролируемого клинического исследования ATLAS, посвященного оценке эффективности и безопасности применения ГИБП адалимумаб пациентами с активным АС, установлено, что у 24 % из 125 пациентов, получавших ЛС адалимумаб в течение длительного времени, возникла необходимость в увеличение частоты дозирования ЛС до 40 мг один раз в неделю [52].
С учетом того что выработка нейтрализующих антител на фоне фармакотерапии ГИБП зависит лишь от иммуногенных свойств ЛС, можно предположить, что степень и частота эскалации дозы для данных препаратов при терапии АС и ПсА, когда ЛС применяются в режиме монотерапии (без добавления базисных противоревматических ЛС), не будут различаться. Таким образом, на основании представленных выше данных с учетом того, что схемы терапии для ПсА и АС идентичны, а их степень и частота эскалации дозы приняты одинаковыми, в дальнейшем расчеты для ПсА и АС также были одинаковыми.
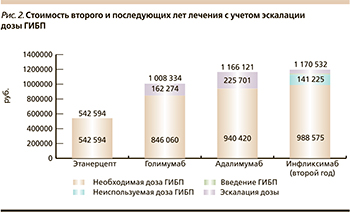
Как видно из данных, представленных на рис. 2, наименьшей суммой затрат за годовой курс лечения ГИБП для второго и последующих лет лечения также характеризуется ЛС этанерцепт (542 594 руб. в год), в то время как стоимость годового курса лечения ГИБП голимумабом составит 1 008 334 руб., включая 846 060 руб. – стоимость необходимой дозы ЛС и 162 274 руб. (16,1 %) – стоимость дополнительных издержек, связанных с необходимостью эскалации дозы ГИБП.
Стоимость годового курса лечения ЛС адалимумаб составит 1 166 121 руб., из них 225 701 (19,36 %) руб.– затраты на эскалацию дозы ГИБП.
В свою очередь наибольшей стоимостью второго года лечения будет характеризоваться ГИБП инфликсимаб: 1 170 532 руб., включая 988 575 руб. – стоимость необходимой дозы ЛС, 141 225 (12,1 % от затрат на лечение) руб. – стоимость неиспользованного ЛС, 30 666 (2,6 %) руб.– дополнительные затраты, связанные с эскалацией дозы ГИБП, и 10 066 руб. – внутривенное введение ЛС.
В итоге с учетом данных анализа эффективности, демонстрирующих отсутствие статистически значимых различий в эффективности и безопасности применения ГИБП при лечении ПсА и АС, наиболее предпочтительной альтернативой с точки зрения анализа «минимизация затрат» будет ЛС этанерцепт, т.к. данная фармакотерапия демонстрирует наименьшую стоимость лечения больных ПсА и АС как в первый, так и в последующие годы лечения.
Результаты анализа «упущенных возможностей»
Для оценки финансовых последствий применения сравниваемых ГИБП также был выбран метод фармакоэкономического анализа «упущенных возможностей», позволяющий оценивать дополнительные возможности в лечении ПсА и АС при переводе пациентов на наиболее предпочтительную с фармакоэкономической точки зрения схему лечения.
Расчет проводили по формуле: Q = CMR/DC2, где: Q – показатель упущенных возможностей; CMR – показатель разницы затрат; DC2 – прямые затраты при применении наиболее предпочтительной медицинской технологии.
Установлено, что внедрение в схемы лечения ПсА и АС ГИБП этанерцепт позволит в рамках того же бюджета системы здравоохранения дополнительно обеспечить в течение года на 85 % больше больных ПсА и АС по сравнению с ЛС голимумаб, на 114 % больше пациентов по сравнению с ЛС адалимумаб и на 115 % больше пациентов по сравнению с ЛС инфликсимаб без потери в эффективности проводимого лечения.
Выводы
Внедрение современных ГИБП в схемы лечения ПсА и АС позволяет существенно повышать эффективность проводимого лечения на тяжелых стадиях заболевания, однако их высокая стоимость создает барьер активному использованию данной терапии в нашей стране. С учетом данного факта актуальным становится поиск современных, эффективных и безопасных схем лечения ПсА и АС, применение которых будет наиболее оправданно с экономической точки зрения в условиях отечественной системы здравоохранения. Как видно из полученных нами результатов, использование ГИБП этанерцепт позволяет решать задачи по оптимизации медицинской помощи больным данной нозологией, значительно сокращает издержки системы здравоохранения по сравнению с другими ГИБП.
Так, применение ГИБП этанерцепт позволит сократить стоимость годового курса лечения каждого больного ПсА или АС в среднем на 303 466 руб. по сравнению с ЛС голимумаб, на 397 826 руб. по сравнению с ЛС адалимумаб и на 758 656 руб. по сравнению с ЛС инфликсимаб. Данная экономия бюджетных средств позволит значительно повысить число пациентов, обеспеченных необходимой им терапией ГИБП без выделения дополнительных ресурсов системы здравоохранения. Так, перевод 100 больных ПсА и АС на схему лечения, включающую ЛС этанерцепт, позволит дополнительно пролечить от 85 до 115 пациентов, страдающих данными нозологиями.



