Введение
Хроническая и рецидивирующая боль была определена как особая проблема здравоохранения и считается сама по себе болезнью [1]. В ХХI в. боль в спине заняла лидирующее место среди причин потери трудоспособности и экономических затрат (по таким показателям, как частота, распространенность и число лет, прожитых с нарушенным здоровьем), обогнав 300 других заболеваний в исследовании глобального бремени болезней в 188 странах мира с 1990 по 2013 г., тогда как еще 27 лет назад находилась на 105-м месте [2, 3].
Как известно, патологические изменения анатомических структур позвоночного столба и спины (надкостница, связки, мышцы, сухожилия, фасеточные суставы и др.) являются важными составляющими диагноза «дорсопатия» [4]. Таким образом, при дифференциальной диагностике различных дорсопатий специалисты должны учитывать различные этиологические факторы, такие как остеофитоз, фасеточный синдром (ФС), миофасциальный, или миотонический, синдром, поясничный стеноз, спондилолистез и др.
Эпидемиология
Обзоры указывают на то, что фасеточные суставы служат основным источником боли для 10–15% молодых взрослых пациентов с хронической болью в нижней части спины и гораздо чаще в более старших популяциях (15% среди лиц с травмами позвоночника, 40% в более старшей популяции без ранее существовавших травм, 45% в более гетерогенной популяции) [5].
Высокая распространенность остео-артрита фасеточных суставов была проиллюстрирована в многочисленных исследованиях [6–9], в то время как в асимптомной популяции дистрофические изменения фасеточных суставов выявляются в 8–12% случаев [10].
Среди лиц пожилого возраста заболеваемость ФС достигает 85–90% [11, 12]. При хронических болях в спине, согласно результатам исследований, поражение фасеточных суставов служит причиной болевого синдрома на поясничном уровне в 30–60% случаев, на шейном – в 49–60%, на грудном – в 42–48% случаев [13–15].
Анатомические предпосылки
Каждый сегмент позвоночника, за исключением сочленения CI–CII, состоит из межпозвонкового диска и тел позвонков, а также задних парных синовиальных суставов, составляющих «трехкомпонентный комплекс», где каждый компонент влияет на два других. Ориентация суставных полостей в шейном отделе приближается к горизонтальной плоскости, в грудном – к фронтальной и в поясничном отделе – к сагиттальной плоскости. Благодаря наличию фасеточных суставов между позвонками возможны разнообразные движения, а позвоночник является гибкой подвижной структурой [16–18].
Анатомическое строение позвоночного столба подчеркивает предназначение его передних отделов (передняя продольная связка, тела позвонков, межпозвоночные диски) главным образом для сопротивления силам тяжести (компрессии), а задних отделов (межпозвонковые суставы, ножки, поперечные и остистые отростки, пластинка) – для защиты от аксиальных ротаторных сил [12].
Распределение сил тяжести происходит следующим образом: от 70 до 88% приходится на передние отделы (позвоночный столб), от 12 до 30% – на задние – т.е. фасеточные суставы, которые состоят из верхней суставной фасетки нижнего позвонка и нижней фасеточной фаски верхнего позвонка. Это настоящий синовиальный сустав, способный хранить до 1,5 мл жидкости с определенными биомеханическими свойствами в зависимости от уровня позвоночника [16, 17, 19, 20].
Фасеточные суставы играют важную роль в передаче нагрузки, обеспечивая вспомогательный стабилизирующий сегмент движения при сгибании и разгибании. Они также участвуют в механизме вращательной кинематики путем ограничения осевого вращения [20, 22].
Фасеточные суставы имеют сложную и обширную ноцицептивную и проприоцептивную иннервацию: синувертебральный нерв Люшка отходит от вентрального спинномозгового нерва и волокон серых ветвей, затем возвращается к позвоночному каналу. Его ветви иннервируют не только фасеточные суставы, но и внешнюю часть фиброзного кольца, связок и др. N. Bogduk et al. были первыми, кто описал три разветвления дорсальной ветви (медиальной, промежуточной и латеральной) спинного нерва, которые распространяются в дорсальных мышцах. Фасеточный сустав иннервируется медиальной веточкой из дорсальной ветви [23].
Каждый сустав иннервируется из 2–3 сегментов спинного мозга, что обеспечивает «перекрытие» зон распространения боли. Такая перекрывающаяся иннервация фасеточных суставов затрудняет пациентам правильно описывать боли, а клиницистам выявлять симптомы при физикальном осмотре [24, 25].
Этиопатогенез
В 1911 г. J.E. Goldthwait признал важность фасеточных суставов как потенциальную причину боли в пояснице, подчеркнув, что асимметричная гипертрофия фасеточных суставов может вызывать сдавление нерва [26]. В 1937 г. R.K. Ghormley впервые использовал термин «фасетный синдром» [27]. Вскоре после этого C.E. Badgley et al. предположили, что фасеточные суставы служат источником до 80% болей в спине [28]. Многие авторы продемонстрировали патологические дегенеративные изменения, которым подвержены эти суставы с течением времени [29–32], а также воспалительные изменения, связанные с ними [33–35].
Безусловно, ФС как дегенеративная патология чаще наблюдается у пожилых пациентов, но может развиваться и у лиц молодого возраста, чему способствуют наследственная предрасположенность, врожденные аномалии, травмы позвоночника, гипермобильность позвоночно-двигательных сегментов (ПДС), избыточная масса тела. При травмах (по типу «хлыста», тракции, ротации) ФС может развиваться остро [36].
Наиболее распространенной причиной заболевания фасеточных суставов являются дегенеративные изменения позвоночника. При поражении дисков весовая нагрузка постепенно переходит на межпозвонковые суставы, достигая от 47 до 70%. Такая перегрузка суставов ведет к последовательным изменениям в них: синовиту с накоплением синовиальной жидкости между фасетками; эрозии суставного хряща; растягиванию капсулы суставов и подвывихам в них, периартикулярному фиброзу и остеофитозу. В конце концов фасеточные суставы резко дегенерируют, почти полностью теряют хрящ. Процесс может быть асимметричным, что усугубляет клиническую картину, а в сочетании с изменениями дисков приводит к резкому ограничению движений в соответствующем двигательном сегменте позвоночника [37, 12].
По мнению большинства авторов, термины «спондилоартроз» и «фасеточный синдром» – синонимы. Однако некоторые исследователи утверждают, что термин «спондилоартроз» имеет более общее значение, т.к. дегенеративный процесс, как правило, захватывает фасетки, капсулу межпозвонковых суставов, желтую связку и другие параартикулярные ткани. Термин «фасеточный синдром» подразумевает более конкретную клиническую симптоматику от определенного сустава [12].
В формировании ФС большую роль играет нарушение суставного тропизма, т.е. асимметричное расположение фасеточных суставов. Иногда фасеточный сустав, с одной стороны, располагается в сагиттальной плоскости, с другой – в коронарной. Такие аномалии тропизма считаются предрасполагающим фактором дополнительной ротационной нагрузки на них [11].
Дегенеративный спондилолистез – это смещение тела одного позвонка относительно другого в сагиттальной плоскости, которое в большинстве случаев связано с ФС. Это происходит в результате подвывиха фасеточного сустава, связанного с прогрессирующей потерей хряща и ремоделированием суставов, с сегментарной нестабильностью, вызывающей напряжение капсулы [38].
Когда же дегенерация фасеточных суставов вторична по отношению к естественному износу и неправильной механике тела, это состояние известно как остеоартрит. При локальном воспалении в фасеточном суставе и преобладании процессов деградации суставного хряща над его репарацией высвобождается масса специфических эндогенных молекул, которые ассоциируются с повреждением ткани (продукты деградации хряща, белки группы S100 и др.). Они активируют врожденную иммунную систему путем взаимодействия с паттерн-распознающими рецепторами (PRRs), специальными рецепторными белками, расположенными на поверхности клеток иммунной системы. Это поддерживает хроническое низкоактивное воспаление, которое протекает с дизрегуляцией и повышением продукции провоспалительных цитокинов клетками иммунной системы и др. Формируется порочный круг, поддерживающий хроническое низкоинтенсивное (lowgrade) воспаление, деструкцию кости и хряща в фасеточном суставе [39].
В патогенезе болевого синдрома при патологии фасеточных суставов выделены четыре механизма ирритации нервных окончаний в двигательном сегменте: 1) механический или дисфиксационный за счет смещения тел позвонков и суставных отростков по отношению друг к другу; 2) компрессионный – экзостозами, при ущемлении капсулы сустава, менискоидов или свободных хрящевых сегментов в суставе; 3) дисгемический за счет отека периартикулярных тканей, нарушения микроциркуляции, венозного стаза; 4) воспалительный за счет асептического (реактивного) воспаления в тканях двигательного сегмента [40].
В 1940-х гг. J. Kos и J. Wolf высказали предположение о функциональных блокированиях межпозвонковых суставов т.н. менискоидами. Эта теория пыталась объяснить положительный лечебный эффект манипуляций на позвоночнике, использующихся мануальными терапевтами, при болевом ФС [41]. Патогенез блокирования фасеточных суставов оказался более сложным. Его суть не только в механическом блокировании сустава позвоночника отекшей синовиальной оболочкой, но и в сопутствующих мышечных, сегментарных вегетативных и сосудистых реакциях, одной из важнейших среди них является воспалительная реакция синовиального выроста и его ущемление вследствие избыточного смещения в межпозвонковом суставе [42].
Наиболее часто спондилоартроз фасеточных суставов вследствие максимальных нагрузок развивается в поясничном отделе позвоночника – в ПДС L4–L5 и L5–S1. Дополнительным фактором развития спондилоартроза является слабость брюшной стенки, сопровождающаяся увеличением выраженности поясничного лордоза и компрессионной нагрузки на фасеточные суставы. Значительно реже поражение фасеточных суставов наблюдается в шейном (преимущественно на уровнях С2–С3 и С5–С6) и грудном отделах позвоночника. Для ФС характерны рецидивирующее течение, постепенное развитие и медленный регресс каждого болевого эпизода с тенденцией к удлинению и утяжелению каждого последующего обострения [43]. Во многом это связано с тем, что фасеточные суставы имеют общую иннервацию с другими структурами позвоночника [44].
Безусловно, как шлейф за ФС появляется мышечно-тонический синдром, что усиливает и изменяет болевой рисунок. Межпоперечные, меж-остистые и мышцы-вращатели позвоночника под влиянием импульсов из пораженного фасеточного сустава рефлекторно напрягаются, формируется мышечно-тонический синдром, а в случае асимметричного их вовлечения может формироваться сколиоз, а также резкое ограничение движений в соответствующем ПДС [11, 45, 46].
Клиническая картина
Клиническая оценка пациентов с подозрением на ФС основана на неспецифических тестах, таких как пальпация паравертебральных мышц, индукция вынужденных разгибаний и вращательных движений.
Клинически ФС характеризуется наличием боли в спине (шее, спине, пояснице), которая является преимущественно осевой. Боль максимальна по утрам, после пробуждения или в периоды бездействия. Характерно появление кратковременной утренней скованности, длящейся 30–60 минут, боль может нарастать к концу дня. Она может увеличиваться при экстен-зии позвоночника, осевой нагрузке, пальпации фасеточных суставов и вращательном движении туловища, а также от длительного стояния, разгибания, особенно если оно сочетается с наклоном или ротацией в больную сторону, при перемене положения тела из лежачего в сидячее, и наоборот. Разгрузка позвоночника – его легкое сгибание, принятие сидячего положения, использование опоры (стойка, перила) уменьшает боль [47, 48]. Воспроизведение боли возможно боковым вращением и разгибанием спины и еще рядом тестов, что должно наводить невролога на мысль о заболевании фасеточных суставов [47, 49].
Боль при поражении фасеток носит латерализованный, диффузный, трудно локализуемый характер. Она, как правило, умеренной интенсивности, описывается пациентами как «глубокая», «ноющая», «давящая», «скручивающая», «сжимающая» [50].
В шейном и грудном отделах боль может иррадиировать в плечо или быть паравертебральной. В поясничной области она может распространяться на нижние конечности, особенно на ягодицы, заднюю часть бедер, крестцово-подвздошную область, в область бедра (большой вертел) и паховую складку, может быть двух- и односторонней. Такая боль не иррадиирует ниже колена, т.н. короткая боль (рис. 1). Боль от фасеточных суставов верхне-поясничного уровня (L1–L2, L2–L3, L3–L4) может распространяться в область груди, боковой поверхности живота [20].
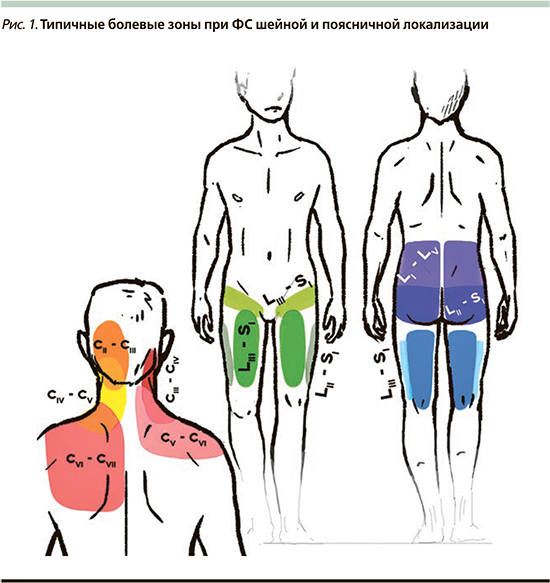
В неврологическом статусе могут обнаруживаться сглаженность шейного и/или поясничного лордоза, ротация, сколиоз и/или легкое искривление, или латеральное отклонение от оси туловища позвоночника в шейно-грудинном или пояснично-крестцовом отделах. При поясничной локализации на больной стороне выявляется напряжение паравертебральных мышц, квадратной мышцы спины, мышц подколенной ямки, ротаторов бедра; при вовлечении шейного отдела – болезненность задне-шейной группы мышц, трапециевидной мышцы.
Выявленная боль не несет паттерна невропатического болевого синдрома (ощущения «электрического тока», жжения, парестезии и др.), не сопровождается появлением симптомов натяжения (Ласега, Мацкевича, Вассермана), а также симптомов выпадения в двигательной, чувствительной и рефлекторной сферах [36]. Иногда в хронических случаях выявляется некоторая слабость выпрямителей позвоночника и мышц подколенной ямки. Таким образом, клинической особенностью, имеющей диагностическое значение, считается боль в позвоночнике, усиливающаяся при экстензии и ротации с локализованной болезненностью в проекции фасеточных суставов [36, 51].
При определении диагностической значимости различных тестов при патологии фасеточных суставов выявлено, что наиболее информативными были тесты Кемпа (сочетание экстензии, ротации и бокового сгибания, приводящее к повышенной нагрузке на фасеточные суставы) и Асеведо (стресс-тест для фасеточного сустава: у пациента, находящегося в положении лежа на спине, экзаменатор, подставив ладонь под пятку, поднимает вытянутую ногу вверх, просит противодействовать этому движению, а затем резко отпускает руку, что приводит к усилению боли), а также пальпаторный тест (усиление боли при давлении на фасеточный сустав) [49, 51].
В целом дифференциальная диагностика между фасеточной и невропатической болью приведена в табл. 1.

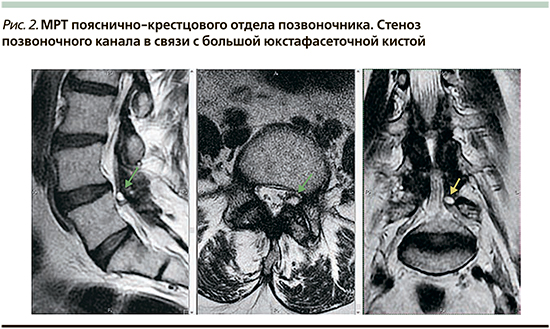
Однако нельзя забывать о таком осложнении, как дегенеративные кисты, возникающие из фасеточных суставов: юкстафасеточные кисты. Это синовиальные околосуставные кисты с мембраной, прикрепленной к капсуле сустава (рис. 2). Они содержат коллоидную жидкость или газ. Стенки состоят из рыхлой соединительной миксоидной ткани. Данные образования могут вызывать корешковый синдром, стеноз позвоночного канала и даже компрессию спинного мозга.
По данным R. Deyo (2001), самой частой причиной болей в спине (70%) является микротравматизация мышц [52]. Поэтому мы приводим в табл. 2 дифференциально-диагностические различия между мио- и артрогенной болью в области спины.
Диагностика
Общеизвестно, что магнитно-резонансная (МРТ) и компьютерная (КТ) томография являются наиболее адекватными диагностическими методами, позволяющими визуализировать структурное повреждение фасеточных суставов: показать дегенерацию, сужение суставного пространства, субхондральный склероз, эрозии и др. Однако эти изменения могут присутствовать и у бессимптомных пациентов. Данные показывают, что 89% пациентов в изученной популяции в возрасте от 60 до 69 лет имеют остеоартроз суставов, но опять же без корреляции между аномальной морфологией по рентгенологическим данным и болью в спине [53].
Изменения на КТ оценивают в соответствии с критериями, предложенными М. Pathria et al. (1987), и сходными критериями КТ, МРТ, предложенными D. Weishaupt et al. (1999).
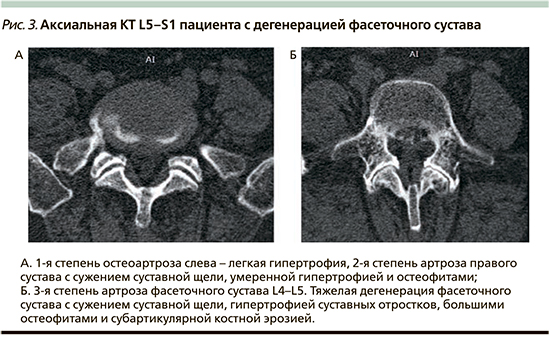
Выделяют четыре степени поражения (рис. 3) [54, 55]:
- • Степень 0, норма: однородный хрящ и нормальная (2–4 мм) ширина суставной щели.
- • Степень 1: легкие дегенеративные изменения – сужение суставной щели (менее 2 мм), и/или небольшие остеофиты, и/или незначительная гипертрофия суставного отростка.
- • Степень 2: умеренные дегенеративные изменения – сужение суставной щели (менее 1 мм) и/или умеренные остеофиты, и/или субхондральные эрозии.
- • Степень 3: тяжелые дегенеративные изменения – сильное сужение суставной щели, крупные остеофиты и субхондральные эрозии/кисты.
Введение гадолиния поможет установить диагноз синовита. A. Fujiwara et al. предложили классификацию от 1 до 4: 1-я степень – норма; 2-я – сужение суставного пространства или слабый остеофит; 3-я – склероз или умеренный остеофитоз; 4-я степень – выраженный остеофитоз. Важным наблюдением из исследования A. Fujiwara является то, что МРТ имеет тенденцию недооценивать тяжесть остеоартрита фасеточного сустава по сравнению с КТ [56].
Интерес к нейровизуализации часто заключается в ее способности исключать т.н. признаки красных флажков, а не доказывать симптоматическое состояние. Для врача крайне важно получить информацию о состояниях с потенциальной опасностью для жизни (подозрение на новообразования, инфекция, синдром конского хвоста, переломы) [57].
Диагностические блокады нервных структур, которые предположительно вызывают боль, могут быть выполнены для оценки роли структуры-мишени в болевом синдроме [58]. «Золотым» стандартом и единственным доказательным методом для подтверждения связи болевого синдрома с патологией фасеточных суставов является исчезновение (или значительное уменьшение) боли через несколько минут после проведения блокады анестетиком медиальной ветви задней первичной ветви спинномозгового нерва под визуализационным контролем. Положительный ответ на две диагностические блокады, выполненные в двух отдельных случаях на двух или более уровнях, может подтвердить источник боли. Но диагностические блокады медиальной ветви не являются широко используемым методом в рутинной клинической практике [59, 60].
Терапия
Терапевтические вмешательства включают консервативные методы и интервенционные, а иногда и хирургические вмешательства [61, 62].
Консервативное лечение включает медикаментозную терапию (неспеци-фические и специфические противовоспалительные препараты, миорелаксанты), иглорефлексотерапию, физиотерапию, массаж и психотерапию, также нельзя забывать о коррекции массы тела. Это методы лечения, используемые в сочетании друг с другом, в качестве полимодального подхода к лечению фасеточной боли. Когда консервативные меры терпят неудачу, считается, что интервенционные процедуры уменьшают боль, улучшают функциональность и уменьшают побочные эффекты от лекарств [63]. Высокую эффективность дают блокады фасеточных суставов глюкокортикостероидами (ГКС) [64].
Если у пациента есть положительный ответ на две диагностические блокады анестетиком, может быть выполнена радиочастотная аблация для удаления медиальной ветви нервов. Показано, что улучшение функции и уменьшение боли продолжаются от 6 до 12 месяцев после радиочастотной аблации поясничной медиальной ветви. Она проводится под местной анестезией и рентгеноскопическим контролем. Поскольку нервы в конечном итоге восстанавливаются, процедура повторяется, когда боль возвращается – обычно через 6–12 месяцев [65].
Кроме этого используются внутрисуставные инъекции, нейролитические методы, включая инъекцию нейролитических растворов, крионевролиз. Однако в литературе данные терапевтические вмешательства встречали и благосклонность, и скептицизм, и критику [62, 66–69].
L. Manchikanti et al. предоставили существенные доказательства диаг-ностической достоверности блокад нервов фасеточных суставов и умеренные доказательства терапевтической эффективности радиочастотной невротомии и терапевтических блокад нервов фасеточного сустава при лечении хронической боли в пояснице [70]. Однако до сих пор сохраняется спор относительно точности диагностики и терапевтической эффективности интервенционных методов [71, 61, 72].
Управление генерального инспектора Минздрава и социальных служб США провело оценку целесообразности инъекций фасеточных суставов, сделав вывод, согласно которому многие процедуры были неуместными, без медицинской необходимости и показаний [73].
Несмотря на это, настоящие данные показывают, что с 2000 по 2013 г. число вмешательств с использованием фасеточных суставов увеличилось на 293% на 100 тыс. человек в рамках Medicare с платой за услугу (FFS), при этом на 213% для вмешательств на поясничном суставе и на 522% для пояснично-крестцового невролиза фасеток. Аналогичным образом произошло увеличение числа шейных и грудных блокад фасеточного сустава на 350% и увеличение невролиза фасеток на 845% с 2000 по 2013 г. в популяции [72, 71].
В систематическом обзоре сравнительной эффективности различных растворов, в т.ч. местных анестетиков и ГКС. L. Manchikanti et al. показали одинаковую эффективность местного анестетика по сравнению со ГКС при длительном наблюдении за блоками нервов поясничного сустава. Внутрисуставные фасеточные инъекции в поясничный отдел не были признаны эффективными [74].
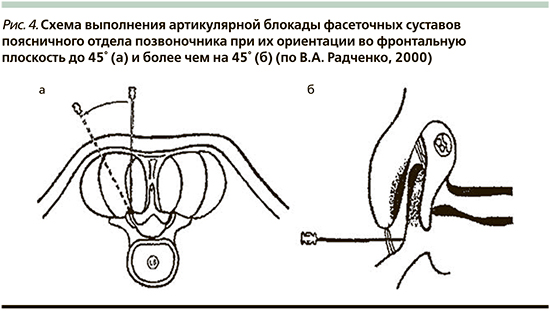
В ранее опубликованной нами монографии об инвазивных методах лечения в неврологии [89] мы приводили методику внутрисуставных блокад фасеточных суставов (по В.А. Радченко, 2000) [75]. Так, при ориентации во фронтальной плоскости до 45° (рис. 4а) сустав пунктируют следующим образом: иглу вкалывают на 1,5 поперечника пальца от линии остистых отростков, проводят до упора кончика иглы в костную ткань, после чего больного просят повернуться на угол, соответствующий ориентации суставной щели. В момент совпадения ее с направлением иглы последнюю проталкивают в полость сустава на 1–2 мм. Обычно после прокола кожи и фасции отмечается рефлекторное напряжение мышц, что приводит к изменению направления продвижения иглы. Для исключения этого необходимо выполнять тщательную инфильтрационную анестезию кожи и мышц по ходу иглы, вплоть до капсулы сустава.
При фронтальной ориентации суставных фасеток более чем на 45° сустав пунктируют в нижнем завороте (рис. 4б). Пункцию осуществляют в положении больного на боку или на животе со сгибательной установкой в поясничном отделе позвоночника. Иглу вводят, ориентируясь на нижний край остистого отростка, соответствующего уровню пунктируемого сустава, отступив латерально на 2–3 см и каудально на расстояние, предварительно измеренное на спондилограммах. Кончик иглы проводят в нижний заворот сустава до упора в хрящевую поверхность верхнего суставного отростка [75].
Однако для проведения таких блокад требуется визуализация (ультразвуковой контроль). Из-за видимой сложности данных процедур в нашей монографии мы предложили более легковыполнимый вариант – периартикулярные блокады межпозвонковых суставов. Техника выполнения проста. На 2 см латеральнее остистого отростка и выше его на ширину пальца перпендикулярно к поверхности кожи вводят иглу (глубина 5 см) и веерообразно инфильтрируют мягкие ткани. Обычно используются коктейли: ГКС+анестетик [76].
По нашим данным, подобные инвазивные методы максимально эффективны и достаточно безопасны при обострении ФС. Локальное поступление ГКС позволяет ограничить их побочные эффекты, а вкупе с анестетиками быстро дает обезболивание и улучшение всех клинических показателей [77, 78].
Эффективность мануальной терапии связана с ранним периодом развития ФС, поскольку на этой стадии болевой синдром связан с функциональными блоками фасеточных суставов, который может приводить к вторичному мышечному спазму. В 2005 г. понятие функционального блока (подвывиха) было определено Всемирной организацией здравоохранения как «повреждение или дисфункция в суставе или подвижном сегменте, в котором изменяются соосность, целостность движения и/или физиологические функции, хотя контакт между суставными поверхностями остается неизменным» [79]. Однако в стадиях выраженной дегенерации или воспаления мануальная терапия может приводить к обострению болевого синдрома при ФС.
В настоящее время большинство методов лечения болей в спине сосредоточено на уменьшении симптомов и функциональных нарушений, обусловленных хронической болью в спине. Согласно рекомендациям Британского общества боли (BPS guidelines – British Pain Society), важнейшей задачей лечения и главным критерием его эффективности является сохранение трудоспособности [79, 80]. Общие принципы терапии включают разъяснение пациенту доброкачественной природы заболевания и благоприятного прогноза, сохранение повседневной активности, краткое обучение проблеме хронической боли в спине, не рекомендован длительный постельный режим [79].
ФС – это хронический процесс, споспособный причинять боль до конца жизни человека. Дегенерация позвоночника и суставов обычно прогрессирует с возрастом пациента. Важно предотвратить прогрессирование дегенерации, поддерживая оптимальную массу тела и ведя активный образ жизни. С учетом ведущей патогенетической роли в развитии ФС дегенеративно-дистрофических процессов межпозвонковых суставов оправданно использование базисной структурно-модифицирующей терапии (хондроитина сульфат и глюкозамин – ХС и ГА) – препаратов, способствующих замедлению дегенерации хрящевой ткани. Применение хондропротекторов рекомендуется уже на ранних этапах развития данной патологии [11].
ГА и ХС служат естественным компонентом хрящевой ткани. ГА является аминомоносахаридом, в организме он используется хондроцитами как исходный материал для синтеза протеогликанов, гликозаминогликанов, в частности ХС и гиалуроновой кислоты. ХС — это ключевой компонент внеклеточного матрикса хрящевой ткани, ответственный за сохранение ее эластичности и сопротивление нагрузкам. Противовоспалительные свойства ХС хорошо исследованы [82], но о его влиянии на ангиогенез известно немного. ХС влияет на выработку синовиальными фибробластами про- и антиангиогенных факторов в пораженной остеоартрозом синовиальной мембране и способен восстанавливать баланс между ними. Так как в развитии остеоартроза одним из ключевых процессов является патологический ангиогенез, благотворное воздействие ХС может быть объяснено именно антиангиогенными свойствами этого вещества [83].
ГА является фундаментальным строительным блоком, необходимым для биосинтеза таких соединений, как гликолипиды, гликопротеины, гиалуронат и протеогликаны. ХС – важный класс гликозаминогликанов, необходимых для формирования протеогликанов суставного хряща [84].
ГА и ХС способны повышать синтез протеогликанов и коллагена, уменьшать активность лейкоцитарной эластазы, коллагеназы и аггреканазы, подавлять интерлейкин-1-стимулированный синтез простагландинов фибробластами [85–87]. В то же время имеются некоторые принципиальные различия, касающиеся в первую очередь воздействия на субхондральную кость и синовиальную оболочку. Считается, что способность нормализовывать костный обмен свойственна ХС, как и возможность мобилизации фибрина, липидов и депозитов холестерина в синовии и субхондральных кровеносных сосудах, а также уменьшения апоптоза хондроцитов [88]. Эти данные послужили предпосылкой к созданию комбинированных препаратов с целью потенцирования взаимодополняющего действия ХС и ГА.
По данным L. Lippielo et al. (1999), совместное применение ХС и ГА в эксперименте увеличило продукцию гликозаминогликанов хондроцитами на 96,6% по сравнению с 32% при монотерапии [89]. Использование в комбинированных препаратах вместо глюкозамин сульфата другой субстанции – глюкозамина гидрохлорида – связано с его более высокой стабильностью и биодоступностью [90].
Впервые применение хондропротекторов (ХС) при хронической болях в спине предпринято в исследовании K.D. Christensen, L.R. Bucci (1989), где была продемонстрирована их эффективность [91]. В дальнейшем последняя подтверждена и в других исследованиях [92–94].
Клинический случай
Пациентка С. 59 лет с хроническим болевым синдромом в области поясницы (продолжительность боли – 6 лет) обратилась с жалобами на усиление ежедневных болей в пояснице с иррадиацией в левый бок, пах, крестцово-подвздошную область и крыло левой подвздошной кости (визуальная аналоговая шкала – ВАШ 9 баллов). Боли возникали утром, усиливались при стоянии, разгибании позвоночника, вращательных движениях, при перемене положения тела из лежачего в сидячее, и наоборот, и к вечеру. Часто больная принимала разгрузочные позы, «встав к столу, опиралась на локти и переносила вес на руки». Она описывала боль как ноющую, сжимающую, иногда ломящую.
Со слов больной, 2 последних года принимает трамадол по 50 мг 2 раза в сутки (выписывает врач-родственница), 2 раза в год ходит на массаж. После последнего курса массажа возникло обострение болевого синдрома. Боли стали нетерпимыми, ухудшился сон.
1-й визит. В неврологическом статусе выявлена болезненность в области L2–S1, больше слева. Напряжение мышц-разгибателей поясницы слева до 2-й ст. по Попелянскому. Ограничен объем движений в поясничном отделе позвоночника на 1/3 (разгибание, латеральная флексия влево). Двигательных расстройств не выявлено. Тест Асеведо положителен слева. Положительна проба Кемпа при повороте влево.
Назначено: МРТ пояснично-крестцового отдела позвоночника, общий анализ крови, ревмопробы. Отменен трамадол. Рекомендовано диклофенак 3,0 мл внутримышечно 5 дней утром (+омепразол 20 мг 2 раза в сутки), лидокаиновый пластырь на поясничную область, амитриптилин 25 мг на ночь, ношение поддерживающего поясничного корсета при физической активности.
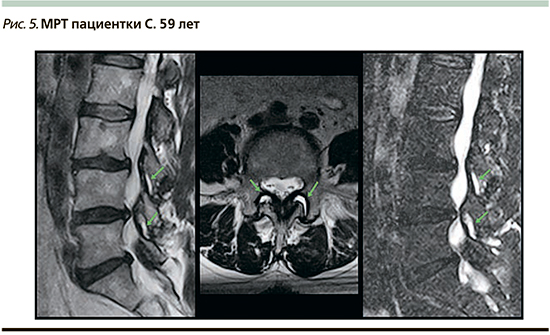
2-й визит (через 5 дней). Больная отметила улучшение. Болевой синдром уменьшился до 6 баллов по ВАШ. Значительно улучшился сон. На МРТ получены данные о дегенеративных изменениях пояснично-крестцового отдела позвоночника, сублигаментозных грыжах дисков L4–S1, протрузии диска L3–4, синовите дугоотросчатых сочленений с признаками деформирующего артроза на уровне L3–5 (рис. 5).
Ревматоидный фактор в норме, С-реактивный белок – 7 мг/л. По данным электронейромиографии нижних конечностей, имеются начальные признаки полиневропатии. После проверки аллергической пробы на лидокаин больной проведены две периартикулярные блокады: дексаметазон 0,5 мл+2% лидокаин – 2 мл на 1 блокаду по вышеизложенной технике на уровне L3–4, L4–5 слева и справа.
Назначено: остеоденситометрия, консультация ревматолога. Реко-мендовано: амитриптилин 25 мг на ночь продолжить, паноксен 1 таблетка по требованию (при сильной боли) после еды, пластырь Версатис по требованию, омепразол 20 мг на ночь, ХС+ГА (Артра) по 1 таблетке 2 раза в сутки в течение 3 недель, тейпирование пояснично-крестцового отдела позвоночника.
3-й визит (через 3 недели). Отмечает улучшение. Болевой синдром уменьшился до 3 баллов по ВАШ. Реко-мендовано отменить амитриптилин, ХС+ГА (Артра) по 1 таблетке 1 раз в сутки, 1 месяц, лечебная физкультура (по разработанной индивидуальной программе реабилитологом), ношение корсета при физической работе, требующей наклонов или ротаций поясничной области позвоночника.
4-й визит (через месяц). Отмечает улучшение. Болевой синдрому меньшился до 2 баллов по ВАШ. Реко-мендовано продолжить ХС+ГА (Артра) по 1 таблетке 1 раз в сутки 1 месяц, лечебная физкультура (по разработанной индивидуальной программе реабилитологом).
Заключение
Поскольку хроническая боль в спине представляет собой серьезную проблему здравоохранения, диагностика и лечение такого распространенного заболевания, как ФС, остаются серьезным социально-экономическим бременем. Данная патология, как известно, входит в понятие «неспецифические боли в спине».
Часто используемый в общемедицинской практике термин «неспецифические боли в спине» (или скелетно-мышечные боли), на которые приходится до 85–90% всех болевых синдромов в области спины, нередко не совсем ясно трактуется как врачами, так и пациентами, как бы исключая анатомический субстрат боли [95]. M. Hancock et al. (2011) обращают внимание на то, что в настоящее время имеется тенденция к недооценке анатомических факторов боли и возможной переоценке психосоциальных, что может быть связано с трудностью диагностики [96].
В ряде работ подчеркивается, что группа пациентов с неспецифическими болями в спине весьма неоднородна и больные нуждаются в дифференцированном лечении [79, 97, 98].
Поэтому считаем, что определение основного источника боли в спине становится принципиальной задачей для выбора последующей тактики лечения. Из-за способности патологии фасеточного сустава имитировать компрессию корешка позвоночника, невысокой специфичности и воспроизводимости клинических тестов [99], недостаточного использования МРТ-визуализации практикующими неврологами, ФС имеет определенные диагностические трудности и порой плохо диагностируется, что может приводить к неправильному лечению, например к применению жгучих мазей при воспалении фасеточных суставов или греющих процедур, что может вызывать обострение болевого синдрома. Связанные с фасеточным суставом анатомические, клинические и рентгенологические знания необходимы для успешного лечения ФС.



