Введение
Пустулезный псориаз (ПП) представляет собой гетерогенную группу нозологических форм, имеющих общие клинико-патологические признаки [1]. Для этих заболеваний характерно появление поверхностных стерильных пустул, обычно расположенных на эритематозном фоне. Гистопатологические признаки включают гиперкератоз, паракератоз, акантоз, диффузные дермальные мононуклеарные и нейтрофильные воспалительные инфильтраты, интраэпидермальные скопления нейтрофилов и расширенные извилистые сосуды в сосочковом слое дермы [2].
Сбор точных статистических данных о прогнозе и лечении данного заболевания затруднены из-за относительной редкости и разнообразия форм ПП. Однако недавние успехи в идентификации генетических мутаций и иммунологических механизмов привели к лучшему пониманию патогенеза ПП и дают хорошие перспективы для диагностики и лечения [3].
В течение длительного времени вопросы о классификации ПП оставались спорными.
Чтобы систематизировать вопросы о распространенности, заболеваемости, классификации ПП, начать беспристрастное совместное исследование клинического фенотипа и генотипа пациентов с данным заболеванием, основана европейская сеть экспертов по редкому и тяжелому псориазу (The European Rare and Severe Psoriasis Expert Network – ERASPEN) на грант APRC Европейской Ассоциации дерматологов и венерологов [4].
Согласно консенсусу ERASPEN, ПП подразделяется на три подтипа: генерализованный ПП, ладонно-подошвенный пустулез (ЛПП) и стойкий акродерматит Аллопо (АДА). Смешанные формы классифицируются по их прео-бладающим признакам [5, 6].
В настоящее время термин «ладонно-подошвенный ПП» считается устаревшим. Длительное время шли споры об общности и различиях таких понятий, как ладонно-подошвенный ПП, ладонно-подошвенный пустулез. Но в 2007 г. в ходе работы Международного консилиума по проблеме псориаза (The International Psoriasis Council) ладонно-подошвенный ПП был выделен в качестве самостоятельной нозологической единицы, для обозначения которой был предложен термин «ладонно-подошвенный пустулез» (palmoplantar pustulosis) [7, 8].
Также, согласно Международной статистической классификации болезней и проблем, связанных со здоровьем, ПП кодируется следующим образом: L40.1 – генерализованный пустулезный псориаз, L40.2 – акродерматит стойкий [Аллопо], L40.3 – пустулез ладонный и подошвенный [9].
Локализованные формы ПП наиболее распространены из трех архетипических форм, а именно чаще встречается ЛПП. Барбер из Института дерматологии Святого Иоанна в Лондоне подробно описал ряд пациентов. Он заметил, что вульгарный псориаз часто ассоциируется с ЛПП и может предшествовать ему, возраст пациентов в период манифестации заболевания варьировался от 7 до 74 лет, часто фиксировался отягощенный семейный анамнез по псориазу [10].
ЛПП поражает исключительно ладони и/или подошвы. Клинически это проявляется наличием стерильных пустул на фоне разлитой эритемы, гиперкератозом и шелушением [11]. Поражаются в основном кожа тенора, гипотенора и центральные области ладоней, аналогичным образом поражается кожа подошв [12, 13].
Однако ЛПП необходимо дифференцировать от АДА. Во-первых, ЛПП редко связан с травмой в анамнезе, тогда как АДА часто предшествует травма или локальная инфекция. Во-вторых, АДА проявляется в виде пустул под ногтевыми пластинами, в то время как ЛПП не обязательно поражает ногти. Если не отмечается поражение ногтевых пластин, то стоит рассматривать высыпания как ЛПП. В-третьих, АДА проявляется в виде одностороннего поражения небольшого количества пальцев, в то время как ЛПП обычно бывает двусторонним и симметричным. Наконец, без лечения АДА может приводить к осложнениям, включая ониходистрофию, анонихию, остеит, который может приводить к остеолизу дистальной фаланги. Таким образом, АДА может стать причиной инвалидности и негативно влиять на качество жизни пациентов [14].
Локализованные формы ПП чаще поражают женщин среднего возраста, особенно курящих [12, 15]. Изучена связь между курением и ПП [15]. Было продемонстрировано, что курение повышает уровень интерлейкина (IL)-17 [16, 17]. Более того, экспрессия ацетилхолинового рецептора α7nAChR в акросирингиуме может снижаться при курении с последующим нарушением активации эндогенного никотинового противовоспалительного пути [18]. И наоборот, отказ от курения может приводить к улучшению течения ПП [19].
Возможными сопутствующими заболеваниями ПП являются артроостит, метаболический синдром и заболевания щитовидной железы. В японской литературе сообщается, что примерно у 30% пациентов с ЛПП развиваются скелетно-мышечные нарушения. Наконец, ЛПП является частым признаком т.н. синдрома SAPHO, включающего синовит, акне, пустулез, гиперостоз, остит (от англ. synovitis/acne/pustulosis/hyperostosis/osteitis – SAPHO) [20, 21]. Локализованные формы ПП могут быть частью проявлений таких синдромов, как амикробный интертригинозный пустулез, бленноррагическая кератодермия.
В последние годы несколько исследований позволяют предполагать генетические причины развития ПП. Текущие данные показывают, что все три формы ПП ассоциированы с различными генетическими мутациями в генах IL36RN, CARD14, APS13 [22]. Патогенные варианты IL36RN выявлены примерно у 5% больных ПП [23], при этом гипоморфные варианты, по-видимому, относительно более распространены при локализованных формах ПП по сравнению с генерализованным ПП [24]. Мутации в гене IL36RN могут приводить к нерегулируемой секреция воспалительных цитокинов, и такие мутации были обнаружены в нескольких случаях семейного генерализованного ПП. Эта унаследованная форма теперь известна как «недостаточность антагониста рецептора интерлекина-36» (DITRA). Авторы этих работ предполагают, что такие генетические мутации также могут быть связаны с АДА [25].
Хотя патофизиология ПП остается неясной, в настоящее время широко признано, что роль эккринных потовых желез имеет решающее значение. В частности, акросирингиум (внутриэпидермальный спиральный выводной проток) служит основным местом воспаления и образования пустул [26]. Интересно, что увеличение числа клеток Лангерганса может быть обнаружено как в поврежденной, так и в неповрежденной коже пациентов с ЛПП, что указывает на процесс, управляемый антигеном [27]. Антимикробный пептид hCAP-18/LL37, по-видимому, действует как индуктор воспаления при ладонно-подошвенном ПП, повышая уровень провоспалительных цитокинов [28].
IL-17A активно экспрессируется в ладонях и подошвах пациентов с ладонно-подошвенным ПП в отличие от IL-12 и -23 [29].
Общеизвестно, что ладонно-подошвенный ПП трудно поддается терапии. Наиболее часто препаратами лечения остаются местные средства, в основном топические глюкокортикостероиды (ТГКС), которые считаются более эффективными при использовании под окклюзией. Также используются производные витамина D, местная ПУВА-терапия, фотодинамическая терапия и местные ингибиторы кальциневрина. Местное лечение часто не приводит к стойкой ремиссии, поэтому требуется системная терапия [30].
Успешное использование ингибиторов TNF-α или устекинумаба при ладонно-подошвенном ПП задокументировано в отчетах о клинических случаях и небольших исследованиях. Однако рандомизированное плацебо-контролируемое исследование не смогло продемонстрировать статистически значимую эффективность устекинумаба у пациентов с ладонно-подошвенным псориазом [11, 19].
Хорошие показатели эффективности в терапии ладонно-подошвенного ПП показал ингибитор IL-17А секукинумаб. 2PRECISE представляло собой многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3b с параллельными группами, в котором сравнивали секукинумаб в дозах 300 (n=79) и 150 мг (n=80) с плацебо (n=78) у лиц с умеренным и тяжелым ладонно-подошвенным ПП в течение 52 недель. Данные исследования 2PRECISE показали, что на 52-й неделе индекс площади и тяжести ладонно-подошвенного псориаза (PPPASI) снизился как минимум на 75% по сравнению с исходным уровнем (PPPASI-75) у 41,8% пациентов, получавших секукинумаб в дозе 300 мг/мес. [30].
Проблема подбора терапии ПП остается актуальной. В нашей практике мы имели возможность вести пациента с локализованной формой ПП подошв. Представляем клинический случай успешного применения ингибитора IL-17А нетакимаба (Эфлейра®) пациентом с ПП подошв. В данном случае препарат назначен после получения согласия пациента и врачебной комиссии.
Описание клинического случая
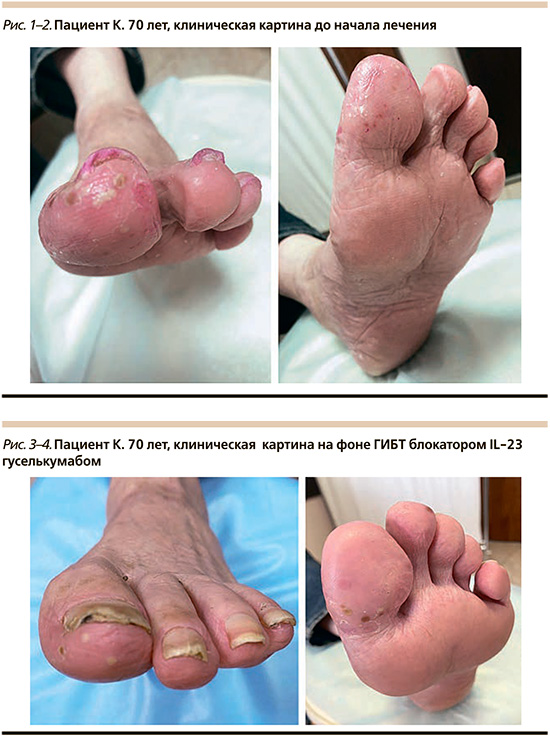
Пациент К. 70 лет обратился к врачу-дерматовенерологу отделения дерматовенерологии и косметологии Поликлиники № 1 УДП РФ в ноябре 2019 г. с жалобами на высыпания на коже стоп, которые беспокоили его в течение 1 месяца.
Отметил, что в сентябре 2018 г. проходил лечение с диагнозом «перелом наружной лодыжки, таранной, пяточной и кубовидной костей левой стопы»; со слов, травма бытовая: 12.09.2018 упал со стремянки. 18.09.2018 выполнена операция остеосинтеза перелома левой таранной кости титановыми канюлированными винтами.
На момент первичного осмотра дерматовенерологом выявлены следующие изменения: кожа стоп сухая с выраженным гиперкератозом, обильным мелкопластинчатым шелушением, гиперемирована. Кожа в области 1-го и 2-го пальцев левой стопы с множественными поверхностными сгруппированными пустулами до 0,2 см в диаметре, геморрагическими корками, обрывками эпидермиса, незначительно инфильтрирована. Ногтевые пластины стоп изменены по гипетрофическому типу желтого цвета, крошатся (рис. 1, 2). После проведенного клинико-лабораторного обследования: осмотр, БАК-посев содержимого пустул (из исследуемого материала патогенных и условно-патогенных микроорганизмов в диагностически значимых количествах не выделено), микологическое исследование соскоба с кожи стоп и ногтевых пластин стоп (отрицательно), установлен диагноз «ПП подошв». В последующем при повторном микологическом исследовании соскоба с ногтевых платин стоп был обнаружен мицелий гриба, установлен диагноз «онихомикоз стоп». В течение полугода пациент получал амбулаторное лечение наружными препаратами (ТГКС, ингибиторы кальциневрина, эмоленты) – без выраженного эффекта. Соматический статус: рост – 172 см, вес – 70 кг, индекс массы тела – 24 кг/м2.
Сопутствовавшие заболевания: ишемическая болезнь сердца. Стенокардия напряжения, I ФК. Кардиоангиография от 25.05.2015: в средней трети передней межжелудочковой ветви мышечный мостик, суживающий просвет в систолу на 90%.
Нарушение ритма сердца: рецидивирующие пароксизмы неустойчивой желудочковой тахикардии ускоренного желудочкового ритма, клинически и гемодинамически значимые; желудочковая экстрасистолия высоких степеней градации, включая ранние формы; частая суправентрикулярная экстрасистолия; однократно зарегистрированный эпизод атриовентрикулярной блокады II cт., 2-й тип с паузой 4,5 секунды в ночное время. Атеросклеротический стеноз нижней ветви левой почечной артерии – 95%. Оперативное лечение 04.12.2020: баллонная ангиопластика левой почечной артерии. Гипертоническая болезнь II ст. Артериальная гипертензия (контролируемая). Риск сердечно-сосудистых осложнений – 4 (очень высокий). Хроническая сердечная недостаточность – 0 ст. Сахарный диабет 2 типа. Целевой гликированный гемоглобин до 7,0% (достигнут).
Псориаз, псориатический артрит, демиелинизирующие заболевания в семейном анамнезе отрицает; неспе-цифический язвенный колит, болезнь Крона в личном и семейном анамнезе отрицает. Вредные привычки: куре-ние – 50 лет, пачка в день.
Базисная терапия: ренитек 5 мг 2 раза в сутки, отрио 10 мг в сутки, тулип 40 мг в сутки, кардиомагнил 75 мг в сутки, кальцемин адванс 500 мг в сутки, аквадетрим 3 капли в сутки, глюкофаж 500 мг в сутки.
С учетом тяжести заболевания, неэффективности наружного лечения пациенту показана системная терапия. После стандартного обследования (клинический анализ крови, общий анализ мочи, биохимический анализ крови – глюкоза, АЛТ, АСТ, ГГТ, щелочная фосфатаза, общий билирубин, общий холестерин и липидный профиль, мочевина, креатинин, С-реактивный белок, обследование на инфекции – ВИЧ, гепатиты В, С, сифилис, диаскин-тест, Rg органов грудной клетки, УЗИ органов малого таза и брюшной полости, консультация терапевта) решено начать противовоспалительную терапию метотрексатом, противопоказаний к которой выявлено не было.
С 05.08 по 26.11.2020 получал метотрексат с увеличением дозы (в связи с неэффективностью низких дозировок) от 5 мг до 17,5 мг в неделю без эффекта, на фоне лечения отмечено появление свежих высыпаний. На фоне приема метотрексата развились осложнения в виде кандидозного стоматита, получал системную и местную противогрибковую терапию с эффектом.
Согласно Федеральным клиническим рекомендациям по ведению больных с псориазом, при низкой эффективности и/или развитии осложнений на фоне базисной противовоспалительной терапии показана генно-инженерная биологическая терапия (ГИБТ). Принято решение о назначении терапии ингибитором IL-23 гуселькумабом (Тремфея). С 18.02 по 10.06.2021 пациент получил 3 инъекции гуселькумаба с интервалом 4 недели в дозировке 100 мг. Лечение переносил удовлетворительно, терапия с незначительным эффектом, с периодами обострения в виде появления свежих элементов, в связи с чем системная терапия была прекращена (рис. 3, 4).
В связи с отсутствием системного лечения в течение полугода у пациента наблюдалось выраженное ухудшение кожного процесса в виде появления новых субкорнеальных болезненных пустул, выраженной инфильтрации и гиперкератоза (рис. 5). С 16.12.2021 начат курс инициации ГИБП ингибитором IL-17А нетакимабом в дозировке 120 мг в виде подкожных инъекций по схеме: 0-я, 1-я, 2-я недели – инициирующий курс, начиная с 6-й недели – поддерживающая инъекция 1 раз в 4 недели.
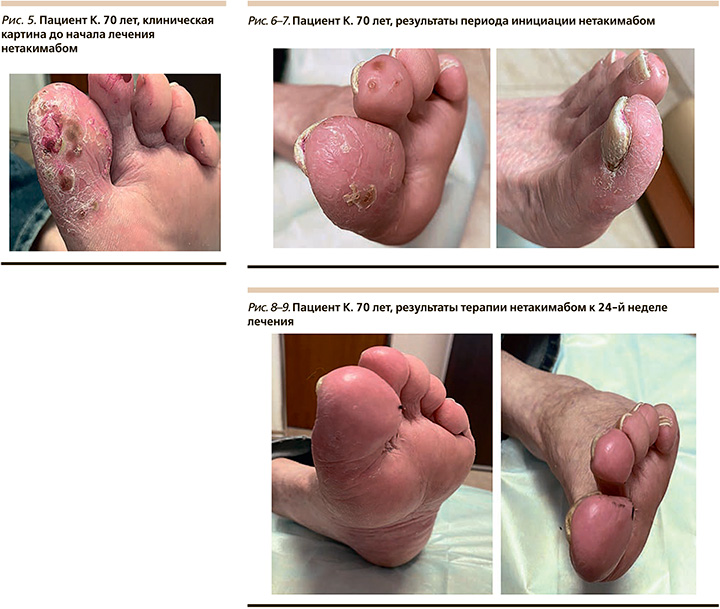
Отмечена удовлетворительная переносимость лечения нетакимабом, положительная динамика отмечена к концу инициирующего курса: достигнуто значение индекса PPPASI 90 (рис. 6, 7).
С 6-й недели пациент получает поддерживающие инъекции нетакимаба 1 раз в 4 недели. На 8-й неделе лечения достигнут результат «чистая кожа», полное очищение кожных покровов от псориатических высыпаний PPPASI100. Переносимость лечения хорошая, к 24-й неделе лечения (рис. 8, 9) изменений и осложнений со стороны лабораторных показателей, сердечно-сосудистой, дыхательной и выделительной систем нет. По настоящее время пациент продолжает лечение и находится в состоянии стойкой ремиссии.
Обсуждение
Пациент наблюдается с диагнозом «ПП псориаз подошв». Мы проводили дифференциальный диагноз в отношении клинической формы ПП, а именно ЛПП или АДА.
Клинические проявления и анамнез дают возможность предположить диагноз «стойкий АДА». «За» данную форму псориаза говорят следующие факты: предшествовшая травма (перелом костей левой стопы), наличие вредной привычки (курение), односторонний, несимметричный характер высыпаний, наличие стерильных пустул, расположенных на гиперемированном и инфильтрированном фоне с локализацией на коже акральных участков пальцев стоп, не распространяющихся на кожу подошвы и свода стопы, наличие единичных подногтевых пустул с дистального края в области 1-го пальца.
Своевременное начало системной терапии не дало развиться тяжелому поражению кожного покрова и осложнениям.
Заключение
Трудноподдающиеся лечению формы псориаза являются одной из актуальных проблем. Подробное изучение роли провоспалительных цитокинов в патогенезе ПП открывают новые терапевтические возможности. Большинство пациентов с ладонно-подошвенным ПП нуждаются в системной терапии, т.к. данное заболевание приводит к нарушению повседневного функционирования и социализации.



