Одним из частых последствий цереброваскулярных (острые нарушения мозгового кровообращения, хронические сосудистые заболевания головного мозга) и нейродегенеративных заболеваний (болезнь Альцгеймера – БА, деменция с тельцами Леви, лобно-височная дегенерация, болезнь Паркинсона, мультисистемная атрофия и др.) являются когнитивные нарушения (КН), которые проявляются снижением памяти, особенно на текущие события; нарушением внимания, его концентрации и способности быстрой ориентации в меняющейся обстановке; замедленностью мышления, быстрой истощаемостью при напряженной умственной работе; сужением круга интересов.
Выделяют три степени тяжести КН:
1. При легкой степени больные имеют минимальный когнитивный дефицит, что проявляется в снижении концентрации внимания, умственной работоспособности, запоминании нового материала. При этом больные полностью ориентированы, хорошо выполняют тесты, определяющие состояние оперативной памяти, контролируют свое поведение и эмоции.
2. При умеренной степени у больного отмечается снижение памяти и внимания средней степени, а также снижение контроля поведения и эмоций. В Международной классификации болезней 10-го пересмотра (МКБ-10) для диагностики синдрома умеренных когнитивных расстройств (УКР) предлагаются следующие критерии:
- наличие снижения памяти, внимания и/или способности к обучению;
- субъективные жалобы на повышенную утомляемость при умственной работе;
- отсутствие связи КН с помрачением сознания;
- отсутствие деменции;
- органическая природа когнитивных расстройств.
Таким образом, синдром УКР занимает как бы промежуточное место между изменениями когнитивных функций, обусловленными естественным старением, и деменцией. В большинстве случаев когнитивные изменения при синдроме УКР прогрессируют. В 55–65% случаев в течение 5 лет наблюдается трансформация УКР в клинически выраженную деменцию, преимущественно альцгеймеровского типа. Это диктует необходимость ранней диагностики синдрома УКР, что позволяет проводить своевременные профилактические мероприятия по предотвращению или замедлению социальной дезадаптации больных [1].
3. При выраженной степени КН (деменция) наблюдаются полимодальные нарушения памяти и интеллекта в сочетании с дезориентировкой и социальной дезадаптацией различной степени выраженности. Согласно МКБ-10, диагноз деменции ставят, когда:
- у больного развивается устойчивое снижение (по сравнению с прежним уровнем) мнестических и других когнитивных функций;
- в основе когнитивного дефицита лежит органическая патология головного мозга;
- КН определяются на фоне ясного сознания (нет делирия и других психических расстройств);
- КН сочетаются с изменениями в эмоциональной сфере или в поведении больного.
Частота встречаемости деменции нарастает по мере увеличения возра-ста: от 2–3% в популяции до 65 лет до 20–30% в возрасте 80 лет и старше [2]. Демографические прогнозы Организации объединенных наций установили, что в 2010 г. насчитывалось 35,6 млн человек, страдавших деменцией, из них 1,2 млн человек – в России. В связи с прогрессирующим постарением населения, согласно прогнозам, общее число больных деменцией будет удваиваться каждые 20 лет и составит 65,7 млн в 2030 г. и 115,4 млн в 2050 г. Негативные последствия деменции затрагивают не только пациента, но и членов его семьи, существенно влияя на их материальное положение, качество жизни и состояние здоровья.
Более 60–70% деменций пожилого возраста составляют атрофические деменции (БА, деменция с тельцами Леви, лобно-височная дегенерация).
Одной из ведущих причин развития КН является БА, которая относится к первичным атрофиям головного мозга и характеризуется прогрессирующим нарастанием КН. В настоящее время термином БА (или деменция альцгеймеровского типа) обозначается собственно БА (БА 2-го типа, пресенильная деменция, к которой относятся случаи с началом заболевания до 65 лет) и сенильная деменция (БА 1-го типа, к которой относятся случаи заболевания старше 65 лет). Их объединение в одну нозологическую форму связано со схожестью морфологической и клинической картины заболевания [3].
В патогенезе БА определенное значение имеет патология одного из нейрональных белков – таy-протеина. Предполагаемыми звеньями патогенеза БА являются:
- отложения амилоида в мозговых сосудах и паренхиме мозга;
- локальное иммунное воспаление;
- окислительный стресс;
- нестабильность клеточных мембран.
Ведущим биохимическим звеном развития КН при БА является ацетилхолинергический дефицит в гиппокампе, теменной и лобной коре, что связано с гибелью нейронов в базальных отделах головного мозга, прежде всего в базальном ядре Мейнерта, нейроны которого продуцируют ацетилхолин.
Морфологическая картина БА представлена следующими изменениями [4, 3]:
- атрофией мозга вследствие гибели нейронов – в первую очередь страдают медиобазальные отделы височной доли, в дальнейшем атрофия распространяется на височно-теменную, а затем на лобную кору;
- сенильными бляшками (отложениями амилоида в тканях мозга и сосудах);
- нейрофибриллярными сплетениями («клубочками»).
Для развернутой клинической картины БА характерно [3–6]:
- Наличие деменции (или выраженных когнитивных расстройств в додементной стадии заболевания).
- Развитие множественного когнитивного дефицита, центральным ядром которого является прогрессирующее снижение памяти.
- Нарушение других высших функций:
- афазия – первоначально возникают симптомы амнестической афазии;
- оптико-пространственная агнозия;
- апраксия.
- Сохранность на ранних этапах «ядра» («фасада») личности.
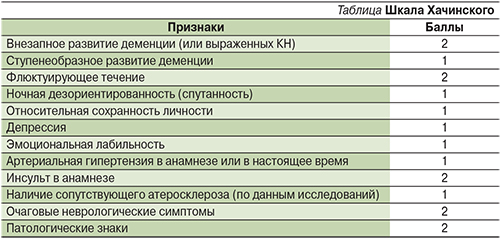
Для проведения дифференциального диагноза между сосудистой деменцией (или выраженными когнитивными расстройствами сосудистого генеза) и первичными атрофиями головного мозга можно использовать ишемическую шкалу Хачинского (см. таблицу) [7]. Особенно она удобна при первом осмотре больного на амбулаторном приеме до проведения подробного психологического и нейровизуализационного (компьютерная – КТ или магнитно-резонансная – МРТ-томография).
Сумма баллов более 7 трактуется в пользу сосудистого генеза деменции, а 4 и менее баллов – в пользу атрофического процесса.
Определенную помощь в дифференциальном диагнозе может принести КТ- или МРТ-исследование.
При БА наблюдается:
- уменьшение объема гиппокампа и расширение височного рога боковых желудочков;
- диффузная церебральная атрофия; но при БА более выражено расширение субарахноидальных пространств полушарий (за счет корковой атрофии), а при дисциркуляторной энцефалопатии больше выражено расширение желудочков мозга (за счет гибели преимущественно белого вещества);
- при БА перивентрикулярный лейкоареоз часто отсутствует (наблюдается только у 20–35% пациентов при КТ-исследовании, у 20–70% – при МРТ) или выражен нерезко, наблюдаются лишь единичные мелкие очаги в белом веществе полушарий мозга, в то время как для гипертонической энцефалопатии характерны выраженный и распространенный лейкоареоз и множественные мелкие очаги.
Более информативна при БА позитронно-эмиссионная томография (ПЭТ), при которой выявляется гипометаболизм глюкозы преимущественно в височно-теменных отделах головного мозга. Применяют также нейрохимическое исследование ликвора, где определяется снижение содержания амилоидного белка и повышение уровня тау-протеина [8].
Сосудистые заболевания головного мозга являются второй по частоте (после БА) причиной деменции. Средний возраст больных сосудистой деменцией несколько меньше возраста пациентов с БА, а продолжительность заболевания с момента постановки диагноза и до наступления летального исхода составляет около 5–7 лет. Сосудистая деменция встречается чаще у мужчин, чем у женщин.
Диагноз сосудистой деменции включает наличие трех критериев:
- деменции;
- цереброваскулярного заболевания (диагностируется при наличии очаговой неврологической симптоматики и признаков цереброваскулярного заболевания, выявленного при нейровизуализации, – КТ/МТР;
- связи первого и второго критериев.
Выделяют следующие типы сосудистой деменции:
- деменция с острым началом;
- мультиинфарктная и субкортикальная;
- смешанная кортикальная и субкортикальная.
Деменция с острым началом возникает в течение 1-го месяца (но не более 3 месяцев) после инсульта, как правило ишемического, реже ее причиной может быть массивное кровоизлияние. Причиной выраженных КН и даже деменции могут быть единичные, относительно небольшие инфаркты, расположенные в функционально значимых зонах: передне-медиальных отделах зрительного бугра и близких к нему областях лобных долях, теменно-височно-затылочных областях мозга, медиобазальных отделах височной доли, бледных шарах [9–14]. Деменция, обусловленная инфарктами в функционально значимых зонах мозга, с течением времени не нара-стает, а даже уменьшается.
Для мультиинфарктной деменции характерно снижение когнитивных функций, обусловленное множественными, большими по размеру инфарктами с локализацией в коре и субкортикальном веществе головного мозга в результате тромбоза церебральных артерий достаточно крупного размера. Деменция в этих случаях развивается остро или нарастает ступенеобразно, а основной причиной ее развития считается утрата значительного объема вещества головного мозга.
У пациентов с субкортикальным типом сосудистой деменции, как правило, имеются артериальная гипертензия (АГ) и признаки сосудистого поражения глубинных отделов белого вещества полушарий головного мозга с сохранностью коры. Инфаркты в основном располагаются субкортикально. Клинически субкортикальный тип сосудистой деменции характеризуется наличием двусторонней пирамидной симптоматики, могут выявляться изолированные гемипарезы, нарушения ходьбы (апраксия ходьбы), нарушение функции тазовых органов (недержание мочи), псевдобульбарные расстройства, аспонтанность, снижение мотивации. КН нарастают постепенно и характеризуются прежде всего замедленностью психических процессов, выраженным нарушением внимания.
При преимущественном поражении коры наряду со снижением памяти и интеллекта наблюдаются отдельные очаговые симптомы поражения высших корковых функций: элементы афазии, аграфии, акалькулии, апраксии.
Смешанная кортикальная и субкортикальная деменции характеризуются сочетанием признаков корковой и подкорковой деменции.
Частота деменций у больных после инсульта составляет 26%, причем с возрастом она имеет тенденцию к увеличению [15]. У больных старше 60 лет риск возникновения деменции в первые 3 месяца после инсульта в 9 раз выше, чем у лиц без инсульта [16].
КН, выявляющиеся в связи с перенесенным инсультом, могут возникать в разные периоды времени: сразу после инсульта (острые КН) и в более отдаленном периоде (отставленные постинсультные КН). Они могут быть обусловлены параллельно протекающим нейродегенеративным (чаще альцгеймеровским) процессом, активирующимся в связи с нарастающими ишемией и гипоксией, а также с постинсультными патологическими нейропластическими процессами. Для определения роли инсульта в развитии КН кроме их оценки необходимо уточнять их состояние до инсульта. Постинсультные КН ухудшают прогноз, повышают смертность [17, 18] и риск повторного инсульта в 3 раза, а также повышают выраженность функциональных нарушений после инсульта, значительно затрудняют реабилитацию.
КН могут быть одним из проявлений хронических сосудистых заболеваний головного мозга, больше известных в нашей стране как дисциркуляторные энцефалопатии. Из всех вариантов хронических сосудистых заболеваний головного мозга КН чаще встречаются при субкортикальной артериосклеротической энцефалопатии, гипертонической мультиинфарктной энцефалопатии и атеросклеротической энцефалопатии.
Основной причиной развития субкортикальной артериосклеротической энцефалопатии (болезнь Бинсвангера) является АГ. При суточном мониторировании артериального давления (АД) у таких больных выявляется недостаточное или резкое снижение ночного АД, повышение ночного АД. На ранних стадиях субкортикальной артериосклеротической энцефалопатии снижение когнитивных функций характеризуется замедлением психических процессов, снижением оперативной памяти, ослаблением внимания. Больным становится трудно осмыслить большое количество информации, что приводит лиц, занятых умственным трудом, к определенному снижению трудоспособности. Для нарушения когнитивных функций при субкортикальной артериосклеротической энцефалопатии характерен т.н. подкорковый тип когнитивной дисфункции [19], характеризующийся:
- снижением внимания;
- снижением психической активности;
- замедлением всех психических процессов;
- флуктуативностью КН;
- относительной сохранностью профессиональных возможностей и полной самостоятельностью в быту.
Исходом прогрессирования КН является деменция. При субкортикальной артериосклеротической энцефалопатии в большинстве случаев ведущим является субкортикальное поражение лобных долей, приводящее к когнитивному дефициту.
Мультиинфарктная гипертоническая энцефалопатия отличается от субкортикальной артериосклеротической энцефалопатии тем, что в морфологической картине заболевания преобладает мультиинфарктное состояние – развитие множества мелких глубинных лакунарных инфарктов в белом веществе полушарий мозга, подкорковых узлах, зрительном бугре, основании моста мозга, мозжечке. Клиническая картина характеризуется острым или ступенеобразным развитием КН. Развитие и выраженность КН в значительной степени связаны с месторасположением инфаркта в функционально значимых областях головного мозга. Так, при поражении таламуса у больного будут наблюдаться нарушения памяти, нарушения динамики психических процессов и их замедленность, нарушение программирования деятельности, апатико-абулический («лобный») синдром.
Основными факторами риска развития атеросклеротической энцефалопатии является множественный атеросклеротический стеноз магистральных артерий головы, сочетающийся с изменениями реологических свойств крови. При атеросклеротической энцефалопатии встречаются разные типы развития КН:
- острое – при локализации очагов в стратегически значимой зоне;
- ступенеобразное нарастание;
- флуктуирующее течение (периоды ухудшения и периоды улучшения).
Основной причиной возникновения и развития при атеросклеротической энцефалопатии КН являются множественные инфаркты. Чаще они наблюдаются в коре («корковый» тип КН), реже – в подкорковой области («подкорковый» тип КН).
Схематично патофизиологическую последовательность развития сосудистых когнитивных расстройств можно представить в следующем виде. Патология крупных и мелких артерий мозга вследствие различных заболеваний (АГ, атеросклероза, сахарного диабета) вызывает хроническую ишемию и/или острые нарушения мозгового кровообращения с повреждением функционально значимых зон коры мозга, подкоркового белого вещества, базальных ганглиев, мозгового ствола и развитием легких и умеренных КН. Нарастание тяжести цереброваскулярных нарушений приводит к дополнительному функционально значимому повреждению нейротрансмиттерных систем. Значительное повреждение вещества мозга и нейротрансмиттерной регуляции снижает когнитивные возможности до качественно иного уровня – деменции. Исследование посмертно взятой ткани мозга подтвердило роль холинергического дефицита у больных сосудистой деменцией, включая сниженную холинэстеразную активность в коре головного мозга, гиппокампе и стриатуме [20]. Сниженный уровень ацетилхолина в спинномозговой жидкости при сосудистой деменции и корреляция степени его снижения с глубиной деменции у больных также подтверждают заинтересованность обмена центрального ацетилхолина в развитии сосудистой деменции.
Жалобы на снижение памяти являются основанием для проведения исследования когнитивных функций. Для экспресс-диагностики, особенно в амбулаторной практике, наиболее пригодны скрининговые нейропсихологические шкалы: MOCAтест (Montreal Cognitive Assessment), Mini-Cog, MMSE (Mini-Mental State Examination). Для объективизации когнитивного статуса больной обязательно направляется на консультацию к нейропсихологу.
Тщательно собранный анамнез (с обязательным опросом родных и близких больного) позволяет исключить ряд заболеваний, которые могут сопровождаться снижением памяти (например, токсические и дисметаболические нарушения, травмы головного мозга и т.д.).
Всем пациентам с нарушением памяти обязательно проведение нейровизуализации (КТ/МРТ головного мозга), прежде всего для исключения объемных образований головного мозга, нормотензивной гидроцефалии, выявления сосудистых изменений или признаков дегенеративных заболеваний [21].
Основные принципы коррекции КН можно свести к следующим положениям [5]:
- этиопатогенетическая терапия;
- коррекция сопутствующих заболеваний;
- когнитивный тренинг;
- базисная терапия КН.
Этиопатогенетическая терапия направлена на основной патологический процесс, вызывающий КН: необходима адекватная коррекция АГ, гиперлипидемии, прием антиагрегантов/антикоагулянтов, антиоксидантов и т.д.
Коррекция сопутствующих заболеваний и дополнительных факторов, усугубляющих КН (коррекция сердечной и дыхательной недостаточности, отмена препаратов с холинолитическим действием, коррекция депрессии, коррекция эндокринных нарушений и т.д.).
Проведение длительных курсов коррекционных занятий с нейропсихологом. Целью нейропсихологических занятий является выявление центрального дефекта в структуре нарушений высших психических функций, организация деятельности пациента по преодолению выявленных нарушений с опорой на сохранные функции.
Выбор препаратов, улучшающих когнитивные функции. К таким препаратам относят лекарственные средства, действующие на процессы синаптической передачи: ингибиторы ацетилхолинэстеразы (донепезил, галантамин, ривастигмин, ипидакрин) и мемантин. При легкой и умеренной деменции препаратом выбора является мемантин, который может использоваться как в виде монотерапии, так и в комбинации с ингибиторами ацетилхолинэстеразы.
Мемантин – неконкурентный антагонист NMDA-рецепторов (рецепторы N-метил-D-аспартата), регулирует ионный транспорт (способствует поступлению ионов кальция и натрия внутрь клетки), нормализует мембранный потенциал нейрона, стимулирует передачу нервных импульсов, улучшает когнитивные функции, способность к обучению, повышает активность больных. Плацебо-контролируемое исследование мемантина на 166 пациентах с БА и выраженными КН показало достоверное уменьшение выраженности КН, поведенческих расстройств, улучшение адаптации [23]. В основе положительного эффекта мемантина как при БА, так и при сосудистых заболеваниях головного мозга лежит общая для этих двух заболеваний хроническая гиперактивация глутаматергической нейротрансмиссии, приводящая к нейронной дисфункции, а в дальнейшем и к гибели клетки [24]. Мемантин способен снижать активность глутаматных рецепторов, что приводит к уменьшению скорости развития нейродегенерации.
В Российской Федерации проводилось многоцентровое региональное исследование, в котором принимали участие 240 пациентов, средний возраст составил 69,5±5,5 года, с умеренными КН или легкой деменцией (148 пациентов получали 20 мг мемантина в течение 6 месяцев, группу контроля составили 92 пациента, не получавших лечение мемантином). На фоне лечения выявлено уменьшение выраженности КН (прежде всего достоверное увеличение числа запоминаемых слов, воспроизведение большего количества слов в условиях интерференции, увеличение беглости речи, нарастание уровня внимания и уменьшение зрительно-пространственных расстройств) [25].
Плацебо-контролируемые исследования эффективности мемантина показали, что мемантин не только улучшает когнитивные функции, но и нормализует поведение больных, уменьшает психические расстройства [23, 26]. Положительный эффект мемантина в отношении поведенческих расстройств при деменции связывают с коррекцией нарушений глутаматергической нейротрансмиссии в лобных долях и поясной извилине [27]. Исследования B. Reisberg (2003) показали, что к концу 6-го месяца применения мемантина только 1 пациент был направлен в спецучреждение по уходу, в то время как в группе плацебо таких пациентов было в 5 раз больше. Е.Б. Любов и соавт. (2010) в своих исследованиях показали, что доля госпитализированных пациентов, получавших мемантин, снизилась с 51,2 до 36%. Все эти исследования свидетельствуют: раннее назначение антидементных средств не только стабилизирует состояние когнитивных функций и поведение пациентов, но и препятствует их преждевременному интеллектуальному угасанию.
Применяют мемантин по следующей схеме: по 5 мг ежедневно в 1-ю неделю, по 10 мг – во 2-ю, 15 мг – в 3-ю, а затем в течение нескольких месяцев (а в большинстве случаев – пожизненно) по 20 мг/сут. Многоцентровое рандомизированное контролируемое исследование показало, что более предпочтителен однократный прием 20 мг мемантина, т.к. это улучшает переносимость препарата, создавая лишь одну пиковую концентрацию препарата в день. Кроме того, это удобно пациенту, его родственникам, а также лицам, которые ухаживают за больным.
Проводимые исследования подтвердили хорошую переносимость мемантина. Лишь в период титрации авторы отмечают возможность появления преходящих головокружений, сонливости, головной боли, падений [29]. Длительность терапии мемантином до настоящего времени не определена. Как показывают результаты большинства исследований, отмена препарата по той или иной причине (в частности, из-за его высокой стоимости) приводит к ухудшению состояния пациентов (как ухудшаются когнитивные функции, так и нарастают и поведенческие симптомы) [30].



