В течение последнего десятилетия отмечается неуклонный рост частоты поражения головного мозга (ГМ) при различных онкологических заболеваниях. Согласно результатам эпидемиологических исследований, данный показатель увеличился с 8,3 до 54,9 на 100 тыс. населения [1]. Причина этого феномена кроется как в больших возможностях методов нейровизуализации, так и в увеличении общей продолжительности жизни пациентов, связанном с успехом в основном химиотерапии (ХТ). Пациенты стали “доживать” до метастазов в ГМ. В настоящее время метастатическое поражение ГМ, как правило, рассматривают как отдельную проблему независимо от первичной опухоли. Несомненно такой подход имеет право на существование. Использование хирургических и лучевых методов в большинстве случаев метастатического поражения ГМ мало зависит от типа первичной опухоли. Вместе с тем очевидно, что непосредственные результаты лечения метастазов в ГМ при таких радиорезистентных опухолях, как меланома и рак почки, будут значительно отличаться от таковых при мелкоклеточном раке легкого. Представляется логичным использование схем терапии, в подавляющем большинстве случаев эффективных при данном конкретном варианте первичной опухоли. При выборе препаратов необходимо учитывать и их способность проникать через гематоэнцефалический барьер (ГЭБ).
Рак легкого относится к числу самых распространенных опухолей человека, а по частоте возникновения метастазов в ГМ занимает первое место (19,9 %) среди всех злокачественных новообразований [2], причем у 50 % больных диагностируют множественные очаги [3]. И если подходы к терапии метастатического поражения ГМ при мелкоклеточном раке легкого в целом отработаны, то при немелкоклеточном раке легкого (НМРЛ) стандарты лечения еще только формируются.
НМРЛ является умеренно чувствительной к лучевой терапии (ЛТ) и ХТ опухолью. Исходя из этого положения, при наличии одиночных метастазов в ГМ и в отсутствие данных о прогрессировании первичной опухоли предполагается выполнение хирургического пособия, в отдельных случаях возможно выполнение и симультанных операций. Однако даже в случае радикального удаления метастазов больным показано проведение послеоперационной ЛТ [4, 5]. Эффективность хирургического лечения одиночных метастазов при НМРЛ по сравнению с ЛТ или комбинированной терапией до конца не ясна. В настоящее время роль хирургии у больных НМРЛ с поражением ГМ представляется довольно ограниченной. Она может быть использована только у пациентов с одиночными метастазами в отсутствие прогрессирования заболевания (ПЗ) и без поражения регионарных лимфатических узлов [6, 7].
Облучение всего объема ГМ (ЛТГМ) может быть показано при наличии как множественных, так и солитарных метастазов. P. Rodrigus и соавт. проанализировали данные 250 больных, получавших ЛТГМ. Результаты свидетельствовали о существовании дозозависимого эффекта: однолетняя выживаемость больных, получивших ЛТ в суммарной очаговой дозе (СОД) 30 Гр и бустерное облучение, составила 35 %; при ЛТГМ в СОД 30 Гр онаснизилась до 23,5 %, а при дозе ЛТГМ 20 Гр – до 4 % (р = 0,001) [7]. В течение последнего десятилетия в клиники активно внедряются радиохирургические установки, использование которых при метастатическом поражении ГМ может стать реальной альтернативой хирургическому лечению. В рандомизированном исследовании RTOG 9508 сочетание ЛТГМ с радиохирургией привело к достоверному увеличению общей выживаемости (ОВ) с 4,9 до 6,5 месяцев (p = 0,0393) только в группе с одиночными метастазами в ГМ [8]. Комбинация радиохирургии с ЛТГМ по сравнению с радиохирургией улучшает результаты местного контроля (80 против 52 %, p = 0,03) и снижает частоту появления новых метастазов в пределах ГМ с 74 до 48 % (p = 0,06). [9]. При многофакторном анализе результатов лечения 160 больных ЛТГМ оказалась наиболее значимым предиктором интракраниального контроля опухоли. В целом использование стереотаксической радиохирургии оказывается эффективным в качестве бустерного облучения при наличии одиночных метастазов. Применение метода ограничивается размерами метастазов, которые могут быть подвергнуты стереотаксической радиохирургии; как правило, их диаметр не должен превышать 2 см, что обусловлено резким нарастанием постлучевых осложнений в случае облучения очага большего размера [10].
Считается, что возможности ХТ как самостоятельного метода лечения при метастатическом поражении ГМ весьма ограничены. В качестве основной причины называется низкая способность большинства химиопрепаратов проникать через ГЭБ. Однако роль последнего в недостаточной эффективности ХТ при метастазах в ГМ кажется несколько преувеличенной, т. к. при наличии макроскопических метастазов ГЭБ уже разрушен, что связано с тем, что новообразованная патологическая сосудистая сеть вокруг метастазов не обладает свойствами, характерными для нормальных сосудов ГМ [11]. Эффективность ХТ при метастазах НМРЛ в ГМ продемонстрирована в многочисленных исследованиях [12–20].
Наиболее эффективным подходом к проблеме представляется сочетание ЛТ и ХТ. В нескольких исследованиях при сочетании ЛТГМ с полихимиотерапией показано увеличение ОВ и улучшение местного контроля интракраниальных метастазов [21–23]. При многофакторном анализе ХТ наряду с хирургическим лечением и ЛТ оказала достоверное положительное влияние на ОВ больных [24].
Результаты собственных исследований
С 1999 по 2010 г. в 31-м отделении Главного военного клинического госпиталя (ГВКГ) им. Н.Н. Бурденко было проведено комбинированное лечение 55 больных НМРЛ с метастазами в ГМ. Медиана возраста – 58 лет. Общесоматический статус по шкале ECOG (Eastern Cooperative Oncology Group) – 0–3. Распределение по гистологическим вариантам: плоскоклеточный рак – 25 (45,4 %), аденокарцинома – 24 (43,6 %), низкодифференцированный рак – 5 (9,1 %), cветлоклеточный рак – 1 (1,9 %). Одиночные метастазы выявлены у 17 (30,1 %) больных, множественные – у 38 (69,9 %).
У 31 (56,4 %) пациента метастазы выявлены в дебюте заболевания, у остальных – поражение ГМ развивалось в сроки от 1 до 58 месяцев после установки морфологического диагноза (медиана – 9 месяцев). Всем больным проводили полихимиотерапию по следующим схемам: карбоплатин AUC-5 + этопозид 120 мг/м2 (или тенипозид 100 мг/м2, или паклитаксел 125 мг/м2) одновременно с ЛТ. По одному курсу ХТ проводили в начале и по завершении ЛТ. В случае отсутствия ПЗ (экстраили интракраниального) проводили до 4–6 курсов ХТ. При одиночных метастазах облучали весь объем ГМ до 30 Гр, затем дополнительно – 30 Гр на область метастаза. При множественном метастатическом поражении облучали весь объем ГМ в разовой очаговой дозе (РОД) 1,5–2,0 Гр до СОД 28–31 Гр.
Результаты: На 30.03.2011 у 16 (29,1 %) больных достигнут полный регресс (ПР) метастазов в ГМ, у 19 (34,5 %) – частичный регресс (ЧР) и у 11 (20,0 %) – стабилизация (CЗ). Частота объективного ответа (ЧОО) составила 63,6 %, общая эффективность лечения – 85,6 %. Прогрессирование отмечено у 9 (16,4 %) больных. Полная ремиссия заболевания (ПР интра- и экстракраниальных очагов опухоли) была достигнута только у 3 (5,4 %) больных. Интересен тот факт, что эффект от химиолучевой терапии (ХЛТ) реализовывался в течение относительно продолжительного времени. Как правило, при оценке эффекта через месяц после окончания ЛТ у больных регистрировали ЧР. Все ПР были зафиксированы в промежутке между 5-м и 11-м месяцами после окончания ЛТ. Медиана выживаемости после диагностики метастазов в ГМ составила 12 месяцев, а медиана ОВ с момента диагностики заболевания – 17 месяцев.
Выживаемость после диагностики церебральных метастазов у пациентов с метастазами в ГМ в дебюте заболевания составила 9 месяцев и достоверно не отличалась (р = 0,3) от ОВ больных с интракраниальными метастазами, возникшими при ПЗ, – 15 месяцев. Не отличалась также ни ОВ, ни выживаемость после диагностики метастазов у пациентов с одиночными и множественными метастазами в ГМ. Наблюдалась отчетливая тенденция к увеличению выживаемости больных аденокарциномой, что подтверждает мнение о лучшем прогнозе при неплоскоклеточном раке легкого.
Токсичность комбинированной ХЛТ в выбранных режимах была приемлемой. Нейтропения 4-й степени отмечена у 8 (14,5 %) больных. Гематологическая токсичность была управляемой и разрешилась на фоне введения гранулоцитарных факторов роста. Необходимо помнить о том, что при комбинации ЛТ и ХТ токсические эффекты кумулируются и еженедельное мониторирование показателей крови является строго обязательным.
Роль таргетной терапии
Опухолевые клетки могут приобретать способность к автономной и нерегулируемой пролиферации вследствие неконтролируемой продукции специфических молекул, которые вызывают рост клеток (факторы роста) или посредством патологической, усиленной экспрессии белков, находящихся на поверхности клеточных мембран (рецепторов), с которыми специфическим образом связываются факторы роста. Эти процессы запускают серию внутриклеточных сигнальных каскадов, в конечном счете ведущих к пролиферации раковых клеток, индукции ангиогенеза и метастазирования. Блокирование ростовых сигналов может приводить к обратным эффектам: подавлению ангиогенеза, стимулированию апоптоза. Информация об эффективности таргетной терапии при метастатическим поражением НМРЛ в ГМ носит ограниченный характер. Во многом это объясняется тем, что пациентов с метастатическим поражением ГМ исключают из клинических исследований.
Ингибиторы ангиогенеза
Индукция ангиогенеза – один из наиболее важных механизмов, влияющих как на собственно процесс метастазирования, так и непосредственно на метастазирование в ГМ. Начальный этап метастазирования, включающий отделение от первичной опухоли, инвазию и выход опухолевых клеток в кровеносное русло, происходит при непосредственном участии фактора роста эндотелия сосудов (VEGF – vascular endothelial growth factor). На этапе фиксации в капиллярах ГМ, экстравазации, роста и неоангиогенеза он также играет одну из ключевых ролей. Продукция VEGF и ангиогенез – основные, но не единственные механизмы, влияющие на развитие метастазов в центральной нервной системе (ЦНС) [25]. В любом случае использование ингибиторов VEGF представляется чрезвычайно интересным подходом к лечению метастазов в ГМ. Наряду с обычными, хорошо известными эффектами антиангиогенной терапии при лечении метастатического поражения ГМ очень важную роль может сыграть их способность уменьшать выход жидкости во внесосудистое пространство и таким образом уменьшать отек ГМ.
В первую очередь, когда обсуждается эффективность ингибиторов ангиогенеза, имеется в виду бевацизумаб – моноклональное антитело к VEGF. История использования бевацизумаба в лечении метастазов в ГМ носит драматический характер. Одинединственный случай кровоизлияния в метастаз в ГМ у больной гепатоцеллюлярной карциномой послужил основанием не только для исключения из клинических исследований всех больных с метастазами в ЦНС, но и для запрещения его использования у такой категории пациентов в общеврачебной практике [26]. Лишь в последние 2 года стали поступать отчетливые сигналы о возможности безопасного применения бевацизумаба при метастазах в ГМ. В ряде исследований влияния бевацизумаба на глиальные опухоли продемонстрирована возможность его безопасного использования при новообразованиях ЦНС.
В 2009 г. M. Socinski и соавт. представили данные исследования II фазы AVF3752g (PASSPORT), целью которого было изучение частоты возникновения кровоизлияний в ЦНС ≥ 2-й степени тяжести у больных НМРЛ с метастатическим поражением ГМ, ранее получавших лечение 1-й или 2-й линии по поводу метастазов в ГМ. В 1-й линии использовался бевацизумаб в дозе 15 мг/кг каждые 3 недели в комбинации с ХТ на основе препаратов платины или эрлотинибом (по выбору врача). Во 2-й линии больные получали бевацизумаб в комбинации с монохимиотерапией или эрлотинибом до ПЗ или смерти. Всего в исследование были включены 115 больных (1-я линия – 76, 2-я – 39). Из 106 пациентов, данные которых были доступны анализу безопасности, медиана продолжительности лечения составила 6,3 месяца, медиана циклов бевацизумаба – 5,0. Ни одного случая кровоизлияния в ЦНС ≥ 2-й степени тяжести не было зарегистрировано [27].
В конце 2009 г B. Besse и соавт. представили данные ретроспективного анализа 13 рандомизированных исследований II/III фазы, 2 открытых исследований безопасности и 2 проспективных исследований, включавших пациентов с метастазами в ГМ опухолей различной первичной локализации (НМРЛ, рака почки, молочной и поджелудочной желез, колоректального рака). Всего в 13 рандомизированных исследований были включены 8443 больных, из которых 4760 получали бевацизумаб. У 187 (2,2 %) были выявлены метастазы в ГМ: 91 (1,9 %) – в группе бевацизумаба, 96 (2,6 %) – в контрольной группе (без бевацизумаба). В группе бевацизумаба у 3 (3,3 %) пациентов развились внутримозговые кровоизлияния 4-й степени. Конечно, ценность информации, полученной в результате этого анализа, ограничена особенностями исследования (ретроспективный анализ, опухоли различной первичной локализации, разнообразные схемы лечения). Несмотря на существующие ограничения, полученные данные указывают на то, что риск кровоизлияния в ЦНС у пациентов, получавших бевацизумаб, не является непропорционально большим по сравнению с больными, не получавшими бевацизумаб. Результаты этого исследования позволили исключить наличие метастазов в ГМ из списка противопоказаний к применению бевацизумаба [28].
Ингибиторы тирозинкиназы
Эпидермальные факторы роста и рецепторы к ним являются классическим примером того, как лабораторная находка превратилась в целое направление в лечении онкологических заболеваний вообще и рака легкого в частности. Было обнаружено, что при НМРЛ гиперэкспрессия рецепторов к эпидермальному фактору роста (EGFR – epidermal growth factor receptor) встречается в 85–90 % случаев и ассоциирована с неблагоприятным прогнозом. С учетом этого феномена именно EGFR стал первым рецептором, предложенным в качестве мишени для противоопухолевой терапии.
Существует несколько возможностей влиять на активность EGFR:
- блокирование непосредственно факторов роста (лиганда);
- ингибирование непосредственно EGFR с помощью моноклональных антител;
- блокирование тирозинкиназы с помощью малых молекул.
В настоящее время для терапии НМРЛ зарегистрировано два препарата из этой группы: эрлотиниб (Тарцева) и гефитиниб (Иресса). Оба препарата подавляют внутриклеточную сигнальную активность благодаря тому, что конкурируют с АТФ за взаимодействие с активными участками внутриклеточного тирозинкиназного домена.
В нескольких исследованиях продемонстрировано наличие корреляции между мутациями в экзонах 18–21 EGFR и ЧОО при лечении НМРЛ ингибиторами тирозинкиназы (ИТК). Подобные мутации чаще регистрируют среди лиц азиатской расы (30 против 8 %), никогда не куривших (51 против 10 %), женщин (42 против 14 %) и пациентов с аденокарциномой (40 против 3 %). Наиболее часто встречаются делеция в экзоне 19 (del 19) и точечная мутация L858R в экзоне 21 [29]. ЧОО в проспективных исследованиях у больных НМРЛ с наличием соматических мутаций колеблется от 55 до 91 % [30].
Гиперэкспрессия EGFR ассоциирована с резистентностью к ЛТ [31]. Интересен тот факт, что наличие мутаций EGFR коррелирует не только с более высоким ответом на терапию ИТК, но и с радиочувствительностью. Клеточные линии НМРЛ без мутаций EGFR демонстрируют радиопротективные свойства с относительно низким уровнем радиационно обусловленного апоптоза и эффективным механизмом репарации разрыва ДНК. В клеточных линиях с мутантным EGFR этот механизм не работает [32]. В настоящее время имеются данные исследований, подтверждающие возможность использования ингибиторов EGFR для увеличения цитотоксичности ЛТ [33]. Блокирование EGFR-сигнального пути усиливает радиационно-обусловленный апоптоз и подавляет ангиогенез, и в этом смысле комбинация ИТК и ЛТ может иметь перспективы. В ретроспективном анализе C.H. Gow и соавт. экспериментальные данные получили подтверждение. Наиболее высокая ЧОО была у больных аденокарциномой легкого с мутациями EGFR – 54 % по сравнению с 24 % у пациентов без мутаций EGFR в опухоли (р = 0,045). Использование ИТК (р = 0,034) и наличие мутаций EGFR (р = 0,029) независимо влияли на ЧОО [34].
Накопление гадолиний-содержащего контраста в метастазах рака легкого свидетельствует о разрушении ГЭБ, и в такой ситуации возможность проникновения ИТК через ГЭБ не имеет принципиального значения. Однако для микрометастазов с нормально функционирующим ГЭБ эта способность чрезвычайно важна. Низкая молекулярная масса ИТК косвенно свидетельствует об их потенциальной способности проникать через ГЭБ. Опубликовано несколько работ, в которых авторы сходятся во мнении, что концентрация в ликворе эрлотиниба и его активного метаболита OSI-420 после приема стандартных доз препарата составляет 7 и 9 % соответственно от концентрации в плазме. Таким образом, при приеме эрлотиниба внутрь его концентрация в ликворе сопоставима с той, которая оказывала эффект в преклинических моделях на некоторые клеточные линии рака [35–37]. С учетом этих экспериментальных данных очевидно, что для достижения эффекта при использовании ИТК необходим правильный отбор пациентов.
R. Porta и соавт. представили результаты лечения эрлотинибом 69 больных НМРЛ с метастазами в ГМ. ЧОО при наличии мутаций EGFR в опухоли составила 82,4 %; у больных НМРЛ без мутации EGFR не было зафиксировано ни одного эффекта (p < 0,001). Медиана времени до прогрессирования интракраниальных очагов у больных НМРЛ с мутациями EGFR составила 11,7 (7,9–15,5) месяца по сравнению с 5,8 (5,2–6,4) для контрольной группы, где мутация EGFR не была оценена (p < 0,05). ОВ достигла 12,9 (6,2–19,7) и 3,1 (2,5–3,9) месяца (p < 0,001) соответственно [38].
Необходимость отбора пациентов подтверждается в исследовании G.L. Ceresoli и соавт. В исследование был включен 41 пациент с измеряемыми интракраниальными метастазами. Все пациенты получали гефитиниб в дозе 250 мг/сут. ЧР метастазов был достигнут у 4 (10 %) больных, СЗ – у 7 (17 %), общий уровень контроля церебральных метастазов (ЧР + СЗ) составил 27 %. Медиана выживаемости без прогрессирования (ВБП) для всей популяции пациентов составила 3 месяца, причем ВБП была выше в группе больных аденокарциномой (р = 0,04) [39].
До настоящего времени не было ни одного крупного исследования, которое оценивало бы эффективность ИТК при церебральных метастазах. Как правило, имеющиеся данные получены путем ретроспективного анализа. Наибольшее количество результатов клинических исследований опубликовано корейскими и китайскими авторами на основе опыта лечения, соответственно, азиатского контингента больных. Причем, по данным авторов из Азии, ЧОО в популяции больных, где не использовались ни молекулярно-генетические, ни клинические предикторы отбора была приблизительно в 3 раза выше по сравнению с данными европейских исследователей и составила 33 % [40, 41]. Этот факт указывает на возможность использования клинических предикторов (в данном случае расы) для отбора пациентов.
Некоторые авторы считают, что ГЭБ серьезно уменьшает терапевтический интервал ИТК. Для достижения терапевтических концентраций эрлотиниба в ликворе может быть предложена интермиттирующая (прерывистая) схема приема препарата с высокими недельными дозами (1500 мг). J.L. Clarke, предложивший подобную методику, описал успешное достижение высоких концентраций эрлотиниба в ликворе, что, по мнению автора, позволило успешно контролировать течение заболевания у больных НМРЛ с наличием мутаций EGFR и лептоменингиальными метастазами [42].
Результаты собственных исследований
Мы использовали несколько другой подход к отбору больных НМРЛ с метастазами в ГМ. В исследуемой группе пациентов подавляющее большинство составили первичные больные. В подобной ситуации времени для определения мутаций EGFR, как правило, нет. Затягивание с началом лечения, направленного против церебральных метастазов, может существенно ухудшить состояние больных. Именно поэтому для отбора пациентов использовались преимущественно клинические предикторы эффективности ИТК. В первую очередь отбирали никогда не куривших больных с аденокарциномой. Из небольшого арсенала ИТК выбор был сделан в пользу эрлотиниба. Основанием стало то обстоятельство, что в клинических исследованиях эрлотиниб в отличие от гефитиниба оказался эффективным у больных НМРЛ не только с мутациями EGFR, но и с “диким типом” EGFR, с плоскоклеточным раком и даже у курящих пациентов. Необходимость достижения контроля метастатического процесса в ГМ диктовала использование максимально агрессивных подходов. Поэтому на первом этапе подавляющему большинству больных проводили ХЛТ. Опубликованные ранее данные исследования SATURN продемонстрировали возможность увеличения выживаемости больных при использовании эрлотиниба в “поддерживающем режиме” [43]. Именно подобную методологию и было решено использовать среди пациентов, отобранных на основании или клинических, или молекулярно-генетических предикторов. Схема лечения представлена на рис. 1.

С 2008 по 2011 г. в 31-м отделении ГВКГ им. Н.Н. Бурденко проведено комбинированное лечение 10 больных НМРЛ с метастазами в ГМ. Медиана возраста – 52 года. Мужчин – 3 (30 %), женщин – 7 (70 %). Никогда не курили 8 человек, курил и бросил 1, продолжает курить 1 пациент. Общесоматический статус по шкале ECOG – 1–3. У всех пациентов при гистологическом исследовании диагностирована аденокарцинома. Одиночные метастазы – у 1 больного, множественные – у 9. Из 10 больных у 8 метастазы в ГМ были диагностированы в дебюте заболевания. Эти пациенты получили ХЛТ в качестве первичного лечения, а затем эрлотиниб как поддерживающую терапию. У 2 больных метастазы развились при ПЗ. В этих случаях была сразу начата терапия эрлотинибом в комбинации с ЛТ, а затем продолжено лечение эрлотинибом в монотерапии до ПЗ.
Таблица. Клиническая характеристика больных НМРЛ, у которых определяли мутационный статус EGFR в опухоли.
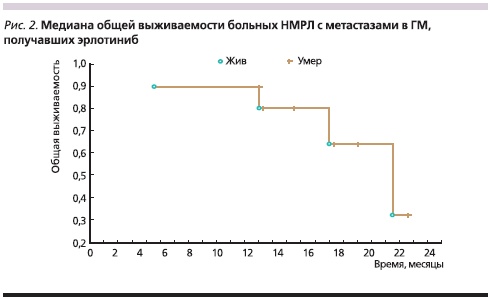
Результаты: На 30.03.2011 у 3 больных достигнут ПР метастазов в ГМ, у 5 – ЧР и у 1 – СЗ. ЧОО составила 80 %, общая эффективность лечения – 90 %. ПЗ отмечено у 1 больного. Полная ремиссия заболевания (ПР интраи экстракраниальных очагов) была достигнута только у одного пациента. В нашем исследовании только трем больным выполнено исследование на наличие мутаций EGFR. В одном случае выявлена мутация в экзоне 19. На фоне лечения у больного зарегистрированы СЗ метастазов в ГМ, ЧР опухоли и экстракраниальных метастазов. У двоих пациентов не обнаружено мутаций EGFR (см. таблицу). Наше наблюдение демонстрирует возможность эффективного применения эрлотиниба у больных НМРЛ без мутаций EGFR с метастазами в ГМ. Медиана ОВ больных, получавших эрлотиниб, составила 21,5 месяца (рис. 2).
Терапия эрлотинибом переносилась хорошо. Редукция дозы препарата потребовалась в одном случае, вследствие развития сыпи 3-й степени. В остальных 9 случаях побочные эффекты со стороны кожи были 1–2-й степеней и не требовали специального лечения.
Клинические примеры
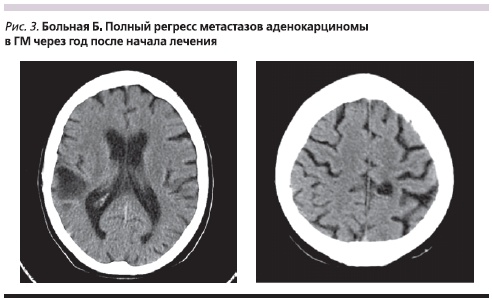
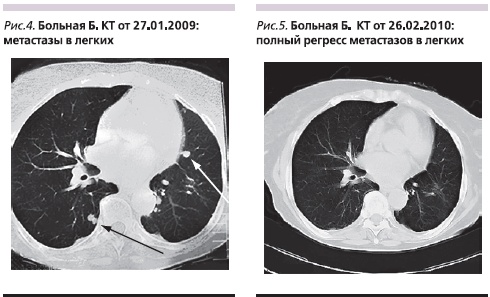
Пример 1. Больная Б. Женщина европейской расы. Возраст – 68 лет. Никогда не курила. В августе 2007 г. при компьютерной томографии (КТ) в С8 левого легкого обнаружена опухоль с неровными бугристыми контурами, единичными тяжами к междолевой плевре размерами 38 ± 25 мм. Лимфатические узлы средостения и корней легких до 10 мм. 09.10.2007 выполнена операция: нижняя лобэктомия слева. При гистологическом исследовании: опухолевый узел представлен умеренно дифференцированной аденокарциномой ацинарного и папиллярного строения с участками продукции слизи и фокусами бронхиолоальвеолярного рака. В дальнейшем больная наблюдалась по месту оперативного лечения. Летом 2008 г. при КТ выявлено появление новых объемных образований, число которых в легких в последующем увеличивалось (рис. 4). С февраля 2009 г. – ухудшение состояния, отмечены появление головных болей, нарушение статики, выраженная общая слабость. В ускоренном порядке госпитализирована в ГВКГ им. Н.Н. Бурденко. При поступлении состояние тяжелое, общесоматический статус по шкале ECOG – 3. При КТ выявлено множественное метастатическое поражение ГМ. С 23.03.2009 по 15.04.2009 проведен курс ЛТ в РОД 2 Гр до СОД 30 Гр, одновременно проведено 2 курса ХТ по схеме: карбоплатин AUC-5 в 1-й день, этопозид 200 мг – с 1-й по 3-й день. После завершения ХЛТ начат прием эрлотиниба в дозе 150 мг/сут. Через месяц после начала лечения отмечено развитие сыпи 3-й степени, что потребовало редукции дозы до 100 мг/сут. Проявление уменьшилась до 1-й степени. В результате лечения достигнут ПР метастазов в ГМ с образованием через год на их месте кист (рис. 3). При оценке экстракраниальных проявлений заболевания констатирован ПР (рис. 5). В результате проведенного лечения общесоматический статус по шкале ECOG – 0. Больная на момент написания статьи жива, без признаков прогрессирования заболевания.
Пример 2. Больная З. Женщина европейской расы. Возраст – 48 лет. Никогда не курила. 16.06.2005 оперирована по поводу низкодифференцированной аденокарциномы T2N2M0 в объеме верхней лобэктомии. Проведена послеоперационная ЛТ на область лимфоузлов средостения и корня правого легкого. В ноябре 2008 г. диагностировано ПЗ – множественное метастатическое поражение костей. С 08.12.2008 по 17.03.2009 проведено 5 курсов ХТ по схеме: Авастин (бевацизумаб) + карбоплатин + Навельбин (винорелбин). Достигнуты СЗ, регресс болевого синдрома. С декабря 2009 г. состояние вновь ухудшилось, усилились боли. Проведено два курса ХТ: Алимта (пеметрексед) 800 мг + карбоплатин 400 мг, интервал между курсами – 3 недели. На этом фоне появились выраженные головные боли. При КТ головного мозга выявлено его множественное метастатическое поражение. С 14.04.2010 по 13.05.2010 – курс ЛТ в РОД 2 Гр до СОД 40 Гр. С 13.04.2010 начат ежедневный прием эрлотиниба в дозе 150 мг/сут. Нежелательные явления со стороны кожи 1-й степени. Болевой сидром уменьшился. Достигнут ЧР метастазов в ГМ (рис. 6). В результате проведенного лечения состояние больной значительно улучшилось. Больная жива. Обслуживает себя.
Выводы
- Хирургическое лечение может быть предложено больным НМРЛ с хорошим общесоматическим статусом (ECOG 0–2), с доступным для операции единичным очагом, отсутствием экстракраниальных проявлений болезни.
- Послеоперационная ЛТГМ должна проводиться для снижения риска интракраниального рецидива опухоли после удаления солитарного метастаза в ГМ.
- Радиохирургическое бустерное облучение с ЛТГМ может увеличить выживаемость пациентов с единичными, нерезектабельными метастазами в ГМ.
- ЛТГМ должна осуществляться при наличии множественного поражения ГМ при НМРЛ. РОД не более 2 Гр из-за повышенного риска развития постлучевой деменции.
- ХЛТ больных НМРЛ с метастазами в ГМ обладает высокой непосредственной эффективностью и позволяет увеличивать медиану выживаемости до 12 месяцев, что фактически соответствует аналогичным показателям выживаемости больных без метастазов в ГМ.
- Эрлотиниб в комбинации с ЛТ и в поддерживающем режиме после ХЛТ обладает высокой эффективностью у больных НМРЛ, отобранных на лечение с использованием молекулярно-генетических и клинических предикторов ответа на терапию ИТК. Медиана выживаемости после диагностики метастазов в ГМ у таких пациентов составляет 21,5 месяца, согласно данным, полученным на собственном опыте в ГВКГ им. Н.Н. Бурденко.
Информация об авторах:
Смолин Алексей Владимирович – кандидат медицинский наук, старший ординатор (31-го)
радиотерапевтического отделения ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”.
E-mail: sirano68@gmail.com;
Конев Андрей Владимирович – заведующий (31-м) радиотерапевтическим отделением
ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”.
Тел. 8 (499) 263-03-66;
Николаева Светлана Николаевна – врач-радиолог (31-го) радиотерапевтического отделения
ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”.
Тел. 8 (499) 263-53-31;
Сидоренко Владимир Владимирович – врач-специалист отделения магнитно-резонансной томографии, подполковник
медицинской службы ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”;
Шаманская Юлия Евгеньевна – врач-радиолог (31-го) радиотерапевтического отделения
ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”.
Тел. 8 (499) 263-53-31;
Халиярова Дилрабо Джураевна – врач-радиолог (31-го) радиотерапевтического отделения
ФГУ “Главный военный клинический госпиталь им. Н.Н. Бурденко”.
Тел. 8 (499) 263-57-32