Введение
Менопауза – это нормальное физиологическое событие для женщин среднего возраста, связанное со снижением функции яичников, что приводит к снижению уровня половых гормонов. Она также может быть вызвана хирургическим удалением или необратимым повреждением яичников. Средний возраст наступления менопаузы составляет 51 год. Независимо от того, когда и как это происходит, женщины проживают период менопаузы по-разному. Приблизительно в 50% случаев развивается мочеполовой синдром менопаузы (МСМ) – состояние, которое значительно ухудшает качество жизни и определенно требует лечения.
МСМ – это совокупность симптомов и признаков, связанных со снижением половых гормонов, проявляющихся в виде изменений больших и малых половых губ, клитора, влагалища, уретры и мочевого пузыря [1].
Основные клинические проявления МСМ можно разделить на три группы: генитальные (сухость влагалища, раздражение/жжение/зуд, лейкоррея, редеющие/седеющие волосы на лобке, вагинальная/тазовая боль, выпадение свода влагалища), сексуальные (диспареуния, уменьшение количества вагинального секрета, посткоитальное кровотечение, снижение возбуждения/оргазма, потеря либидо, дизоргазмия), симптомы со стороны мочевыделительной системы (дизурия, стрессовое недержание мочи, рецидивирующие инфекции мочевыводящих путей, выпадение уретры, ишемия везикулярного тригона) [22].
Наиболее частые жалобы пациенток при МСМ: сухость вульвовагинальной зоны, диспареуния, ощущение жжения/зуда и дизурия. К другим жалобам относятся внешние изменения и раздражение в области вульвы, частые рецидивы бактериальных инфекций мочеполовых путей. Вульвовагинальная атрофия может проявляться в раннем возрасте из-за гипоталамической аменореи, гиперпролактинемии, лактации и приема антиэстрогенных препаратов [2].
Сухость, диспареуния и раздражение влагалища и вульвы – это симптомы, больше всего влияющие на индекс качества жизни женщины (ДИКЖ – дерматологический индекс качества жизни) [3].
«Золотым» стандартом лечения симптомов МСМ являются эстрогены и Оспемифен (пероральный активный селективный модулятор рецепторов эстрогенов). В настоящее время данный препарат одобрен FDA (Food and Drug Administration) для лечения диспареунии, связанной с вульвовагинальной атрофией в постменопаузе [4]. Но не всегда удается назначить пациентке эстрогены не только из-за отсутствия желания или недоверия женщины к препаратам [5], но и из-за прямых противопоказаний на примере эстроген-зависимой карциномы молочной железы [6, 23]. Также необходимо отметить, что гормоны значительно менее эффективны для вульвы по сравнению с влагалищем [7].
В последние годы для коррекции инволютивных изменений кожи активно применяется фотодинамическая терапия (ФТД). Метод ФДТ состоит из трех компонентов: фотосенсибилизатор (вводится внутривенно или наносится локально на область воздействия), свет определенной длины волны и синглетный кислород. В европейских клинических рекомендациях ФДТ для омолаживающего эффекта имеет самый высокий уровень рекомендаций (A) и уровень доказательности (I) для пациентов с онкологией (аденокарцинома, болезнь Боуэна и базальноклеточная карцинома) [8].
Основные мишени ФДТ – окислительно-антиокислительная, иммунная системы, митохондрии, лизосомы, цитоплазматическая мембрана, пластинчатый комплекс Гольджи, гранулярная эндоплазматическая сеть, микрососудистая сеть нормальной ткани [9, 24]. E.S. Marmur et al. сообщают о превосходстве ФДТ по эффективности перед другими неаблативными методами лазерной терапии из-за способности приводить к усиленному синтезу коллагена I типа в тканях [10]. ФДТ является перспективной неинвазивной методикой лечения инволютивных состояний кожи, но единого утвержденного протокола терапии на данный момент не существует [11].
Также из перспективных методов омоложения и улучшения качества кожи является метод PRP-терапии, набирающий популярность в последнее время. PRP – это аутологичная плазма крови, богатая тромбоцитами [12]. Также PRP обогащена факторами роста, свертывания крови, хемокинами, цитокинами и другими белками плазмы [13].
В одном из исследований продемонстрировали, что PRP может стимулировать пролиферацию дермальных фибробластов человека и увеличивать синтез коллагена I типа [14]. На основании гистологических данных PRP, вводимый в глубокие слои дермы и непосредственно в подкожную клетчатку человека, вызывает активацию фибробластов и отложение нового коллагена, а также образование новых кровеносных сосудов и жировой ткани [15, 16]. Кроме того, обнаружено, что тромбоциты выделяют около 35 факторов роста, способствующих заживлению и регенерации тканей. Этот факт использовался эстетическими гинекологами в таких процедурах, как омоложение влагалища и терапия при сексуальной дисфункции [17].
После инъекции PRP для регенерации слизистой оболочки влагалища практикующие врачи сообщили о резком увеличении чувствительности за счет усиленной васкуляризации. При сексуальной дисфункции PRP считается революционным новым нехирургическим амбулаторным методом лечения, который помогает нивелировать недержание мочи и сексуальную дисфункцию за счет использования собственных факторов роста. PRP немедленно активирует регенерацию тканей, и сексуальный ответ значительно усиливается. Желаемый результат включает улучшение возбуждения, более сильный оргазм, уменьшение проявлений диспареунии и увеличение синтеза секрета [18].
Несколько исследований, посвященных лечению МСМ с использованием PRP, показали многообещающие результаты [19, 25].
S.H. Kim et al. пришли к выводу, что применение аутологичного липофилинга, комбинированного с PRP, привело пациентку с атрофией влагалища к облегчению симптомов и восстановлению контура больших половых губ, также был отмечен неплохой косметический результат [20].
C. Runels et al. ввели плазму, обогащенную тромбоцитами в клитор и влагалище 11 пациенткам, и обнаружили, что интравагинальные и интраклиторальные инъекции PRP могут быть эффективным методом лечения определенных типов женской сексуальной дисфункции [21].
В заключение: PRP– инновационный, доступный и легковыполняемый терапевтический метод при урогенитальных расстройствах. Хотя конкретные механизмы действия PRP не были полностью выяснены, эффективность PRP-терапии выглядит многообещающе, а риски данной процедуры при правильном применении минимальны.
Цель исследования: оценка эффективности и безопасности ФДТ при сочетанном использовании с PRP в лечении МСМ.
Методы
В группу данного исследования включены 15 женщин с диагнозом «мочеполовой синдром менопаузы» в возрасте от 42 до 66 лет (средний возраст составил 55,8±5,95 года). Длительность заболевания составляла от 1 до 10 лет (средняя продолжительность – 37,6±31,29 месяца).
Всем пациенткам проводили комбинированную терапию, состоявшую из 5 процедур ФДТ, чередовавшихся с плазмотерапией (всего 5 процедур) с интервалом в 7 дней. Продолжительность наблюдения составила 3 месяца.
Критерием включения в группу наблюдения послужило отсутствие предшествовавшей гормонотерапии МСМ.
Оценка эффективности проводилась с учетом динамики показателей следующих шкал: ИВЗ (индекс вагинального здоровья), ВАШ (визуальная аналоговая шкала), оценивающая интенсивность показателей сухости, зуда и диспареунии от 0 до 10; ДИКЖ (дерматологический индекс качества жизни), где оценивалось влияние состояния кожи на качество жизни пациента. Также мы разработали собственную шкалу оценки визуальных иволютивных изменений вульвы (ВИИВ), в которую включили 7 показателей (цвет/депигментация, шелушение, текстура кожи на ощупь, сосудистый рисунок, волосяной покров в области больших половых губ, уплощение и сморшивание кожи больших половых губ, трещины/эрозии). Чем выше баллы, тем сильнее проявления атрофии вульвы (см. таблицу).
Результаты
Все 15 пациенток завершили полный курс лечения и наблюдались в течение 3 месяцев. В перименопаузальном периоде наблюдались 6 пациенток, в постменопаузальном – 9.
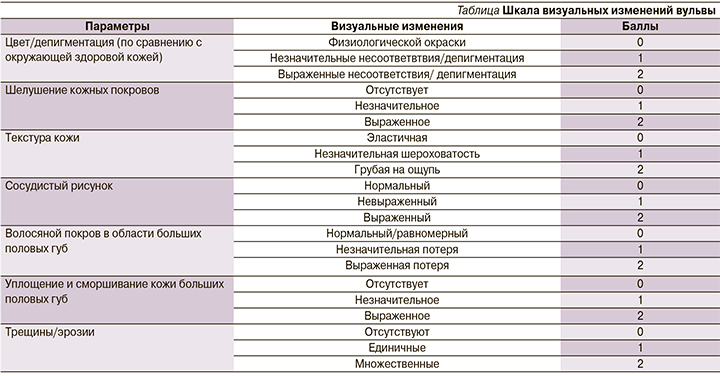
Ни одна из пациенток не выразила жалоб на отсутствие эффекта от пройденной терапии. Оценив удовлетворительность проведенного лечения, 11 пациенток отметили полную удовлетворенность от терапии, остальные четыре – «почти удовлетворены» из-за остаточного явления сухости и диспареунии. Зуд прекратился у большинства пациенток. При оценке эффективности с учетом ИВЗ у всех выявлена положительная динамика. Наибольший эффект достигнут в отношении целостности эпителия (в среднем 4,93 балла), показателей влажности (4,73), транссудата (4,73) и Ph-метрии (4,4 балла). Наименьшие изменения были в показателях эластичности по сравнению с исходными данными (рис. 1).
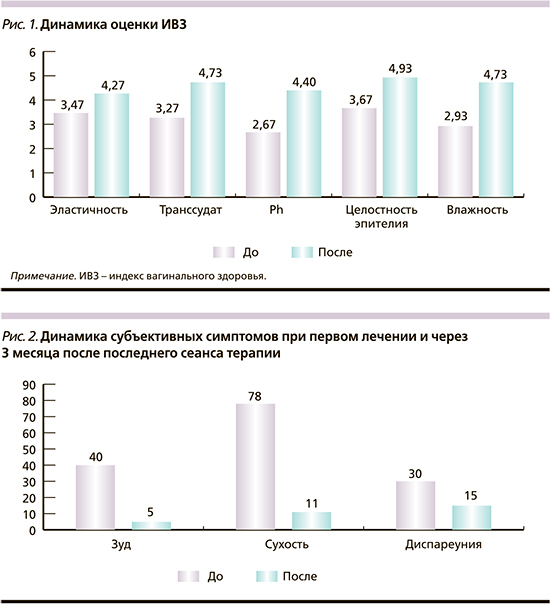
Перед процедурами ФДТ все пациентки жаловались на зуд (от незначительной до выраженной степени), сухость в области вульвы и диспареунию. Зуд у 11 пациенток полностью регрессировал, остальные 4 пациентки сообщили о незначительных проявлениях зуда. Средняя оценка сухости составила 5,47 балла до начала лечения. После завершения курса процедур отмечено снижение данного показателя в среднем до 0,93 балла. Полностью сухость исчезла у 6 пациенток, у остальных наблюдалось уменьшение симптомов до незначительных. Диспареуния, отмеченная до лечения у 10 пациенток, полностью исчезла у 6 из них, у остальных 4 наблюдалось значительное облегчение симптомов. В течение 3 месяцев наблюдения рецидив возник у 1 участницы исследования. Субъективные симптомы при первом лечении и через 3 месяца после последнего сеанса терапии представлены в рис. 2.
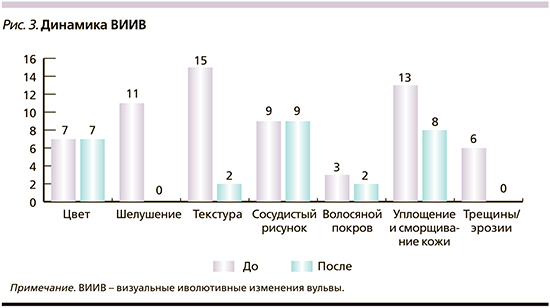
При оценке разработанной нами шкалы ВИИВ получены следующие результаты: у всех пациенток отмечен полный регресс шелушения и трещин. Текстура кожи вульвы у большинства пациенток значительно улучшилась. Также отмечено улучшение визуальной картины по отношению к показателю сморщенности кожи. Волосяной покров практически не изменился. Изменений цвета кожи и сосудистого рисунка после курса процедур не наблюдалось (рис. 3).
Все пациентки прошли полный курс комбинированной ФДТ и плазмотерапии. Побочных эффектов не отмечено во время и после лечения. Пациентки в основном указывали на небольшое жжение и эритему во время процедуры ФДТ, которое исчезало в течение 30 минут. До процедуры плазмотерапии всем пациенткам проводилась аппликационная анестезия кремом Эмла (лидокаин+прилокаин) с экспозицией на 30 минут или спреем лидокаина. После процедуры имели место пощипывание и незначительный отек, который проходил у всех пациенток в течение суток.
Обсуждение
В настоящее время основная линия терапии МСМ/инволютивных изменений в вульвовагинальной области заключается в применении эстрогена, но, т.к. есть определенные противопоказания и гормоны малоэффективны для вульвы, наша задача находить и комбинировать другие, уже доказанные на практике методики. Необходимы новые протоколы терапии для получения более пролонгированного результата с минимальными побочными эффектамии.
Комбинированное применение ФДТ и плазмотерапии при МСМ – эффективый метод по отношению к регрессу симптомов сухости и зуда. Данная комбинация показала улучшение текстуры кожи, а шелушение и эрозии практически исчезли.
Заключение
Процедуры ФДТ и плазмотерапии проводились всего 10 раз (каждая по 5 процедур) поочередно с периодичностью 1 раз в 7 дней. Данный протокол комбинированной терапии ФДТ (используемым фотосенсибилизатором являлся хлорин E6) и плазмотерапии показал высокую эффективность и безопасность.
Исходя из вышесказанного, возможности комбинированного применения ФДТ и плазмотерапии весьма многообещающи. Мы продолжаем наблюдение за состоянием пациенток после пройденного курса для понимания длительности сохраняющегося положительного эффекта.



