Введение
Рак эндометрия (РЭМ) – наиболее распространенная гинекологическая опухоль в развитых странах, и заболеваемость им растет [1]. Заболевание часто манифестирует в виде маточных кровотечений уже на ранней стадии заболевания, поэтому его часто удается диагностировать на I стадии. При I стадии РЭМ 5-летняя общая выживаемость (ОВ) составляет 95,3% [2]. При этом I стадия эндометриоидной (ЭАК) и серозной аденокарциномы с низкой степенью дифференцировки имеет худший прогноз, с 5-летней ОВ – 86 и 74% соответственно [3]. Больные с метастатическим процессом имеют плохой прогноз, с 5-летней ОВ – 17% [4]. Исторически стандартный подход к лечению РЭМ включает гистерэктомию, двустороннюю сальпингоофоректомию и диссекцию тазовых лимфатических узлов (ЛУ) с последующей адъювантной терапией. Сегодня нет единого мнения о том, каким пациенткам следует проводить удаление тазовых и/или парааортальных ЛУ. Лимфодиссекция не повышает выживаемость [5], но наличие метастазов в ЛУ должно учитываться при выборе оптимального адъювантного лечения.
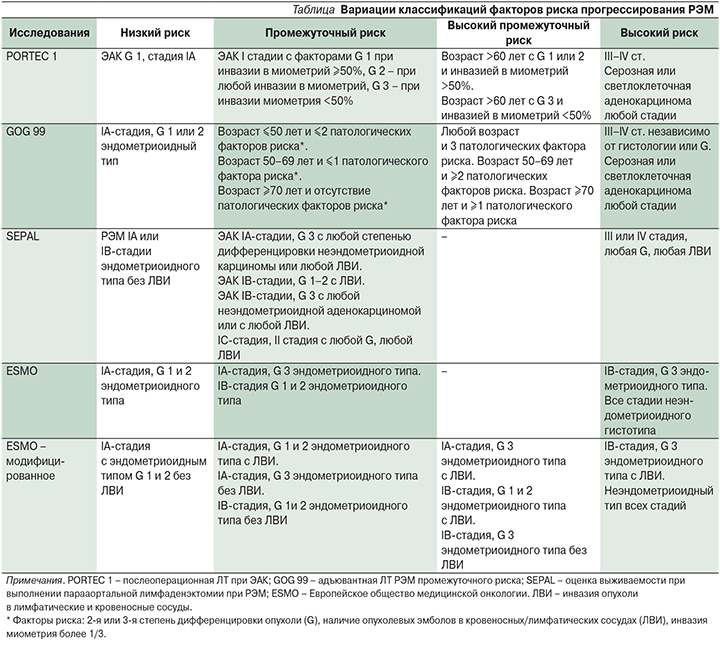
В течение последних лет подходы к лечению РЭМ стали более неопределенными по нескольким причинам: изменения гистологической классификации и стадирования, повлиявшие на хирургическое лечение, адъювантная терапия и прогноз; изменения в показаниях к лимфаденэктомии; расхождения между различными классификациями, используемыми для характеристики факторов риска прогрессирования (см. таблицу) [6–9].
Проблемы с подходами к адъювантному лечению в связи с различными вариациями классификации факторов риска наконец привели к тому, что национальные научные общества проанализировали полученные данные и оставшиеся без ответа вопросы, в 2014 г. опубликовали конкретные рекомендации по поводу РЭМ [10–12].
Хирургическая оценка ЛУ для стадирования заболевания остается одной из самых вариабельных практик во всем мире, одни клиники не оценивают состояния ЛУ, другие – определяют сторожевой ЛУ, некоторые в обязательном порядке выполняют тазовую и аортальную лимфаденэктомию вплоть до почечных сосудов. Большинство клиницистов согласны с тем, что удаление или биопсия подозрительных или увеличенных тазовых или парааортальных ЛУ важны для исключения метастатического процесса. Тазовая лимфодиссекция с патоморфологической оценкой по-прежнему является обязательным аспектом хирургического этапа лечения РЭМ I стадии. Парааортальная лимфодиссекция проводится для стадирования заболевания с целью селекции больных высокого риска прогрессирования [13]. Однако в проспективных клинических исследованиях улучшение выживаемости при лимфаденэктомии не доказано [14]. Ретроспективные данные, свидетельствующие о повышении выживаемости при лимфаденэктомии, представлены сериями исследований случай–контроль и наблюдениями за отдельными отобранными пациентками. Эти результаты значительно отличаются от данных проспективных рандомизированных исследований [5, 8, 15–17].
Адъювантная лучевая терапия
Около 55% больных РЭМ имеют опухоль, распространяющуюся в пределах матки, и низкий риск прогрессирования, когда достаточно проведения одного оперативного вмешательства. Пятилетняя безрецидивная выживаемость в этой группе больных достигает 95%. Четыре рандомизированных исследования и Кокрановский мета-анализ позволили оценить роль дистанционной лучевой терапии (ДЛТ) при РЭМ I стадии [7, 1–24]. В норвежском исследовании 540 пациенток с I стадией заболевания получали послеоперационную внутривагинальную брахитерапию, после чего случайным образом распределялись в группы дополнительной ДЛТ или наблюдения. Хотя частота местных рецидивов была значительно ниже при проведении ДЛТ (4 против 7%), показатели выживаемости в группах были одинаковыми, хотя у пациенток с опухолями G 3 с глубиной инвазии в миометрий >50% имелась тенденция к достижению лучших локального контроля и выживаемости при применении ДЛТ, чем при наблюдении [18]. ДЛТ и наблюдение после операции сравнивали в исследованиях PORTEC-1 (n=714) [17], ASTEC/EN5 (n=905) [7] и GOG 99 (n=392) [21]. Эти работы и Кокрановский мета-анализ показали значительное снижение риска развития рецидива во влагалище и в малом тазу при назначении ДЛТ по сравнению с наблюдением (4 против 14% в PORTEC-1; p<0, 001), но ОВ между группами существенно не различалась [17, 20, 24].
В исследовании PORTEC-2 [22] вагинальная брахитерапия и ДЛТ сравнивались у 427 больных РЭМ с высоким промежуточным риском прогрессирования. В обеих группах 5-летняя частота рецидивов во влагалище была <2%. Однако частота отдаленного метастазирования была выше в группе брахитерапии (5 против 2% в группе ДЛТ; p=0,17). ОВ не различалась между группами (81% в группе ДЛТ и 85% в группе брахитерапии).
В шведском исследовании ДЛТ с последующей вагинальной брахитерапией сравнивали только с брахитерапией у пациенток с раком эндометрия промежуточного риска. Локорегиональный контроль был значительно лучше в группе ДЛТ и брахитерапии, но не превосходил результаты применения одной ДЛТ в других исследованиях. Выживаемость между группами не различалась, но в группе ДЛТ и вагинальной брахитерапии имела место более выраженная токсичность [23].
Принимая во внимание хорошие показатели вагинального контроля без значительных токсических эффектов, вагинальная брахитерапия является стандартным адъювантным лечением для пациенток с РЭМ I стадии по классификации FIGO 2009 г. при высоком промежуточном риске [22]. Тем не менее существует возможность выбора между тщательным наблюдением (риск рецидива – 20%) и простой и эффективной профилактической терапией с одинаковым долгосрочным качеством жизни. Большинство пациенток предпочли лечение, даже при всего лишь 5%-ном уровне пользы [25]. В рандомизированном исследовании PORTEC-4, которое проходит в настоящее время, продолжается изучение результатов тщательного наблюдения по сравнению с вагинальной брахитерапией.
Химиотерапия
Сравнение адъювантной химиотерапии (ХТ) с тазовой ДЛТ при РЭМ проводилось в трех рандомизированных исследованиях [26–28]. Больным назначали 3 цикла комбинированной ХТ по схеме CAP (циклофосфамид, доксорубицин и цисплатин) в японском исследовании [26] и 5 циклов по указанной схеме в итальянском исследовании [27].
В японском исследовании (n=385) у пациенток группы низкого и промежуточного рисков прогрессирования не было отмечено существенных различий ни по ОВ (87 и 85%; отношение шансов [ОШ]=0,72), ни по выживаемости без прогрессирования (ВБП; 82 и 84%; ОШ=1,07) [26]. Тем не менее незапланированный анализ подгруппы пациенток со стадией заболевания IC при возрасте >70 лет, или с ЭАК G3, или РЭМ II стадии G 2, или с наличием клеток рака в смывах продемонстрировал преимущество ХТ перед ДЛТ (5-летняя ВБП – 84 и 66%; р=0,024, 5-летняя ОВ – 90 и 74%; р=0,006) [26].
В итальянском исследовании (n=345) участвовали больные более высокой стадией РЭМ: 65% пациенток имели III стадию. В этом исследовании не было выявлено существенных различий в 5-летней ОВ (66 и 69%; ОШ=0,95) и 5-летней ВБП (63 и 63%; ОШ=0,88), но в группе ХТ реже наблюдалось развитие отдаленных метастазов (17 против 25%) с большей частотой токсических эффектов 3-й степени (14 против 3%; ОШ=0,48) [27].
В исследовании Gynecologic Oncology Group (GOG)-122 у 396 пациенток с III стадией или оптимально оперированных с IV стадией РЭМ (оптимальность определялась как наличие остаточной опухоли <2 см) сравнивали облучение всего живота с ХТ доксорубицином и цисплатином. Несколько лучшие результаты были достигнуты в группе ХТ с показателями ОШ в отношении ВБП и ОВ 0,71 и 0,68 соответственно [28]. Однако частота развития местного рецидива в группе ХТ была выше, чем при ЛТ (18 против 13%; р=0,03).
Комбинированная лучевая и химиотерапия
Исследования, в которых сравнивались адъювантные ХТ и ДЛТ, показали, что хотя ХТ предотвращала развитие отдаленного рецидива РЭМ, тазовая ДЛТ лучше контролировала развитие местного рецидив, а ОВ и безрецидивная выживаемость в группах были одинаковыми [27–31].
В более поздних исследованиях тазовая ЛТ сравнивалась с химиолучевой терапией (ХЛТ). Наиболее достоверным подтверждением превосходства комбинированной ХЛТ стали объединенные результаты исследований NSGO-9501/EORTC-55991 и MaNGO ILIADE-III, в которые включались пациентки с различными стадиями РЭМ и схемами ХТ. Несмотря на отсутствие значительного повышения ОВ в отдельных исследованиях, комбинированная терапия показала ее увеличение в объединенном анализе (ОШ=0,55; 95% доверительный интервал – 0,35–0,88; р=0,01) [31].
В большинстве случаев в указанных исследованиях использовалось от 4 до 6 циклов ХТ (либо доксорубицин с препаратами платины, либо карбоплатин с паклитакселом), продемонстрировавшей свою эффективность при диссеминированном РЭМ [32]. При проведении комбинированной терапии ЛТ использовали как до, так и после ХТ или в «сэндвич»-режиме с тремя циклами ХТ, назначаемыми перед ЛТ, и тремя ее циклами после ЛТ. Все использованные варианты ХЛТ оказались хорошо переносимыми.
Изучению роли ЛТ и ХЛТ в адъювантном лечении РЭМ на ранних стадиях болезни посвящено довольно крупное исследование GOG-249 [33]. В него была включена 601 пациентка с I стадией серозного или светлоклеточного рака, либо со II стадией, либо с I стадией высокого промежуточного риска, определившегося как: a) возраст 70 лет с одним фактором риска; б) возраст 50 лет с 2 факторами риска; c) возраст 18 лет с 3 факторами риска. К факторам риска были отнесены поражение лимфатических сосудов, G 2 или 3, инвазия в миометрий >50%. Пациентки были рандомизированы либо в группу вагинальной брахитерапии с тремя циклами ХТ карбоплатином/паклитакселом либо в группу ДЛТ всего таза. Безрецидивная выживаемость, оцененная при 24-месячном наблюдении, не различалась между группами (82% для ДЛТ, 84% для ХЛТ).
Отсутствие пользы от ХТ в GOG-249 связывают с ее неадекватностью или тем обстоятельством, что некоторые биологические типы опухоли не чувствительны к ХТ. Например, имеются данные, свидетельствующие о том, что РЭМ с наличием мутации POLE хотя и представляет собой ЭАК G3, тем не менее имеет хороший прогноз и, следовательно, при нем не следует применять адъювантную ХТ [34]. Однако, поскольку опухоли с мутацией POLE составляют меньшинство (9,6% карцином эндометрия) [35], это вряд ли может служить объяснением отсутствия пользы от ХТ в GOG-249. Больные светлоклеточной аденокарциномой эндометрия имеют плохой прогноз, промежуточный между прогнозами эндометриоидных и серозных опухолей. Такие опухоли достаточно редки, и данные по их чувствительности к ХТ недостаточны, но они могут быть менее чувствительными, чем другие гистологические варианты [36], что может снизить эффективность адъювантной ХТ.
Перспективы
Текущие исследования фокусируются на применении ХТ, ЛТ или их комбинации у больных РЭМ с высоким риском развития рецидива. В международном исследовании PORTEC-3 больные РЭМ с высоким риском рандомизированы к применению ДЛТ или комбинации ДЛТ и ХТ. В исследовании GOG-258 сравниваются адъювантная ХТ и ЛТ в сочетании с ХТ. Результаты двух этих исследований ожидаются в ближайшем будущем.
В исследовании ENGOT-EN2-DGCG больные РЭМ с негативными ЛУ и высоким риском прогрессирования были рандомизированы для проведения адъювантной ХТ или наблюдения. Вагинальная брахитерапия необязательна в обеих группах.
Необходимо проведение исследований для установления роли лимфадэктомии при РЭМ. Международное исследование STATEC посвящено изучению значения лимфаденэктомии и адъювантной терапии больных РЭМ.
Трансляционная исследовательская группа trans-PORTEC фокусируется на выявлении биологических факторов, позволяющих оптимизировать отбор пациенток с РЭМ для проведения адъювантной терапии.
Заключение
В настоящее время во всех рекомендациях содержатся указания на целесообразность включения адъювантной химиотерапии в комбинированное лечение РЭМ для групп с плохим прогнозом, включая пациенток со стадиями IIIB или IIIC при любой гистологии и пациенток со стадиями IA (при инвазии миометрия), IB, II или IIIA при наличии серозной или светлоклеточной карциномы [4]. Для групп высокого промежуточного риска и в случае IВ-стадии ЭАК G3 (группа высокого риска) возможно ограничиться ДЛТ или брахитерапией. Тем не менее доказательств высокого уровня в отношении необходимости использования ХТ не существуют.
В заключение следует отметить, что РЭМ представляет собой серьезную проблему из-за роста его распространенности. А поскольку большинство больных РЭМ оперируются на первом этапе и часто удается диагностировать заболевание на начальных стадиях, вопрос об оптимальной адъювантной терапии имеет при данной патологии первостепенное значение.



