Введение
Пищевод Барретта (ПБ) остается одной из наиболее актуальных проблем современной гастроэнтерологии. Сейчас принято считать, что пищевод Барретта служит осложнением гастроэзофагеальной рефлюксной болезни (ГЭРБ), которое происходит при хроническом повреждении слизистой пищевода при контакте с компонентами рефлюксата [1, 2]. За последнее время внимание к проблеме ПБ увеличивается в связи с ростом аденокарциномы пищевода в Западной Европе и Северной Америке. За последние 40 лет заболеваемость раком пищевода в США выросла в 6 раз [3]. В связи с этим активно разрабатываются новые подходы к диагностике и лечению этой патологии [4]. Быстро прогрессируют эндоскопические методы ведения пациентов [5], но терапевтические аспекты лечения ПБ до сих пор остаются недостаточно ясными [6].
Материал и методы
Выполнено проспективное рандоминизированное исследование, в котором сопоставлена эффективность комбинированного лечения препаратами омепразол и Урсосан и монотерапии омепразолом ПБ лиц пожилого возраста в течение 5 лет. На первом этапе в исследование были включены 69 больных ПБ (37 мужчин и 32 женщины, средний возраст – 66,5 лет). Пациенты были рандоминизированы на две группы.
В группу А вошли 35 человек (19 мужчин и 16 женщин, средний возраст – 66,8 года). В группу В – 34 пациента (18 мужчин и 16 женщин, средний возраст – 66,2 года). Через 5 лет завершили исследование 31 пациент группы А (16 мужчин и 15 женщин) и 30 лиц группы В (16 мужчин и 14 женщин). Причинами выбывания из исследования были социально-экономические факторы, 4 пациента умерли. Расчет всех показателей в работе проведен исходя из числа людей, закончивших лечение через 5 лет. В начале работы средний индекс массы тела составлял у пациентов группы А 29,1±3,0, группы В – 28,6±3,1.
В исследование включены пациенты с морфологически верифицированным диагнозом ПБ. Еженедельную изжогу имели 87,1% пациентов группы А и 86,7% группы В. Эзофагит (эрозии или язвы пищевода) определены у 83,9% пациентов группы А и у 83,3% лиц группы В. Критерии исключения: наличие хронического гепатита и цирроза печени, хронических органических заболеваний кишечника, заболеваний сердечно-сосудистой системы и системы дыхания в терминальной стадии, онкологические заболевания.
Все пациенты группы А на протяжении 5 лет непрерывно получали ингибитор протонной помпы (ИПП) омепразол в дозе 20 мг 2 раза в сутки и препарат урсодезоксихолевой кислоты (УДХК) Урсосан в дозе 10 мг на кг веса в сутки. Пациенты группы В принимали только омепразол в дозе 20 мг 2 раза в сутки на протяжении 5 лет. Клинический контроль за самочувствием пациентов включал клинический осмотр с занесением результатов в стандартные анкеты, эзофагогастодуоденоскопию с забором биоптатов из слизистой нижней трети пищевода, морфологическое исследование слизистой пищевода до начала и после окончания исследования. По ходу работы клинический осмотр и эзофагогастодуоденоскопия выполнялись 2 раза в год.
Диагностика клинических проявлений ГЭРБ выполнена на основании рекомендаций Монреальского консенсуса [7]. Эзофагит классифицирован при помощи Лос-Анджелесской классификации 1994 г. [8]. Согласно Международным рекомендациям, под ПБ понимали цилиндрическую метаплазию в слизистой оболочке пищевода, верифицированную как кишечная метаплазия при морфологическом исследовании [5]. Во время эндоскопического исследования в соответствии с рекомендациями D. Armstrong [9] в случае смещения Z-линии и подозрения на наличие участков цилиндрического эпителия провели окрашивание 2,5%-ным раствором Люголя. Для этого подозрительный участок слизистой оболочки оросили красителем «прямым» способом (к месту исследования краситель вводили шприцем по полихлорвиниловому катетеру, проведенному через рабочий канал эндоскопа), промывали дистиллированной водой, оценивали результаты окрашивания, определяли место для взятия биопсии [10]. Взятие биопсийного материала осуществлено по 4-квадрантому методу, начиная в гастроэзофагеальном соединении и проксимально каждые 1–2 см к проксимальному краю слизистой, а также из любого подозрительного участка. Верификация диагноза ПБ осуществлена методом световой микроскопии после окраски гематоксилин-эозином при обнаружении в биоптатах пищевода кишечной метаплазии кишечного типа [11].
Результаты и обсуждение
Через 5 лет лечения у пациентов зарегистрирована отчетливая динамика снижения частоты изжоги в обеих группах. Тем не менее через 5 лет частота жалоб на еженедельную изжогу в группе А была в 2,8 раза ниже, чем в группе В (рис. 1). Аналогичная ситуация наблюдалась и для динамики еженедельной отрыжки. До начала лечения в группе А еженедельная отрыжка определялась у 61,3% пациентов, через 5 лет терапии – у 12,9% лиц (ОШ=9,53; 95% ДИ – 2,80–32,41; р<0,001), в группе В эти показатели равнялись 56,7 и 36,7% (ОШ=2,20; 95% ДИ – 0,79–6,08; р=0,2) соответственно. Через 5 лет лечения частота отрыжки в группе А была в 2,8 раза ниже, чем в группе В (ОШ=3,60; 95% ДИ – 1,05–12,39; р=0,06).
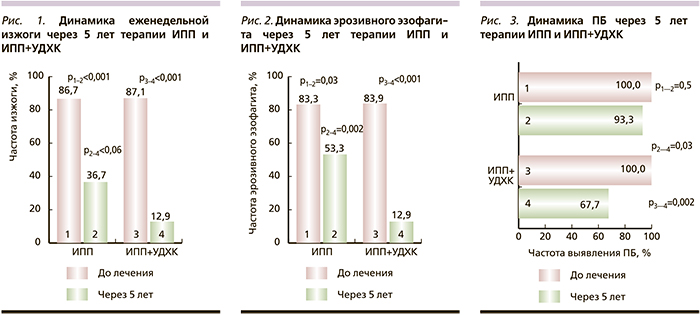
В обеих группах через 5 лет терапии зарегистрировано достоверное снижение частоты эзофагита. Но если в группе В частота эзофагита снижалась на 36%, то в группе А – на 84,6% (рис. 2). В группе, находившейся на монотерапии омепразолом, через 5 лет наблюдения достоверного снижения частоты ПБ не отмечено, тогда как у пациентов, получавших комбинацию омепразол+препарат УДХК, частота ПБ снижалась на 32,3% (рис. 3).
Принципиальное значение имеет профилактика развития дисплазии в слизистой пищевода. В обеих группах до начала лечения дисплазия не определялась. В группе В через 5 лет монотерапии омепразолом дисплазия возникла у 16,7% пациентов (ОШ=0,08; 95% ДИ – 0,00–1,44; р=0,06). В группе А через 5 лет наблюдения дисплазия не была диагностирована ни у одного из пациентов. При сопоставлении результатов, полученных к концу наблюдения, отличия частоты дисплазии в группах А и В приближались к достоверному уровню (ОШ=13,59; 95% ДИ – 0,72–257,49; р=0,06).
Патофизиология ГЭРБ в последние годы активно изучается. Некоторые исследователи указывают, что антибактериальная терапия может влиять на микробный статус пищеварительного тракта, состояние кислотопродукции в желудке, иммунные и нейрогуморальные механизмы, что способствует развитию ГЭРБ у некоторых пациентов и, возможно, ее осложнений [12, 13]. Большое внимание уделяется рефлюксу желчи как возможному предиктору ПБ. В экспериментальной работе, выполненной на крысах, дуодено-гастральный рефлюкс с щелочным рН вызывал дисплазию в пищеводе в 2,6 раза (р=0,02) и аденокарциному в 4,9 раза чаще (р=0,01), чем кислый рефлюкс [14]. В другой экспериментальной работе после создания модели развития ПБ одна из групп крыс получала УДХК в течение 40 недель, вторая – плацебо. К концу периода наблюдения в группе, получавшей УДХК, частота ПБ была ниже (p<0,05), рак пищевода не наблюдался, тогда как в группе плацебо было зафиксировано несколько случаев аденокарциномы (p<0,05). Количество УДХК в желчи было равно 32,7±11,4 ммоль/л в группе крыс, получавшей этот препарат, и 0,82±0,33 ммоль/л в группе плацебо (p<0,05) [15]. В клиническом исследовании показано, что желчный рефлюкс в пищевод увеличивает микроРНК 221 и 222, запускающих процессы карциногенеза пищевода [16]. В другой работе был обследован 21 человек с ПБ. Прием УДХК увеличивал содержание антиоксидантов и уменьшал интенсивность апоптоза в слизистой пищевода, что приводило к блокированию механизмов повреждения эпителия [17].
Следует подчеркнуть, что внимание к лечению ПБ в настоящее время огромно. Быстро развивается применение радиочастотной аблации лицами с дисплазией пищевода [18]. Дискутируются вопросы о роли длительного применения ИПП [19], комбинации ИПП и аспирина [20] для профилактики развития ПБ и аденокарциномы пищевода. В связи с этим предпринятое нами исследование безусловно актуально.
Заключение
В результате 5-летнего проспективного исследования мы обнаружили, что комбинация омепразола и УДХК (Урсосан) обладает более высокой эффективностью в лечении пациентов с ПБ и эзофагитом по сравнению с монотерапией омепразолом. Данный эффект объясняется снижением относительной доли гидрофобных желчных кислот в желчи и увеличением относительной доли УДХК, обладающей выраженным протективным действием, защищающим эпителий пищевода от развития ПБ и аденокарциномы.



