Среди хронических заболеваний печени, сопровождающихся метаболическими нарушениями, неалкогольный стеатогепатит (НАСГ) является наиболее значимым и часто встречающимся. Повышенный интерес к НАСГ обусловлен отсутствием достаточной информации о патогенезе заболевания и причинах его прогрессирования, распространенности в популяции и среди пациентов с заболеваниями печени, о взаимосвязи с нарушениями обмена веществ, состоянием пищеварения и биоценоза кишечника. В связи с этим отсутствуют алгоритмы (стандарты) диагностики и лечения НАСГ, что способствует незаметному прогрессированию воспалительно-деструктивного процесса в гепатоцитах с риском возможного развития цирроза печени и/или гепатоцеллюлярной карциномы, особенно при характерной для НАСГ скрытой клинической картине (“печень не болит”). Такие пациенты, как правило, годами не обращаются к врачу, и диагноз НАСГ обычно устанавливается случайно – при ультразвуковом исследовании (УЗИ) печени или биохимическом исследовании сыворотки крови, проводимых по причинам, не связанным с изучением функции гепатобилиарной системы. Это нарушает наши представления о “доброкачественном” течении неалкогольной жировой болезни (дистрофии) печени (НАЖБП), которая без диагностики, корректирующих рекомендаций и
лечения переходит в категорию прогрессирующих заболеваний печени.
Изучение патологии печени и развитие НАСГ особенно важны у больных, имеющих проявления инсулино-резистентности (ИР), сахарный диабет типа 2 (СД2), гиперлипидемию (с преобладанием триглицеридемии), ожирение, поскольку под влиянием одного или комплекса триггерных факторов (что чаще), происходит прогрессирующее повреждение печеночной ткани. Впервые поражение печени у больных СД изучал Frerichs в 1970-х гг., но лишь в 1980 г. Ludwig и соавт. сформулировали понятие НАСГ, наблюдая изменения в печени у больных ожирением и СД, не употребляющих алкоголь в гепатотоксических дозах. НАСГ представляет собой одну из стадий НАЖБП и является самостоятельной нозологической единицей. Термином НАСГ принято называть хроническое заболевание печени, развивающееся у пациентов, не употребляющих алкоголь в гепатотоксических дозах, и характеризующееся развитием крупнокапельно-го стеатоза и долькового воспаления печени [1, 7].
В настоящее время НАСГ рассматривается как поражение печени в рамках метаболического синдрома (МС), патогенетической основой которого является развитие ИР. ИР характеризуется снижением чувствительности тканевых рецепторов к эндогенному инсулину, вырабатываемому в повышенном или даже нормальном количестве, что приводит к развитию компенсаторной гиперинсулинемии [9, 13, 15]. Основные проявления МС – ожирение, гиперлипидемия, СД2, ассоциированы с формированием НАСГ. Патологическое ожирение в 65–80 % случаев сопровождается развитием НАСГ; СД2 обнаруживается у 25–75 %, гиперлипидемия – у 20–80 % больных НАСГ. У лиц с нормальной массой тела НАСГ встречается в 2,7–3,0 % случаев [10, 16].
Результаты эпидемиологических исследований не дают полного представления о распространенности НАСГ, т. к. чаще они проводятся в рамках одной популяции. По данным биопсии печени, частота встречаемости НАСГ составляет 1,2–4,8 % в Японии, 9–11 % в Европе и 20–32 % в Северной Америке. Такое расхождение данных, по-видимому, связано с социально-экономическими условиями и образом (традициями) жизни населения. Популяционные исследования позволяют предположить, что 60–80 % криптогенных циррозов печени являются исходами НАСГ [12]. По данным Вacon и соавт., на НАСГ приходится около 10 % от общего числа ежегодно выявляемых хронических гепатитов в США. Кроме того, известно, что до 40 % невирусных циррозов печени связаны с НАСГ. У тучных людей распространенность НАСГ выше и составляет 19 % [8]. При аутопсии Wanless и Lentz установили, что ожирение, СД2 или их сочетание имеются у 20 из 22 больных НАСГ [11]. Как правило, НАСГ развивается в возрасте 40–60 лет, однако в последние годы нередко диагностируется и у детей, чаще – у женщин (63–83 %), хотя существуют наблюдения, в которых среди больных НАСГ преобладали мужчины (58 %) [18].
Патогенез НАСГ сложен и до конца не изучен. Первоначальным и фоновым процессом в организме, запускающим избыточное накопление жира в печени, а затем и развитие воспалительных реакций, служит ИР. Среди причин развития ИР выделяют наследственные и экзогенные факторы – это гиподинамия, гиперкалорийное питание, избыточный бактериальный рост в кишечнике с явлениями эндотоксемии [15]. Влияние на прогрессирование ИР оказывают также гормоны жировой ткани и активные вещества, регулирующие чувствительность инсулинорецепторов, – лептин, адипонектин, резистин, висфатин, фактор некроза опухоли α (ФНО-α) и свободные жирные кислоты (СЖК), продукция которых повышается в результате увеличения массы висцерального жира, усиления липолиза и активации клеток Купфера бактериальными токсинами из воротной вены. На фоне ИР в результате выраженного дисбаланса между СЖК и глюкозой в сыворотке крови отмечаются рост концентрации СЖК, гиперинсулинемия, что приводит к торможению скорости β-окисления СЖК в печени и, следовательно, накоплению жира в печени в виде триглицеридов [20, 21]. Этот процесс приводит к развитию начальных морфологических деструктивных изменений ткани и в рамках “теории двух ударов” прогрессирования НАЖБП, а также НАСГ, в 1998 г. предложенной Day и James, представляет собой “первый удар”, увеличивающий чувствительность печени к предполагаемому “второму удару”. В качестве основного процесса “второго удара” был рассмотрен оксидативный стресс, связанный с индукцией цитохрома Р450 2Е1 (CYP2E1) и цитокинов, главным образом ФНО-α, действие которых приводит к повреждению гепатоцитов, воспалению и фиброзу. Накапливаясь главным образом в митохондриях, СЖК нарушают энергетический потенциал клетки, разобщая окислительное фосфорилирование, способствуя снижению синтеза АТФ в дыхательной цепи и повышению уровня реактивных форм кислорода (РФК). РФК активируют перекисное окисление липидов, продукты которого усиливают прямые цитотоксичные эффекты реактивного кислорода – индукцию апоптоза гепатоцитов, хемотаксис нейтрофилов, цитотоксические иммунные реакции и секрецию цитокинов (ФНО-α, интерлейкины 6 и 8, трансформирующий фактор роста β и др.), гибель гепатоцитов, формирование фиброза и цирроза печени [14, 19, 22].
Среди сопутствующей патологии у пациентов с НАЖБП часто диагностируются различные заболевания желчевыводящих путей, которые нередко служат причиной клинических симптомов билиарной диспепсии. Частота встречаемости дисфункции желчного пузыря (ЖП) у таких больных составляет в среднем 30 %. Желчекаменная болезнь (ЖКБ) выявляется у 10–15 % пациентов с НАСГ, при этом отмечается тенденция к ее увеличению. У лиц с СД2 ЖКБ встречается в 17,6 %, с избыточной массой тела – в 64,7 %, с ожирением – 91,5 % случаев. Холестероз стенок ЖП выявляется при УЗИ у 55 % пациентов с НАЖБП. По-видимому, это связано с изменением метаболизма липидов в печени, нарушением процессов желчеобразования и желчевыделения, в результате чего нарушается абсорбция и в стенке ЖП накапливаются эфиры холестерина из желчи. Желчеобразование – главный путь выделения холестерина из организма. Известно, что до 90 % холестерина выводится с желчью в виде желчных кислот и эфиров холестерина. Снижение интенсивности холатообразования и экскреции компонентов желчи в желчевыводящие пути приводит к дислипидемии. Изменение функций гепатоцитов при НАСГ приводит к формированию неполноценных желчных мицелл с повышением уровня холестерина и сниженным содержанием фосфолипидов и желчных кислот, что способствует повышению литогенности желчи и уменьшению ее концентрационной способности. Изменение концентрации и соотношения липопротеидов сыворотки крови, гиперхолестеринемия, повышение концентрации холестерина в желчи и увеличение абсорбции холестерина слизистой оболочкой ЖП, нарушение его моторно-эвакуаторной функции приводят к развитию ЖКБ. Слизистая оболочка ЖП секретирует гормон, ингибирующий холецистокинин, участвующий в регуляции желчеобразования. Дефицит холецистокинина, наличие литогенной желчи, абсорбция ее компонентов слизистой оболочкой ЖП приводят к развитию холестероза [2].
Все вышеизложенное диктует необходимость создания новых лекарственных средств. К числу препаратов, улучшающих функциональное состояние печени, относится Гепабене (ratiopharm, Германия) – комбинированный препарат растительного происхождения. Гепабене содержит экстракт расторопши пятнистой (Fructus Silybi mariani) со стандартизированным количеством флавоноидов (50 мг силимарина, не менее 22 мг силибинина), а также экстракт дымянки аптечной (Fumaria officialis), содержащий не менее 4,13 мг ее алкалоидов в пересчете на протопин.
Лечебные свойства Гепабене определяются оптимальным сочетанием экстракта расторопши пятнистой, который оказывает гепатопротекторное действие, и экстракта дымянки аптечной, нормализующего секрецию желчи и моторику желчевыводящих путей [2, 3].
Растительный флавоноидный комплекс, выделенный из плодов и млечного сока расторопши пятнистой, содержит изомерные соединения полигидроксифенолхроманонов, главными из которых являются силимарин, силибинин, силидиадин и силихристин. Гепатопротекторное действие силимарина обусловлено его антиоксидантными, мембраностабилизирующими и стимулирующими репаративный потенциал печеночных клеток свойствами.
К их числу относятся [4]:
• защита биологических мембран от токсинов в результате ингибирования их захвата гепатоцитами,
стабилизации клеточных мембран и включения в них фосфолипидов (репарация мембран);
• повышение обезвреживающей функции гепатоцитов, связанное с увеличением пула глутатиона в гепатоците и возрастанием активности ферментов, участвующих в окислении ксенобиотиков (в частности, супероксиддисмутазы);
• антиоксидантное действие, обусловленное связыванием свободных радикалов, торможением реакций избыточного перекисного окисления липидов в результате ингибирования фермента липооксигеназы, снижения содержания малонового диальдегида и уменьшения расхода глутатиона;
• антифибротическое действие, связанное с влиянием на трансформирующий фактор роста β и экспрессию генов матрикса в стеллатных клетках (клетках Ito), а также с повышением клиренса свободных радикалов и непосредственным подавлением синтеза коллагена;
• повышение белково-синтетической функции печени;
• ингибирование синтеза холестерина в результате уменьшения активности микросомальной гидроксилметилСоА-редуктазы;
• противовоспалительное и иммуно-модулирующее действие, обусловленное уменьшением активности макрофагальных клеток, участвующих в презентации антигенов.
Основным действующим веществом дымянки лекарственной является производное фумаровой кислоты – алкалоид протопин. Он увеличивает желчевыделение, активизирует продукцию холецистокинина и секретина, что в свою очередь повышает секрецию воды и бикарбонатов эпителием желчных протоков, приводит к сокращению ЖП, ослаблению тонуса сфинктера Одди и беспрепятственному поступлению желчи в кишечник. Таким образом, протопин эффективно восстанавливает дренажную функцию желчевыводящих путей, предупреждая развитие застоя желчи и образование конкрементов в ЖП. Кроме того, через механизм обратной связи он уменьшает всасывание холестерина в кишечнике, его синтез в печени и секрецию в желчь, что уменьшает литогенность желчи [5].
На клинической базе кафедры пропедевтики внутренних болезней и гастроэнтерологии МГМСУ в ЦКБ № 1 ОАО РЖД было проведено открытое неконтролируемое клиническое исследование эффективности и безопасности препарата Гепабене в лечении больных НАСГ.
Материал и методы
В исследование были включены 43 больных НАСГ различной степени активности, из них 17 (39,5 %) мужчин и 26 (60,5 %) женщин в возрасте от 30 до 70 лет (средний возраст – 52,4 ± 8,1 года). Из них у 34 (79 %) зарегистрирована избыточная масса тела или ожирение (индекс массы тела – ИМТ > 25 кг/м2), у 9 (21 %) выявлен СД2. Сахароснижающие препараты (Диабетон, Манинил) принимали 5 больных, остальные придерживались лишь диеты. У 38 (88,4 %) пациентов была выявлена сопутствующая патология желчевыводящих путей: дисфункция желчевыводящих путей – у 21 (55,3 %), ЖКБ – у 8 (21,0 %), холецистэктомия – у 7 (18,4 %), постхолецистэктомический синдром – у 2 (5,3 %).
Диагноз НАСГ устанавливался после изучения жалоб пациентов, анамнеза заболевания и жизни, объективных и лабораторно-инструментальных данных:
1. Отсутствие указаний по поводу злоупотребления алкоголя (более 40 г чистого этанола в сутки).
2. Длительное и необъяснимое повышение активности АСТ и АЛТ.
3. Наличие факторов риска (ожирения, СД2, дислипидемии).
4. Отсутствие стигм алкогольной болезни печени, аутоиммунных проявлений, печеночно-клеточной недостаточности и цирроза печени, наследственных метаболических расстройств, вирусных и аутоиммунных гепатитов, болезни Вильсона, гемохроматоза.
5. Признаки жировой дистрофии печени – повышенная эхогенность паренхимы, “размытый” сосудистый рисунок, нечеткая визуализация диафрагмального контура органа, гепатомегалия; признаки жировой дистрофии гепатоцитов, стеатонекроза и долькового воспаления по данным морфологического исследования биоптата печени.
Критериями включения в исследование были подтвержденный диагноз НАСГ, возраст – 30–70 лет, ИМТ более 25 кг/м2, повышение уровня триглицеридов в сыворотке крови (выше 1,7 ммоль/л), уменьшение содержания холестерина липопротеидов высокой плотности (ЛПВП) менее 1,0 ммоль/л, наличие ИР или СД2, признаки жировой дистрофии печени, выявляемые при УЗИ; признаки стеатогепатита, обнаруженные при гистологическом исследовании биоптата печени.
Всем пациентам проведена немедикаментозная терапия, которая включала диету, режим питания и физические упражнения. В качестве медикаментозной терапии назначен препарат Гепабене по 2 капсулы 3 раза в день во время еды в течение 4 недель.
В план обследования больных входил сбор жалоб, анамнеза, объективного статуса. Проведена оценка основных клинических синдромов (астеновегетативного, диспепсического, болевого, ИМТ); биохимических показателей сыворотки крови (изменение маркеров цитолиза, холестаза, липидного и углеводного спектров); ультразвуковых параметров (размеры и эхогенность печеночной паренхимы, сосудистый рисунок и сократительная функция ЖП). Переносимость терапии оценена на основании анализа возникших на фоне лечения нежелательных явлений.
Результаты и обсуждение
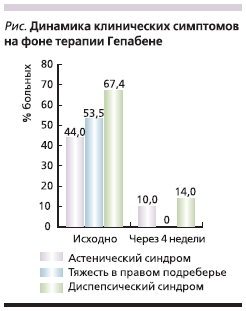
До приема препарата астеновегетативный синдром с наличием слабости, утомляемости и нарушения сна наблюдался у 44 % (n = 19) пациентов. Болевой синдром в виде дискомфорта ноющего характера и/или тяжести в правом подреберье отмечали 53,5 % (n = 23). Диспептический синдром, характеризующийся наличием тошноты, горечи во рту, отрыжки, изжоги, метеоризмом, выявлен у 67,4 % (n = 29).
В результате приема Гепабене у подавляющего большинства пациентов отмечено субъективное улучшение самочувствия на 14-й день лечения, у 2 (5,0 %) больных изменений самочувствия не наблюдалось. У 89,5 % (17 из 19) пациентов исчез астенический синдром, у всех больных купировались тяжесть и/или боль в правом подреберье, у 86,2 % (25 из 29) исчезли симптомы диспепсии (см. рисунок).
В исследовании доля больных с ИМТ > 25, но < 30 кг/м2 составила 85 % (n = 29), с ожирением 1-й степени (ИМТ – 30,0–34,9 кг/м2) – 15 % (n = 5). Проведенная терапия не вызвала достоверного снижения ИМТ. До лечения ИМТ составил 26,8 ± 1,0, после лечения – 24,3 ± 0,7 кг/м2 (р > 0,05). При соблюдении рекомендаций относительно диетического питания и выполнения физических упражнений у 32 % (n = 11) пациентов отмечено снижение массы на 2 кг.
У всех больных до начала терапии выявлено наличие цитолитического синдрома: АСТ – 97,0 ± 11,5 ЕД/л, АЛТ – 1 24,0 ± 28,4, γ-глутаматтранспептидаза (ГГТП) – 85,6 ± 10,3, щелочная фосфатаза (ЩФ) – 108,2 ± 15,4 ЕД/л (р < 0,01). Повышение уровня сывороточного билирубина в среднем до 23,4 ± 4,5 мкмоль/л определено у 24 (56 %) больных (р < 0,05). Исходно до лечения у всех наблюдаемых пациентов обнаружены нарушения показателей липидограммы в виде повышения концентрации общего холестерина до 8,3 ± 0,7 ммоль/л, триглицеридов – до 2,3 ± 0,3, холестерина липопротеидов низкой плотности (ЛПНП) – до 7,2 ± 0,4, снижение концентрации холестерина ЛПВП – до 0,93 ± 0,07 ммоль/л (р < 0,01). При оценке изменений биохимических показателей на фоне проводимой терапии наблюдается достоверное снижение активности сывороточных ферментов (см. таблицу). После 4 недель приема препарата активность АЛТ снизилась с 3,0 до 1,5 нормы у 96,4 % пациентов, АСТ – у 93,4 %, ГГТП – у 94,8 %; общий билирубин нормализовался у 97,8 % (р < 0,05). У 27 (63 %) больных отмечена нормализация уровня триглицеридов (р < 0,05). У 38 (88,3 %) пациентов достигнуто снижение уровня холестерина и холестерина ЛПНП в сыворотке крови, однако динамика этих показателей оказалась статистически недостоверной.
Таблица. Динамика биохимических показателей сыворотки крови на фоне лечения Гепабене.
При УЗИ органов брюшной полости у всех пациентов наблюдались увеличение размеров печени, повышение эхогенности ее паренхимы по сравнению с почкой, “яркая печень”, затрудненная визуализация сосудистого рисунка. Выраженность стеатоза у 11 (26 %) больных определялась как минимальная, у 22 (51,1 %) – как умеренная, у 10 (23,2 %) – как значительная. Увеличенная селезенка обнаружена у 8 (19 %) пациентов. Допплерография портального и селезеночного кровотока не претерпела существенной динамики. Изменения билиарной системы в виде нарушения функции ЖП и сфинктера Одди определялись у 72 % (n = 31) больных. При исследовании функции ЖП методом УЗИ у 12 (28 %) больных она была нормальной, у 17 (39,5 %) обнаружена гипокинетическая дискинезия, у 14 (33 %) – гиперкинетическая. По окончании курса лечения, согласно результатам УЗИ печени, достоверно значимо изменились только ее размеры: исходно они были увеличены и составили в среднем 187,0 ± 18,6 мм, а после лечения снизились до 143,4 ± 7,6 мм (р < 0,01) у 37 (86 %) пациентов. Наблюдалось снижение выраженности жировой инфильтрации печени, проявившееся в возможности визуализации сосудов у 8 (18 %) больных, появлении однородности структуры паренхимы печени у 13 (30 %), у 4 (9,3 %) пациентов отмечено уменьшение спленомегалии. По данным УЗИ, сократительная функция ЖП нормализовалась в 70 % случаев: у 11 (26 %) функция ЖП нормализовалась при его исходной гипотонии и у 8 (18,6 %) – при гипермоторной дискинезии.
Проведенное исследование показало, что переносимость препарата Гепабене хорошая. Из побочных эффектов терапии имели место нарушения дефекации (частота до 3 раз в сутки, кал кашицеобразный,необильный) у 5 пациентов (11,6 %); аллергическая реакция в виде кожного зуда зарегистрирована у 1 пациента, что потребовало отмены препарата.
Таким образом, лечение НАСГ с использованием растительного препарата Гепабене, обладающего комплексом клинических эффектов – восстановление функции гепатоцитов и нормализация оттока желчи, приводит к быстрому улучшению общего состояния больных, снижению выраженности клинических, объективных признаков заболевания, лабораторных и инструментальных показателей. Препарат эффективно восстанавливает моторно-эвакуаторную функцию билиарного тракта, хорошо переносится пациентами и может быть рекомендован для применения в комплексной терапии больных, страдающих НАСГ, особенно при сопутствующей патологии желчевыводящих путей.



