Современная медицина достигла больших успехов в профилактике и лечении различных заболеваний во многом благодаря наличию высокоэффективных лекарственных средств, число которых увеличивается день ото дня. Но за последние десятилетия возросла и частота осложнений от лекарств. Причиной являются широко распространенная полипрагмазия, не всегда обоснованное назначение терапии и наконец самолечение.
Побочное действие лекарственных средств может проявляться как при передозировке лекарств, так и при их использовании в терапевтических дозах. Передозировка лекарств бывает абсолютной (при приеме большой дозы) и относительной (доза терапевтическая, а концентрация в крови и клетках слишком велика в связи с особенностями фармакокинетики препарата у данного больного). Осложнения, не связанные с передозировкой, могут быть первичными, т. е. связанными с прямым воздействием на определенные органы и ткани, или вторичными (косвенными), не обусловленными прямым воздействием препарата на данные органы и ткани. Например, нестероидные противовоспалительные средства (НПВС) оказывают прямое раздражающее действие на слизистую оболочку желудочно-кишечного тракта (ЖКТ) и вызывают тошноту, рвоту, образование эрозий на слизистой оболочке желудка. Поэтому применять их следует после еды. Это первичное побочное действие НПВС. Оказывая влияние на ферменты почек, эти препараты задерживают натрий и воду в организме. Появление отеков – это вторичное или косвенное действие ненаркотических анальгетиков.
Большинство лекарственных препаратов, применяемых перорально, оказывают влияние на слизистую оболочку полости рта и ЖКТ, которое в ряде случаев оказывается негативным. Могут наблюдаться такие побочные эффекты, как разрушение эмали зубов, стоматит, желудочно-кишечные расстройства – раздражение слизистой оболочки, тошнота, ощущение вздутия живота, потеря аппетита, запор или понос, нарушение пищеварения. Некоторые лекарственные средства могут стимулировать выделение соляной кислоты, замедлять выработку защитной слизи или тормозить процессы естественного обновления слизистой оболочки, что создает предпосылки к образованию изъязвлений. Такой эффект называют ульцерогенным (от англ. ulcer – язва), им обладают гормоны коры надпочечников группы кортикостероидов (глюкокортикостероиды – ГКС), анальгетики, средства с выраженной противовоспалительной активностью, кроме того, оказывающие обезболивающее и жаропонижающее действия (НПВС), а также резерпин, тетрациклин, кофеин и др.
Желудок является органом, который наиболее часто повреждается при применении ульцерогенных медикаментов. Структурные изменения слизистой оболочки и функциональные нарушения, возникающие при этом, обозначаются термином “синдром острого повреждения желудка” и включают: 1) поверхностные множественные эрозии с низким риском развития кровотечения; 2) глубокие единичные или множественные язвы с высоким риском геморрагических осложнений [2, 23]. Эрозивно-язвенные поражения (ЭЯП) возникают среди 40–100 % больных, из них клинически значимые кровотечения – у 25–30 % [2, 18]. По данным C. Wilcox и соавт., при эндоскопическом исследовании, проведенном в пределах 18 часов от поступления и через определенные интервалы в течение наблюдения, у 74 % больных, находившихся в палатах интенсивной терапии, имелось повреждение слизистой оболочки желудка (СОЖ) или двенадцатиперстной кишки (ДПК) и только у половины из них не было признаков кровотечения [23].
В патогенезе медикаментозных (по сути ятрогенных) изъязвлений, как и других желудочных ЭЯП, основная роль принадлежит несоответствию факторов агрессии и защиты СОЖ. К внутрипросветным эндогенным повреждающим субстанциям относятся соляная кислота, пепсин и забрасываемые в желудок желчь, а также панкреатические ферменты. Важная роль в повреждении СОЖ принадлежит гематогенным эндогенным повреждающим факторам, к которым относятся провоспалительные и вазоактивные медиаторы, продукты нарушенных метаболических процессов в организме (мочевина, мочевая кислота и др.) и ряд экзогенных повреждающих субстанций (вирусы, бактерии, их токсины и др.), поступающие в организм, минуя ЖКТ. Повреждающее действие медикаментов на СОЖ может реализоваться как эндо-, так и экзогенным путями.
Под влиянием медикаментов и их метаболитов в СОЖ нарушается ход обменных процессов, что приводит к появлению новых биологических субстратов, оказывающих деструктивное действие на ткани [11], наблюдаются следующие процессы, способствующие повреждению СОЖ:
- Падение трансмембранного потенциала поверхностного эпителия, способствующего обратной диффузии водородных ионов в СОЖ.
- Деградация пристеночной слизи и повреждение поверхностного эпителия СОЖ.
- Индукция синтеза провоспалительных субстанций в СОЖ.
- Блокада продукции противовоспалительных тканевых простагландинов и АТФ.
- Активация тканевых фосфолипаз.
- Активация перекисного окисления липидов в эпителии СОЖ.
- Нарушение кровотока и сосудистой проницаемости в СОЖ.
В норме желудочная цитопротекция включает большой спектр внутрипросветных и тканевых механизмов, взаимодействие которых обеспечивает целостность СОЖ и ее устойчивость к факторам агрессии. Слизистый протективный барьер желудка имеет три линии защиты [22]. Первая линия включает слизь, желудочную и дуоденальную секрецию бикарбонатов, гидрофобную поверхность СОЖ и ДПК. Слизь представляет собой водонерастворимый гель, тесно прилегающий к поверхности эпителиальных клеток. В ее состав входят иммуноглобулин А (IgA), лизоцим, лактоферрин и другие компоненты. Слой слизи защищает СОЖ от физических и химических воздействий, действия соляной кислоты и пепсина, бактерий, вирусов и их токсинов. Секреция бикарбонатов уменьшает агрессивные свойства соляной кислоты и повышает уровень рН защитного слоя слизи.
Вторую линию защиты СОЖ составляет эпителиальный барьер. Апикальные, боковые поверхности покровного желудочного эпителия и межклеточные соединения в обычных условиях устойчивы к обратной диффузии Н+ благодаря наличию на базолатеральных поверхностях клеток двух транспортных систем, удаляющих водородные ионы из СОЖ. Целостность данного барьера регулируется эндогенными факторами роста, одним из которых является трансформирующий фактор роста α. В состав данного барьера также входят тканевые субстанции, содержащие сульфгидрильные группы (глутатион- и тиолсодержащие протеины), которые являются мощным естественным антиоксидантом, ловушкой для свободных радикалов водорода и кислорода, включая экзогенные, поступающие со слюной и пищей. Определенная роль в поддержании второй линии защиты принадлежит компонентам врожденного и адаптационного иммунитета (Toll-подобные рецепторы, антибактериальные пептиды, αи β-дефенсины, IgA), обеспечивающим устойчивость СОЖ к внедрению патогенных бактерий, вирусов и их токсинов.
Третья линия защиты представляет собой адекватный кровоток, который способствует поддержанию нормальной трофики СОЖ, удалению Н+, обеспечивает энергией метаболические процессы, поддерживает первую и вторую линии защиты, а также репаративные процессы в СОЖ.
В настоящее время в гастроэнтерологии принято выделять язвенную болезнь (ЯБ) как самостоятельно протекающее заболевание и симптоматические гастродуоденальные язвы (В.Х. Василенко, 1970; А.В. Калинин, 1986), имеющие конкретный, установленный этиологический фактор, приведший к их образованию. Лекарственные поражения СОЖ являются вариантом симптоматических изъязвлений верхних отделов ЖКТ и составляют 20–23 % от числа всех вторичных ЭЯП ЖКТ. По данным некоторых авторов, лечение ацетилсалициловой кислотой провоцирует желудочно-кишечное кровотечение в 50 % случаев, индометацином – в 30 %, диклофенаком – в 26 %, ГКС – в 14 (А.А. Пономарев и соавт., 2003).
Количество потребляемых медикаментов, в т. ч. ульцерогенных, возросло во всем мире. Особенно это характерно для лиц пожилого возраста, часто принимающих лекарственные средства без врачебного контроля. К настоящему времени выявлены препараты, вызывающие образование гастродуоденальных язв, и число их постоянно растет: НПВС (ацетилсалициловая кислота, индометацин, фенилбутазон, ибупрофен и др.) и их производные, антикоагулянты, некоторые антибиотики (клиндамицин, тетрациклины, особенно доксициклин, эритромицин), ГКС, цитостатические средства, антигипертензивные препараты (резерпин, вазопрессин), соли золота, колхицин, кофеин, фтор, хлорид калия, соли железа, препараты наперстянки, производные нитрофуранового ряда, толбутамид, этакриновая кислота и др.
Принято считать, что в группу хронических гастродуоденальных язв, вызванных медикаментозными средствами, можно отнести лишь те, при которых твердо устанавливается причинно-следственная зависимость от длительного приема. Причем при приеме ульцерогенных препаратов не стоит ожидать обязательного развития язвенного дефекта; у многих больных поражение ЖКТ при их длительном применении может ограничиваться развитием острого эрозивного гастрита или гастродуоденита. Большинство ульцерогенных лекарственных средств вызывают острые язвы, в то время как при заболеваниях, требующих их применения, чаще образуются хронические язвы, тем не менее по клинической картине отличающиеся от ЯБ.
В медицинской литературе достаточный объем информации можно, к сожалению, найти только о гастропатиях и язвах, ассоциированных с НПВС. Многие препараты группы НПВС (т. н. безрецептурные препараты, такие как ацетилсалициловая кислота, метамизол натрия и ибупрофен) широко применяются как по назначению специалистов, так и самостоятельно. Увеличение в последние десятилетия числа пациентов пожилого возраста с развитием дегенеративных заболеваний суставов и иных патологических процессов, требующих приема НПВС, соответственно, вызывает учащение развития побочных эффектов и осложнений. Большинство препаратов группы НПВС, являющихся слабыми кислотами, в кислой внутрижелудочной среде приобретают способность проникать через липидные мембраны эпителиоцитов. В щелочной внутриклеточной среде НПВС переходят в ионизированную форму, локально накапливаются в относительно высокой концентрации, оказывают повреждающее действие на клетки. Известно, что производные эноликовой и индолуксусной кислот как наиболее “кислотные” препараты группы НПВС наиболее часто вызывают побочные эффекты со стороны ЖКТ. Одним из негативных эффектов локального действия НПВС может быть увеличение проницаемости клеточных мембран, что способствует развитию обратной диффузии ионов водорода. Клеточный ацидоз и последующие изменения метаболизма эпителиоцитов являются характерным проявлением пептического повреждения, приводящего к активации болевых рецепторов, расположенных в подслизистой оболочке [21]. О значимости данного механизма для патогенеза НПВС-ассоциированной диспепсии можно судить по высокой эффективности при этой патологии препаратов, влияющих на желудочную секрецию.
Ульцерогенный эффект ГКС также достаточно известен и освещен в литературе. Значительно меньшее внимание уделяется развитию ЭЯП ЖКТ при приеме других медикаментов. Например, резерпин и другие препараты раувольфии также относят к опасным в ульцерогенном отношении лекарствам, хотя статистических данных об этом в литературе немного. В 1993 г. А.Н. Хорев в своих работах указывал, что резерпин и его производные были причиной гастродуоденальных кровотечений среди 20 % наблюдаемых им больных, систематически принимавших эти препараты. После приема резерпина признаки поражения слизистой оболочки ЖКТ появляются через 12–18 часов. По скорости возникновения, характеру течения, локализации и морфологической картине эти повреждения напоминают возникающие при введении гистамина, фенилбутазона и атофана. Ульцерогенный механизм действия резерпина и его производных до конца не изучен, однако известно, что он высвобождает катехоламины и серотонин, которые влияют на сосуды желудка, вызывая их спазм, и снижают защитные свойства СОЖ.
Эти процессы протекают на фоне усиления кислотовыделительной активности желудка и нарушения обратной диффузии ионов водорода через СОЖ. Профилактика и лечение язв, вызванных резерпином, имеют свои особенности. Применение центральных холинолитиков, ганглиолитиков, прерывающих рефлекторную дугу в различных ее звеньях, не предотвращает язвообразования, обусловленного употреблением резерпина. В большинстве случаев желательно отказаться от применения данного препарата как антигипертензивного средства и назначить ингибиторы кислотопродукции.
Хлорид калия также повреждает слизистую оболочку верхних отделов ЖКТ, обладает некротизирующим эффектом. При приеме плохо растворимых форм происходит их фиксация на слизистой оболочке с последующим химическим некрозом ее участков. Образующиеся дефекты могут быть поверхностными или глубокими и осложняться кровотечением.
Кофеин стимулирует секрецию желудка и способствует развитию язв желудка, которые часто осложняются кровотечением и перфорацией. Язвы чаще возникают у людей, употребляющих кофе вне связи с едой и в больших количествах. Особенно опасно употребление необработанного кофе, содержащего повышенное количество гидрокситриптамида карбониевой кислоты.
Колхицин – алкалоид, оказывающий повреждающее действие вследствие токсического влияния на СОЖ. Особенно этот эффект выражен у пациентов с нарушением функции печени и почек. Механизм повреждения заключается в цитостатическом действии на желудочный эпителий вследствие подавления полимеризации тубулина и изменения полярности эпителиальных клеток. При световой микроскопии эпителия после приема колхицина определяются многочисленные митозы, остановившиеся в метафазе. Следствием этого является ослабление барьерной функции СОЖ и процессов регенерации [1].
Аналогичное ульцерогенное действие оказывает фтор. Хроническая интоксикация фтором в 5–6 раз увеличивает частоту эрозивных поражений СОЖ и ДПК вследствие угнетения иммунной системы. Аналогичные изменения в слизистой оболочке появляются у пациентов, длительное время принимающих лекарственные препараты, в своем составе содержащие кристаллы алюминия, кальция и хлора.
Пациенты, принимающие препараты железа, часто жалуются на дискомфорт в эпигастральной области, тошноту, рвоту. Эндоскопическая картина при исследовании таких больных представлена очаговой гиперемией СОЖ, эрозиями, язвами, субэпителиальными геморрагиями. Микроскопически выявляется гиперплазия слизистой оболочки вплоть до развития гиперпластических полипов. Так как железо является агрессивным веществом, которое действует на слизистую оболочку местно, увеличение дозы препарата часто приводит к развитию ее инфарктоподобных изменений вплоть до некроза. Кристаллы железа повреждают верхний слой эпителия (“инкрустируют” его), накапливаются в грануляционной ткани, собственной пластинке, клетках стромы, макрофагах и даже в стенках сосудов. При специальной окраске на железо в СОЖ определяется золотисто-коричневый пигмент. Эти изменения необходимо дифференцировать с гранулярным сидерозом, который обычно ассоциируется с системной перегрузкой железом или гемохроматозом. Изменения в слизистой оболочке у пациентов, длительно принимающих препараты железа, обычно исчезают только через 2–4 года после их отмены. Ассоциированные с железом повреждения СОЖ могут быть обнаружены у пациентов с нарушениями желудочной моторики и даже у здоровых людей. Механизм таких изменений до конца не ясен, но, возможно, при “переполнении” каналов физиологического транспорта железа происходит накопление продуктов его окисления, которые и вызывают описанные повреждения.
Кальциноз СОЖ представляет собой мелкие темно-розовые и частично кальцифицированные кристаллы, которые обычно обнаруживают под эпителием в антральном отделе желудка. Эти изменения, как правило, сопровождаются гиперплазией ямочного эпителия различной степени и отеком. Кальциноз чаще обнаруживают у пациентов, перенесших ортотопическую трансплантацию различных органов, или у больных с хронической почечной недостаточностью, которые получают антациды, содержащие алюминий, или сукральфат. J.K. Greenson и соавт. [19] показали, что кристаллы при кальцинозе содержат алюминий, фосфор, кальций и хлор. Компонент сорбитола каэксалат, который раньше использовался для коррекции гиперкалиемии при почечной недостаточности, обусловливает ЭЯП верхних отделов пищеварительного тракта, а также вызывает ишемический колит с некрозом слизистой оболочки толстой кишки, на которой определяются кристаллы; в ряде случаев их обнаруживают в экссудате язв и эрозий.
Химиотерапевтические средства (митомицин С, 5-фтор-2-деоксиуридин, флоксуридин) также вызывают изменения СОЖ. В ряде случаев бывает сложно дифференцировать ятрогенные изменения от аденокарциномы. Химиопрепараты вызывают язвообразование, формирование атипии эпителия –преимущественно в основании желез. Позже развивается выраженная эозинофильная инфильтрация, вакуолизация, появляется большое количество многоядерных клеток. Аналогичные изменения могут быть обнаружены в эндотелиальных клетках и фибробластах.
Так как злоупотребление алкоголем приобретает все большие масштабы, нельзя забывать о повреждающем действии этанола на СОЖ. В литературе есть сведения о прямой зависимости морфологических и функциональных повреждений желудка от стадии алкоголизма. Прием больших доз алкоголя может вызывать острый геморрагический эрозивный гастрит и дуоденит. В основе поражения СОЖ лежат нарушения микроциркуляции (резкое артериальное и артериолярное расширение, а также резкое венозное сокращение) и проницаемости; дегенерация и поверхностная десквамация эпителия; расширение ворсин; отек; нейтрофильная инфильтрация и интерстициальные геморрагии. Деструкция сосудов наблюдается преимущественно в железистой зоне СОЖ, где в дальнейшем образуются эрозии и язвы. В возникновении изъязвлений СОЖ при длительном приеме алкоголя большое значение придается снижению синтеза простагландина Е2 и торможению им секреции гликопротеинов желудочной слизи.
Лекарственные препараты, обладающие повреждающим действием на СОЖ, чаще применяются при лечении тяжелых, хронических заболеваний, таких как обменные нарушения, коллагенозы, артериальная гипертензия, инфаркт миокарда и др., которые имеют в своей основе поражение многих систем организма, в т. ч. нейроэндокринной и иммунной. Поэтому лечащий врач, работающий с пациентами, страдающими подобными заболеваниями, при назначении ульцерогенных лекарственных препаратов должен учитывать сложные, многокомпонентные механизмы их фармакодинамики.
Несмотря на неоднозначность механизмов развития побочных эффектов со стороны СОЖ при использовании ульцерогенных медикаментов, их проявления имеют общие черты. Чаще всего они возникают остро, локализуются преимущественно в желудке, носят множественный характер, сочетаются с эрозиями. Симптоматика изъязвлений неоднородна и зависит от многих факторов. Она всегда сочетается с симптомами основного заболевания и часто маскируется ими. Клинически медикаментозные язвы нередко протекают бессимптомно, даже если они являются рецидивом ЯБ, и часто осложняются кровотечением, которое может проявиться внезапно –без предшествующих симптомов. Вероятность образования медикаментозных язв увеличивается при применении высоких доз препаратов, их комбинаций, при длительном использовании, особенно у пациентов с тяжелым течением фонового заболевания. Неосложненные язвы, как правило, протекают почти бессимптомно. У некоторых больных их возникновение сопровождается изжогой, чувством дискомфорта, тошнотой, отрыжкой и болями в эпигастральной области. Появление этих симптомов у пациента, ранее не страдавшего заболеваниями желудка и кишечника, должно насторожить врача в отношении возникновения острых язв, что требует проведения диагностических и терапевтических мероприятий.
Лекарственные средства, обладающие побочным ульцерогенным действием, чаще провоцируют рецидив ЯБ или реализуют генетическую предрасположенность к болезни, но могут вызывать и образование острых множественных дефектов СОЖ и ДПК. Различают три вида острого поражения СОЖ, являющихся как бы последовательными стадиями одного патологического процесса: кровоизлияние в слизистую оболочку (за счет нарушения микроциркуляции в слизистой оболочке ЖКТ), образование эрозии и язвы. Кровоизлияния могут варьироваться от мелких петехий до обширных участков. Вторая стадия – образование эрозии с поверхностной деструкцией слизистой оболочки (на глубину подслизистого слоя стенки желудка или ДПК). Итог цикла повреждений – образование язвы, при которой дефект достигает мышечного, а иногда и серозного слоя слизистой оболочки. Дно острых язв обычно покрыто фибрином или сгустком крови. Диаметр симптоматических язв может колебаться от 2–3 мм до 2–3 см и более. Вокруг острой язвы нет периульцерозного воспалительного вала, как при хронических язвах, но есть ярко-красный ободок. Острые ЭЯП чаще локализуются в области дна и тела желудка, гораздо реже – в пилорическом отделе и ДПК. Они обычно располагаются на отечной слизистой оболочке, покрытой вязкой слизью и фибрином, которая характеризуется повышенной ранимостью и кровоточивостью. При эндоскопическом исследовании характеристика изъязвления соответствует острой язве с периульцерозным воспалительным валом, что отличает ее от хронической язвы при ЯБ [10].
Дифференциальная диагностика симптоматических, в т. ч. лекарственных, язв желудка и ДПК должна проводиться прежде всего с ЯБ. Для ЯБ характерно циклическое образование одиночных язв на малой кривизне тела желудка, в антральном его отделе или в луковице ДПК. Язвы при ЯБ, как правило, имеют хроническое течение. Трудности при дифференциации возникают при разграничении острых симптоматических язв желудка и ДПК, а также острой формы ЯБ. Одиночные язвы типичной локализации, особенно среди лиц с наследственной предрасположенностью, следует относить к ЯБ. Окончательный диагноз обычно помогают установить неоднократные эндоскопические исследования с множественными прицельными биопсиями.
Лечение лекарственных язв
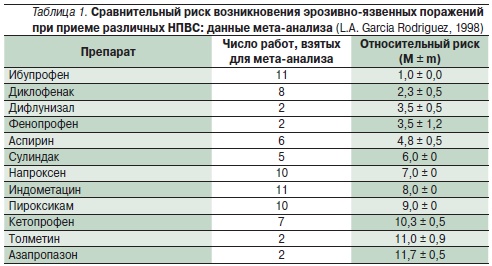
При лекарственных язвах следует отменить “ульцерогенные” препараты, а при невозможности прекращения лечения заменить их препаратами, менее активно действующими на СОЖ и ДПК. Например, последние поколения НПВС (мелоксикам и др.), избирательно угнетающие циклооксигеназу-2 (ЦОГ-2), обладают значительно меньшим повреждающим действием на СОЖ (табл. 1). Лечение лекарственных гастродуоденальных язв не отличается от лечения обычного рецидива ЯБ. После отмены “ульцерогенных” медикаментов лекарственные язвы обычно хорошо поддаются консервативному лечению.
Базовым лекарственным средством для лечения кислотозависимых заболеваний ЖКТ являются антисекреторные препараты, позволяющие уменьшать кислотно-пептическую агрессию желудочного содержимого. Процесс секреции соляной кислоты париетальными (обкладочными) клетками желудка регулируется многими факторами. Он основан на трансмембранном переносе протонов и осуществляется специфическим ферментом – протонной помпой (Н+/К+-зависимой АТФ-азой). Париетальная клетка не является обособленной структурой. Она находится под влиянием вегетативной нервной системы, тесно связана с G-клетками, продуцирующими гастрин, и D-клетками, синтезирующими соматостатин. Стимуляция рецепторов париетальной клетки (М3-ацетилхолином, Н2-гистамином, G-гастрином) с помощью группы вторичных сигнальных мессенджеров активизирует работу протонных помп. Надежное ингибирование поступления ионов водорода в просвет желудка обеспечивает двойной эффект: создаются условия для адекватной репарации СО за счет снижения агрессивных свойств желудочного содержимого, а изменение рН желудочного сока до уровня рН-5–6 уменьшает активацию пепсиногена в пепсин до 20–30 % от исходных величин, что снижает протеолитические свойства желудочного сока, а значит – уменьшает риск рецидива кровотечения за счет лизиса тромба, сформировавшегося в кровоточащем сосуде.
В настоящее время препаратом выбора для терапии всей группы кислотозависимых заболеваний являются ингибиторы протонной помпы (ИПП), позволяющие поддерживать оптимальный уровень рН-желудка в течение суток и обладающие минимумом побочных эффектов [13, 14]. ИПП являются последней генерацией антисекреторных средств, действующих непосредственно на протонную помпу париетальной клетки, необратимо ингибируя ее активность и обеспечивая выраженный антисекреторный эффект независимо от природы кислотостимулирующего фактора.
Важным преимуществом ИПП является отсутствие снижения их антисекреторной активности после приема пищи, в то время как отмечено недостаточное блокирование постпрандиальной желудочной кислотности Н2-блокаторами в дневное время [17]. Последнее может быть обусловлено тем, что прием пищи стимулирует секрецию кислоты, не связанную с гистаминовыми механизмами, и снижает абсорбцию препарата [15]. Т. Andersson и соавт. [14] утверждают, что биодоступность ИПП не зависит от приема пищи, несмотря на снижение абсорбции. В отличие от Н2-блокаторов ИПП ингибируют конечный этап секреции соляной кислоты, не зависящий от природы стимуляции (вагусной, гистаминовой или гастриновой) [6].
Все ИПП являются производными бензимидазола, в основе имеющими единое молекулярное ядро. Однако химические радикалы (“надстройка”) индивидуализируют свойства разных ИПП: различные точки связывания с молекулой Н+/К+-АТФ-азы, особенности трансформации молекулы пролекарства в активную форму и различную стабильность в кислой среде, особенности взаимодействия с системой цитохрома Р450. Их различия касаются в основном скорости наступления и продолжительности кислотоснижающего (обусловлено их рН-селективностью), антихеликобактерного эффектов, межлекарственного взаимодействия с другими одновременно принимаемыми препаратами, которые метаболизируются системой цитохрома Р450, и преимущественной эффективности при язвах желудка [3]. При пероральном приеме ИПП быстро всасываются из кишечника. Капсулы ИПП покрыты кислотоустойчивой оболочкой, поэтому они эвакуируются из желудка неповрежденными; препарат всасывается в щелочной среде кишечника, после чего быстро и избирательно перераспределяется между различными тканями.
В группу ИПП входят омепразол, пантопразол, лансопразол, эзомепразол и рабепразол, которые различаются радикалами в пиридиновом и бензимидазольном кольцах, а также некоторыми фармакокинетическими и фармакодинамическими свойствами. Различия данных препаратов обусловлены особенностями их взаимодействия с системой цитохрома Р450, в частности скоростью метаболизма ИПП у пациентов с различным генотипом данного фермента. Цитохром Р450 представляет собой обширное семейство энзимов, осуществляющих в печени метаболизм ИПП, а также других эндогенных и экзогенных субстратов в неактивные субстанции, которые удаляются из организма с мочой и калом.
Мутации генов ферментов, ответственных за метаболизм лекарственных препаратов, приводят к появлению фенотипических вариантов энзимов с высокой или низкой активностью, что определяет как особенности фармакокинетических и фармакодинамических эффектов различных ИПП, так и их клиническую эффективность. Так, при сравнительном исследовании кислотодепрессивного действия 20 мг омепразола, 40 мг пантопразола (Контролока), 40 мг эзомепразола и 30 мг лансопразола на больных ЯБДПК наиболее продолжительный и выраженный антисекреторный эффект отмечен у эзомепразола и пантопразола [9], причем процент суточного времени с рН больше 4 имел место у пантопразола (Контролока). Проведенные собственные исследования подтверждают эти данные (табл. 2).
Таблица 2.Сравнительная характеристика ИПП пантопразола (Контролока) и эзомепразола.
В клиническом плане помимо кислотодепрессивного эффекта чрезвычайно важными свойствами, которые учитываются при выборе ИПП, являются низкий уровень взаимодействия с другими лекарственными средствами, отсутствие кумулятивного эффекта при длительном применении, а также наличие лекарственной формы для парентерального введения, необходимой для профилактики и терапии стрессовых язв и желудочно-кишечных кровотечений. По данным параметрам выгодно отличается пантопразол (Контролок), у которого спектр взаимодействия с лекарственными препаратами значительно уже по сравнению с другими представителями группы ИПП. Так, в ряде фармакологических и клинических исследований показано, что Контролок не взаимодействует с антацидными препаратами, антипирином, кофеином, пероральными контрацептивами, этанолом, глибенкламидом, левотироксином, метопрололом, пироксикамом, теофиллином, амоксициллином, кларитромицином, диклофенаком, напроксеном, диазепамом, карбамазепином, дигоксином, нифедепином, варфарином, циклоспорином, такролимусом и др., что позволяет использовать его в лечении пепсических изъязвлений у пациентов, получающих несколько препаратов одновременно [20].
Контролок в отличие от омепразола и эзомепразола не аккумулируется в организме после приема повторных доз. Так, после внутривенного введения Контролока в дозе 30 мг/сут в течение 5 дней показатели фармакокинетики оказались сравнимыми с таковыми, полученными после его однократного внутривенного введения. При этом установлено, что площадь под кривой “концентрация–время” (AUC – Area Under the Curve) составила 5,35 мг × ч/л, максимальная концентрация в плазме крови (Cmax) – 5,26 мг/л, период полувыведения – 1,11 часа. При фармакокинетических исследованиях пантопразола при пероральном приеме в дозах от 10 до 80 мг и при внутривенном введении в дозе 240 мг его содержание в сыворотке/плазме крови имело линейный характер. Эти свойства существенно отличают Контролок от омепразола, при повышении дозы которого в том же диапазоне площадь под кривой AUC изменяется непропорционально, а период полувыведения увеличивается уже после однократного внутривенного введения. Важным свойством Контролока, делающим его препаратом выбора в терапии стрессовых язв, является отсутствие необходимости коррекции дозы у пациентов пожилого возраста, а также при почечной и печеночной недостаточности [13, 16].
Примером большей эффективности ИПП при лечении симптоматических, в т. ч. вызванных приемом ульцерогенных медикаментов, изъязвлений СОЖ служат результаты международных многоцентровых исследований, по данным которых применение ИПП в указанных случаях (особенно при невозможности отмены ульцерогенного препарата) превышает таковую при использовании Н2-блокаторов и синтетических простагландинов (мизопростола). Их прием в обычных дозах в течение 8 недель позволяет достигать заживления ЭЯП желудка среди 83–97 % больных, получающих НПВС, а ЭЯП ДПК – ссреди 93 % пациентов. Профилактически ИПП назначают на фоне терапии основного заболевания пациентам, которые имеют повышенный риск развития ЭЯП ЖКТ (лицам пожилого возраста, при наличии в анамнезе ЯБ, при злоупотреблении алкоголем и др.) [12].
Поскольку среди пациентов, использующих в лечении медикаменты с раздражающим и повреждающим действием на СОЖ, большую часть составляют больные старших возрастных групп, которые имеют сопутствующие заболевания, требующие медикаментозной терапии, важно правильно выбрать препарат для профилактики и лечения последствий ульцерогенного влияния. Если прием НПВС или иных медикаментов, обладающих ульцерогенным действием, жизненно необходим, лечение ими можно продолжать на фоне кислотоингибирующей терапии, не снижая дозы и не изменяя формы их введения, в т. ч. не отменяя сопутствующий прием ГКС и цитостатиков [4]. Тем не менее при необходимости продолжать терапию, а также при наличии факторов риска развития структурных изменений СОЖ (язвенный анамнез, возраст старше 65 лет; одновременное назначение ГКС, цитостатиков; систематический, свыше 6 недель, прием препаратов; курение, прием алкоголя и др.) целесообразно профилактически применять пантопразол один раз в сутки в стандартной дозе (40 мг) в течение всего срока терапии.
Информация об авторе:
Логинов Алексей Федорович – кандидат медицинских наук, доцент кафедры внутренних болезней
Института усовершенствования врачей ФГУ “Национальный медико-хирургический
центр им. Н.И. Пирогова” Минздравсоцразвития России.
Тел. 8 (499) 464-04-54, e-mail: InstitutUVr@yandex.ru



