Хронический гепатит С (ХГС) представляет в настоящее время серьезную медико-социальную проблему в мире. По данным Всемирной организации здравоохранения, около 170 млн (3 % мирового населения) человек инфицированы вирусом гепатита С (HCV – Hepatitis C Virus), из которых около 1 млн составляют лица в возрасте до 18 лет [1, 2]. Последние десятилетия характеризуются снижением острых форм гепатита С и ростом ХГС, особенно среди лиц молодого возраста. Это привело к тому, что в распространенности HCV-инфекции ведущую роль стали играть естественные пути передачи, прежде всего – вертикальный (от матери к ребенку), при котором вероятность вертикальной трансмиссии HCV невелика – от 5 до 9 %, но наиболее высокая частота хронизации инфекции – 75–85,7 % [2, 3]. Характерной чертой ХГС в современных условиях считается развитие в 25–30 % случаев цирроза печени, гепатоцеллюлярной карциномы [4].
В течение последнего десятилетия лечение ХГС у взрослых предполагало применения пегилированного интерферона (ИФН) α2α и α2b в сочетании с рибавирином [5]. Для оценки эффективности терапии используют определение РНК HCV, на основании чего оценивается вирусологический ответ (ВО) (табл. 1) [5].
Такая комбинированная противовирусная терапия (ПВТ) обеспечивает эрадикацию HCV 80 % пациентов с генотипом 2–3 и 40–50 % пациентов с генотипом 1 [2, 4]. Не так давно в Европе и США были зарегистрированы препараты (телапревир и боцепревир) для тройной ПВТ ХГС у пациентов с I генотипом, что позволило достигнуть устойчивого вирусологического ответа (УВО) в 72–75 % случаев [6]. У детей комбинация ИФН-α2b и рибавирина была одобрена для лечения ХГС с 3 лет в США и Европе с 2008–2009 гг. [2, 6, 7]. При этом УВО был достигнут в 60,7 % случаев: при I генотипе – у 51 % пациентов, при 2/3 генотипе – у 93 %, рецидивы регистрировали у 7,7–17 % пациентов [2].

В России комбинированная противовирусная терапия (ПВТ) ХГС разрешена с 2010 г. в отношении детей с 3 лет и включает ИФН-α2b и рибавирин; с 2011 г. – пегилированный α-2b и рибавирин.
В настоящее время доказано, что эффективность ПВТ у детей не уступает таковой у взрослых. Ее цели: эрадикация HCV, предотвращение развития осложнений (фиброза, цирроза, гепатоцеллюлярной карциномы), ликвидировать «клеймо неблагополучия» в связи с наличием в семье «асоциального заболевания» [2, 5]. Более двух десятилетий ведутся работы по поиску предикторов результата вирусологического ответа при терапии ХГС, общепризнанны генотип HCV 2/3–1 (отношение шансов [ОШ] = 4,9; р = 0,0001); исходная стадия фиброза F2–F4 (ОШ = 2,2; р = 0,0001); исходная вирусная нагрузка < 600 тыс. МЕ/мл (ОШ = 1,9; р = 0,0001) [7].
Несмотря на большой накопленный мировой опыт лечения ХГС у детей, вопросы, когда и как лечить, вызывают неоднозначные ответы. Это связано прежде всего с возрастными особенностями организма хозяина при ответе на врожденную HCV-инфекцию. Основа противовирусного иммунитета – клеточный иммунный ответ. В результате поглощения HCV антигенпрезентирующая клетка активирует CD4+, Th1-хелперы, стимулирует рост и дифференцировку цитотоксических Т-лимфоцитов СD8+, NK (Natural killer)-клеток, индуцирует продукцию ИФН-γ Т-лимфоцитами и NК-клетками [8, 9]. У детей с первых месяцев жизни, наоборот, преобладает Th2-ответ, отмечается дефицит Т-супрессоров, ослабление активности NК-клеток [10]. Таким образом, у детей младшего возраста имеют место все предрасполагающие иммунные факторы к персистенции и репликации вируса.
Кроме этого только данный контингент больных имеет продолжительность потенциально хронической инфекции с рождения и, несмотря на относительно благоприятный прогноз инфекции, у 4–6 % детей с хронической НСV-инфекцией морфологически определяются признаки фиброза или цирроза [11]. Доказано, что у детей, имевших онкологическое заболевание и приобретенный ХГС, через 30 лет в 5 % случаев разовьется цирроз [2]. При сопоставлении клинико-лабораторных и морфологических данных детей с ХГС было показано, что именно поражение печени более выраженно, чем представлено клинической и лабораторной симптоматикой. При этом примечательно, что после проведения ПВТ морфологические показатели воспаления и фиброза в ткани печени существенно уменьшались [12].
Таким образом, за проведение ПВТ считаются следующие аргументы: возможность полного предотвращения прогрессирования болезни при достижении стойкого вирусологического ответа – элиминация вируса в течение 5 лет и тем самым ликвидация пожизненного риска развития цирроза или гепатоцеллюлярной карциномы.
Кроме этого важно учитывать, что у детей выше реальные возможности элиминации инфекции, чему способствуют:
- благоприятный «фон» лечения – гистологически «мягкий» ХГС у большинства пациентов;
- отсутствие сопутствующей патологии, препятствующей или осложняющей проведение ПВТ (инсулинорезистентность и ожирение);
- нет внепеченочных проявлений, характерных для взрослых;
- высокая приверженность лечению и лучшая переносимость терапии [2, 7].
Таким образом, лечение ХГС в раннем возрасте (после 3 лет) позволяет предотвращать долгосрочные последствия болезни, улучшать прогноз заболевания, снижать расходы на здравоохранение [2]. Однако до настоящего времени нет единого мнения по особенностям иммунного ответа, определяющего исход ПВТ у детей с ХГС при вертикальной передаче инфекции.
Цель исследования – определение факторов, влияющих на исход ПВТ, на основании изучения особенностей клеточного иммунитета и цитокинового профиля у детей с ХГС при вертикальной передаче инфекции.
Материал и методы
В клинике ФГБУ «Нижегородский научно-исследовательский институт детской гастроэнтерологии» Минздрава России обследованы 43 ребенка в возрасте 3–7 лет с ХГС, рожденных от а/HCV-позитивных матерей. Критерии вертикальной передачи HCV: совпадение генотипа HCV с ранее известным генотипом матери; двукратное выявление HCV РНК в крови. Предполагаемые сроки заболевания, интранатальное заражение, вертикальная передача HCV-инфекции диагностированы в 3–4 месяца [2, 7].
Диагноз ХГС (В18.2) установлен в соответствии с Международной классификацией хронических гепатитов (Лос-Анджелес, 1994). Всем больным проведено стандартизованное обследование. Определение РНК HCV в сыворотке крови осуществлено методом полимеразной цепной реакции (ПЦР), сопряженной с обратной транскрипцией с использованием тест-систем «Ампли Сенс-200 HCV-240/440-ВКО» (Россия); генотипирование HCV – при помощи ПЦР-тест-систем «Ампли Сенс-50-R» (Россия). Количество РНК HCV менее 50 МЕ/мл было ниже предела чувствительности системы и расценено как неопределяемое.
Методом проточной цитофлуометрии в крови определено число Т-хелперов (СD4+, %), Т-цитотоксических лимфоцитов (СD8+, %), естественных киллерных клеток (NK-клетки, CD16+, %), В-лимфоцитов (CD19+, %) на цитометре Becton Diskenson FACSCano II (Becton Diskenson, USA). Исследование профиля провоспалительных (фактора некроза опухоли-α – ФНО-α, ИФН-γ), противовоспалительных (ИЛ-4, ИЛ-10) цитокинов в сыворотке крови с помощью тест-систем ООО «Протеиновый контур» (Санкт-Петербург) твердофазным иммуноферментным методом.
Результаты иммунологических параметров сравнили с нормативными показателями, разработанными сотрудниками ФГБУ ННИИ ДГ МЗ России [13], для сравнительной оценки уровня цитокинов взята группа условно здоровых детей, идентичных по возрастно-половому составу исследуемым пациентам.
Все дети получали комбинированную противовирусную терапию (ПВТ) в соответствии с инструкцией, прилагаемой к препарату, после получения информированного согласия: 32 человека – ИФН-α2b человеческий рекомбинантный (3 млн/м2 через день) и рибавирин (15 мг/кг в сутки ежедневно), 11 детей – пегИФН-α2b ИФН-α2b (60 мкг/м2 1 раз в 7 дней) и рибавирин (15 мг/кг в сутки ежедневно). Продолжительность ПВТ определена генотипом HCV: при I генотипе – 48, при II, III – 24 недели [5, 7].
Применены современные методы статистического анализа [14], интегрированные в ряде прикладных программ: Statistica 6.0 for Windows ХР, Excel for Windows ХР. Описательная статистика признака включила среднюю арифметическую (М), стандартную ошибку средней (m), медиану (Ме), интерквартильный размах (Q25–Q75). Рассчитаны коэффициенты корреляции Спирмена (R), гамма (γ), использованы критерий χ2 Пирсона с поправкой Йетса (χ2Yates), коэффициенты Стьюдента, Манна–Уитни. Различия считались достоверными при p < 0,05, что принято в биологии и медицине.
Результаты и их обсуждение
У каждого второго ребенка с ХГС был диагностирован I генотип НСV (21 из 43 детей). Фактически треть (37 %) детей имели III генотип HCV (16 из 43) и 14 % пациентов – II (6 из 43). Более чем в половине (53% из 43) случаев зарегистрирована высокая вирусная нагрузка (более 800 тыс. МЕ/мл).
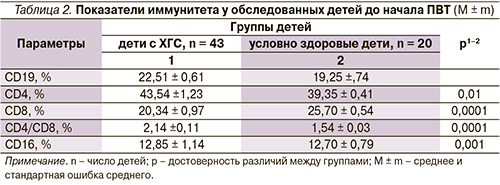
При исследовании показателей клеточного иммунитета у детей с ХГС по сравнению с условно здоровыми детьми установлено статистически значимое повышение относительного числа Т-хелперов (CD4+) (р = 0,01), Т-супрессоров (CD8+) (р = 0,0001) (табл. 2).
При индивидуальном анализе выявлен дисбаланс между CD4+ и CD8+ Т-лимфоцитами. Так, более половины (66% из 43) обследованных имели высокие показатели CD4+, в 2 раза реже регистрировались значения CD8+ (33% из 43) выше величин условно здоровых детей. Полученные данные были взаимосвязаны с повышением индекса CD4+/СD8+ (р = 0,0001). Таким образом, у детей дошкольного возраста с ХГС при вертикальной передаче инфекции преобладают клетки с рецепторами Th2-фенотипа, что связано с возрастными особенностями иммунной системы в этот возрастной период и является патогенетическим признаком неадекватности функционирования иммунной системы при НСV-инфекции [9, 10]. Незначительное повышение доли цитотоксических лимфоцитов (CD8+) может свидетельствовать о недостаточности/истощении Т-клеток при хроническом течении ХГС [15, 16].
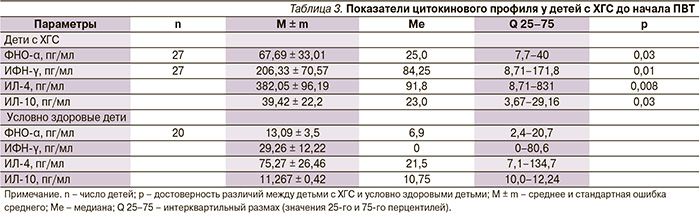
Существенную роль в иммунопатогенезе ХГС играет продукция про- (ФНО-α, ИФН-γ), и противовоспалительных (интерлейкина-4 – ИЛ-4, ИЛ-10) цитокинов [17]. В исследовании отмечены изменения в цитокиновом профиле больных ХГС по сравнению со здоровыми в виде повышения уровней как провоспалительных цитокинов (ФНО-α, ИФН-γ), так и противовоспалительных – ИЛ-4, ИЛ-10 (табл. 3).
При индивидуальном анализе не установлено существенных различий в частоте их повышения: ФНО-α (42 % из 43), ИФН-γ (36 % из 43), ИЛ-4 (30 % из 43), ИЛ-10 (18 % из 43). Однако выявлено, что уровни провоспалительных цитокинов были обратно взаимосвязаны с Т-хелперами (CD4+, %): ФНО-α (R = -0,47; р = 0,025), ИФН-γ (R = -0.5; р = 0,028) с CD19 (%); ИФН-γ (R = -0,5; р = 0,025), ФНО-α (R = 0,49; р = 0,02), CD8+ (%) с ИФН-γ (R = -0,49; р = 0,006). Это подтверждает сдвиг баланса Т-хелперных клонов лимфоцитов в сторону Th2-ответа наблюдаемых больных. Содержание CD16+ (%) было напрямую взаимосвязано с ИФН-γ (R = 0,48; р = 0,03), ФНО-α (R = 0,4; р = 0,025) и обратно – с ИЛ-4 (R = -0,41; р = 0,037). Поскольку NK-клетки являются продуцентами ИФН-γ, обладают прямой цитотоксической активностью и играют важную роль в подавлении репликации HCV [17], полученные данные подтверждают роль показателей врожденного иммунитета в иммунопатогенезе ХГС при вертикальной передаче инфекции у детей.
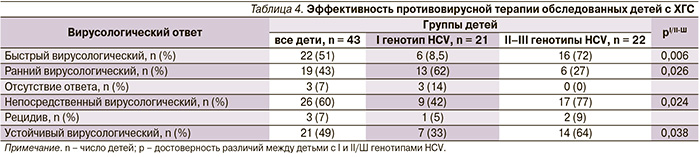
При оценке эффективности проводимой комбинированной противовирусной терапии детям с перинатальным ХГС показано, что УВО был достигнут фактически каждым вторым пациентом (21 из 43), существенно выше этот показатель был у детей, имевших II/III генотипы – 64 % (р = 0,038). Кроме того, у данного контингента пациентов существенно чаще диагностировали быстрый вирусологический ответ (БВО), ранний вирусологический ответ (РВО), непосредственный вирусологический ответ – НВО (табл. 4). Достижение УВО напрямую было взаимосвязано с особенностями HCV – II/Ш генотипом (γ = 0,75; р = 0,0016), а также благоприятным фактором для достижения УВО стали БВО (γ = 0,86; р = 0,001) и НВО (γ = 1,0; р = 0,00001).
Установлена связь между состоянием клеточного иммунитета обследованных детей до начала терапии и ответом на ПВТ. Так, показатели врожденного иммунитета СD16+ (%) напрямую коррелировали с НВО (γ = 0,49; р = 0,04) и обратно – с отсутствием ответа – ОО (γ = -0,76; р = 0,04). Таким образом, можно предполагать, что активность клеток врожденного иммунного ответа (NK) остается одним из определяющих факторов эффективности терапии детей с ХГС при вертикальной передаче инфекции. УВО был ассоциирован с более низкими стартовыми показателями CD19+ (%) (γ = -0,6; р = 0,005). Поскольку В-клетки стимулируют Т-хелперы к дифференцировке в Th2-клетки, вырабатывающие цитокины, необходимые для дальнейшего развития В-клеток, полученные данные подтверждают развитие Th2-ответа и его неэффективность для элиминации вирусного патогена у детей [16]. Это было подтверждено результатами дальнейшего исследования.
Определена связь между медиаторами межклеточного взаимодействия и исходом противовирусной терапии детей с ХГС при вертикальной передаче инфекции. Так, более высокие показатели ИФН-γ (R = 0,43; р = 0,023) и низкие ИЛ-4 (R = -0,43; р = 0,023), свидетельствовавшие о преобладании Th1-ответа, существенно чаще отмечались у детей c РВО и БВО. Отсутствие ответа на терапию, наоборот, было взаимосвязано с профилем цитокинов до лечения, характерным для преобладания Th2-ответа, с более низкими показателями ИФН-γ (R = -0.43; р = 0,04), ФНО-α (γ = -1,0; р = 0,03) и высоким уровнем ИЛ-4 (R = -0,62; р = 0,001), поскольку ИФН-γ регулирует взаимодействие Т-хелперных клонов, сдвигая баланс в сторону клеточного иммунитета. Недостаточный противовирусный ответ – сдвиг в сторону Th2-ответа – обусловливает ОО на противовирусную терапию детей с ХГС при вертикальной передаче инфекции. Известно, что ИФН-γ синтезируется главным образом Т-лимфоцитами и активированными NK-клетками [17]. Поэтому при снижении содержания NK-клеток существенно чаще отмечалось снижение уровня ИФН-γ и как следствие – ОО на противовирусную терапию.
Таким образом, у детей дошкольного возраста с хроническим гепатитом С при вертикальной передаче инфекции иммунологические нарушения в фазу репликации вируса характеризуются преобладанием Th2-ответа, истощением CD8+, что связано с возрастными особенностями иммунной системы. Это определяет персистенцию вируса HCV и негативно влияет на исход противовирусной терапии. Преобладание Th1-ответа, наоборот, способствует быстрому и непосредственному вирусологическому ответу. Достижению УВО детьми с ХГС способствуют генотип вируса (II–III), БВО и НВО. Дальнейшее изучение механизмов взаимодействия организма ребенка с HCV будет способствовать разработке программ профилактики данной инфекции, совершенствованию подходов к терапии и в последующие годы – снижению частоты осложнений хронического гепатита С у лиц молодого возраста.



