Использование комбинированной оральной контрацепции (КОК) способствует не только снижению числа нежелательных беременностей, но и улучшению репродуктивного здоровья женщины путем профилактики злокачественных опухолей репродуктивной системы [1, 2]. Безопасная контрацепция имеет большое социальное значение, поскольку служит реальной альтернативой абортам и связанной с ними материнской смертности.
К наиболее эффективной стратегии обратимой контрацепции относится применение женских половых гормонов в виде комбинации синтетических аналогов натуральных эстрогенов и прогестинов. В США и странах Европы гормональная контрацепция остается основным способом предохранения от беременности [3]. Широкая распространенность гормональных контрацептивных препаратов в значительной степени связана с удобством и простотой их применения, что обусловлено наличием различных лекарственных форм, среди которых таблетированные, трансдермальные (пластыри), а также вагинальные кольца. Для женщин с медицинскими противопоказаниями к применению эстрогенов разработаны прогестиновые и внутриматочные (в т.ч. релизинговые системы) контрацептивы.
Половые гормоны и сердечно-сосудистая система
Несмотря на более чем полувековую историю применения гормональной контрацепции, некоторые вопросы безопасности препаратов данной группы остаются в эпицентре изучения и широкой дискуссии. Одной из наиболее актуальных проблем является влияние уровня эндогенных половых гормонов и КОК на сердечно-сосудистую систему.
По данным обсервационных исследований, риск развития сердечно-сосудистых заболеваний (ССЗ) у женщин в молодом возрасте значительно ниже, чем у мужчин. Наряду с этим было доказано, что снижение синтеза эстрогенов в яичниках, наблюдаемое при преждевременной недостаточности функции яичников и во время физиологической пре- и постменопаузы, повышает риск коронарного атеросклероза и сердечно-сосудистых осложнений (ССО). Было выдвинуто предположение о протективной роли эндогенных эстрогенов в развитии атеросклероза и ассоциированных с ним осложнений. Эксперименты на животных показали, что активация эстрогеновых α-рецепторов на клетках эндотелия и миокарда оказывает антиоксидантный эффект и приводит к ингибированию роста гладкомышечных клеток в стенке сосудов и восстановлению поврежденного эндотелия. Более того, эстрогены снижают уровень окисления холестерина липопротеидов низкой плотности (ЛПНП), связывание и агрегацию тромбоцитов, а также повышают активность циклооксигеназы-2. Учтя сходные свойства эстрогенов и статинов (ингибирование воспаления, повышение активности синтетазы оксида азота, угнетение активности мощного вазоконстриктора эндотелина-1), швейцарский ученый Маттиас Бартон даже назвал эстрогены «эндогенные статины» [4].
Группа исследователей под руководством M. Adams (1990) выявила уменьшение выраженности атеросклероза у макак на атерогенной диете, получавших эстрогены, на 50–75 % по сравнению с животными группы плацебо. Те же авторы опубликовали в 2000 г. результаты исследования на обезьянах, в ходе которого группы испытуемых получали трехфазный КОК, монотерапию этинилэстрадиолом (ЭЭ), монотерапию левоноргестрелом и плацебо. При этом все животные получали атерогенную диету. Степень снижения выраженности атеросклероза у животных, получавших монотерапию ЭЭ, по сравнению с группой плацебо составила 67 %, а у макак, принимавших КОК, – 28 %. У животных, получавших левоноргестрел, уменьшения выраженности атеросклероза не наблюдалось.
Полученные данные побудили исследователей к изучению влияния терапии женскими половыми гормонами на развитие и прогрессирование атеросклероза и ассоциированных с ним сердечно-сосудистых событий. Изучен и ряд других показателей атеросклероза, в частности уровень коронарного кальциноза, общепринятого и чувствительного маркера повышенного риска развития ССО [5]. В данном контексте необходимо рассматривать и результаты исследования WISE (Women’s Ischemia Syndrome Evaluation Study, 2006). После учета поправки на возраст и факторы сердечно-сосудистого риска обнаружено, что прием КОК в прошлом сопровождался небольшим (2,4 %), но статистически значимым снижением риска атеросклеротического поражения коронарных артерий [6].
Существуют и более сложные связи между уровнем половых гормонов и развитием ССЗ. Так, данные Nurses’ Health Study продемонстрировали связь между нарушением регулярности менструального цикла в репродуктивном возрасте и развитием в последующем нежелательных сердечно-сосудистых событий, что свидетельствует о возможной роли дисфункции яичников и низкого уровня эстрогенов в повышении риска кардиальных осложнений.
У женщин с синдромом поликистозных яичников и гиперандрогенией заметно значительное повышение риска ССЗ, применение ими КОК приводит к подавлению продукции андрогенов яичниками и повышению выработки секс-стероид-связывающего глобулина, что сопровождается снижением свободной фракции тестостерона плазмы [7]. Наконец прием КОК приводит к уменьшению выраженности ответа коры надпочечников на стресс у приматов, что также может опосредо–ванно уменьшать риск развития атеросклероза за счет влияния на нейроэндокринные механизмы.
Таким образом, влияние эстрогенов как эндогенного происхождения, так и в составе современных КОК на кардиоваскулярные риски не теряет актуальности и в настоящее время [3, 8, 9] (табл. 1).
Прогестины, применяемые в составе КОК, служат синтетическими аналогами прогестерона. Существует несколько разновидностей прогестинов, отличающихся степенью сродства к прогестероновым, андрогенным и эстрогенным рецепторам, а также рядом дополнительных свойств, позволяющих использовать КОК с лечебной целью, например учитывать антиандрогенный и антиминералокортикоидный эффекты дросперинона. Именно прогестагенная составляющая определяет «лицо» КОК и позволяет персонифицировать гормональную контрацепцию.
Влияние гормональных контрацептивов на факторы риска ССЗ
Под факторами риска (ФР) понимают особенности организма, внешние воздействия и/или их взаимодействия, приводящие к увеличению вероятности возникновения заболевания, его прогрессирования и неблагоприятного исхода [10]. В связи с влиянием на заболеваемость и смертность ФР необходимо своевременно выявлять и устранять или по меньшей мере уменьшать степень их выраженности. В настоящее время известно более 300 ФР ССЗ.
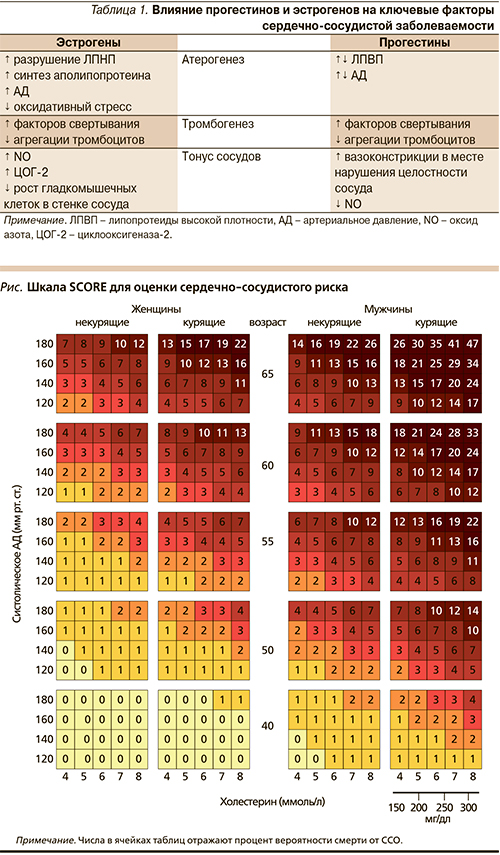
В отчете Всемирной организации здравоохранения (ВОЗ) за 2002 г. указано 3 основных ФР ССЗ: артериальная гипертензия (АГ), гиперхолестеринемия и курение. Их наличие объясняет более чем 75 % случаев смертности от ССЗ. Большое клиническое значение имеют также гипергликемия, повышение уровня ЛПНП, триглицеридов (ТГ), ожирение, возраст и пол. Оценку суммарного риска ССО и смертельного исхода от сердечно-сосудистых причин осуществляют по шкале SCORE (Systematic Coronary Risk Evaluation), разработанной группой экспертов Европейского общества кардиологов. Данная шкала (см. рисунок) отражает абсолютную вероятность смертельного ССО в ближайшие 10 лет с учетом нескольких ФР (пол, возраст, курение, систолическое АД – САД, уровень общего холестерина).
Уровень холестрина и дислипидемия
Влияние эстрогенов на липидный профиль носит опосредованный характер. Они вызывают активацию геномных механизмов, в результате которой конформационные изменения эстрогеновых рецепторов усиливают синтез печеночного аполипопротеина, что теоретически может смещать в благоприятную сторону соотношение липидов крови. Влияние прогестинов на липидный профиль изучено в меньшей степени, результаты полученных исследований не позволяют делать однозначных выводов по поводу их атерогенности.
Клинические исследования показали дозозависимые изменения липидного профиля при приеме КОК. Метаболически нейтральные прогестагены (дроспиренон, диеногест), а также левоноргестрел в комбинации с ЭЭ не обладают столь выраженным неблагоприятным воздействием на метаболизм липидов. L. Speroff и A. DeCherney (1993), проанализировав данные об особенностях липидного спектра у женщин, принимавших КОК с прогестинами 2-го и 3-го поколений, обнаружили небольшое изменение общего уровня холестерина в сочетании с существенным увеличением уровня холестерина ЛПВП и ТГ, а также значимое снижение содержания ЛПНП. При сравнении КОК, содержащих 35 и 30 мг ЭЭ, было выявлено, что у женщин, принимавших КОК с более низким содержанием ЭЭ, наблюдалось небольшое повышение уровня атерогенных фракций липопротеидов, в частности ЛПНП и ТГ, с одновременным снижением уровня ЛПВП (исследования J. Endrikat, 2002). Вместе с тем J. Barkfeldt и соавт. (2001) в ходе двойного слепого рандомизированного исследования препаратов, содержащих дезогестрел и левоноргестрел, не выявили значимых изменений липидного профиля у пациенток, принимавших прогестероновые оральные контрацептивы (ПОК).
Очевидно, КОК оказывают разнонаправленное действие на липидный профиль в зависимости от соотношения и биологических свойств активных компонентов. Прогестагены с андрогенными свойствами тормозят разрушение атерогенных ЛПНП в печени, в результате чего уровень последних в крови возрастает. Синтетические эстрогены, напротив, ускоряют разрушение ЛПНП и стимулируют печеночный синтез антиатерогенных ЛПВП, но одновременно увеличивают уровень ТГ. Поэтому чем выше доза эстрогенов относительно прогестинов (например, в трехфазных препаратах), тем ниже атерогенный эффект, но выше риск повышения уровня ТГ. К аналогичному результату приводит выбор прогестагена с высокой селективностью или антиандрогенным действием. Современные низко- и микродозированные КОК чаще всего не оказывают существенного влияния на жировой обмен, хотя у некоторых женщин отмечаются изменения, характеризующие преимущественно андрогенный (повышение уровня ЛПНП) или эстрогенный (повышение уровня ТГ) эффект препаратов.
Тактика врача при назначении гормональной контрацепции пациенткам с дислипидемией [11]
Комбинированная гормональная контрацепция условно противопоказана при наличии дислипидемии, однако ее допустимо назначать при условии тщательной оценки всех «за» и «против» (необходимо отсутствие другие сердечно-сосудистых ФР, особенно курения). Приемлемым уровнем ЛПНП, при котором польза превышает риск, составляет 2,2 г/л и меньше. При превышении данного показателя возможно назначение препарата, содержащего прогестин, желательно без андрогенной активности. Пороговое значение уровня ТГ – 2 г/л, при его превышении применение эстрогенсодержащих КОК не рекомендовано. Женщинам, у которых на фоне гиполипидемической терапии уровень ЛПНП нормализовался, можно назначать КОК с содержанием ЭЭ не более 30 мкг. Всем пациенткам с фоновой дислипидемией, которым назначены КОК, рекомендован контроль липидного профиля через 3–6 месяцев после начала терапии. При выявлении повышенного уровня общего холестерина Французское общество эндокринологов рекомендует оценить, за счет какой фракции это произошло. Если повышен уровень ЛПВП, то каких-либо дополнительных действий предпринимать не следует. Если нет других ФР, КОК необходимо отменить при значении ЛПНП более 2,2 г/л, каждый дополнительный ФР ССЗ снижает допустимый порог ЛПНП на 0,3 г/л. При выявлении гипертриглицеридемии (более 2,0 г/л) КОК противопказаны.
Артериальная гипертензия
Высокий уровень АД (более 140/90 мм рт. ст.) является самостоятельным фактором сердечно-сосудистого риска, важнейшим ФР развития атеросклероза и ассоциированных с ним осложнений. Показано, что эстрогены способны усиливать выработку ангиотензиногена в печени и стимулировать ренин-ангиотензин-альдостероновую систему, что приводит к задержке натрия, воды и увеличению объема циркулирующей крови, повышению ударного объема и сердечного выброса [12]. Результатом изменения водно-солевого баланса в совокупности с увеличением ударного и минутного объемов сердца становится развитие АГ у 3–6 % женщин. Данные эффекты обратимы и самостоятельно регрессируют после отмены КОК. Повышение среднего АД на 5–7 мм рт. ст. наблюдается вне зависимости от содержания ЭЭ (20–30 мкг), а клинически значимая АГ, требующая коррекции, развивается у женщин, принимающих КОК, с частотой 1 : 200. В остальных случаях антигипертензивной терапии с учетом небольшой степени повышения АД не требуется. По данным W.K. Oelkers (1996) и W. Suthipongse (2004), при использовании КОК, содержащих прогестаген с антиминералокортикоидной активностью, например дроспиренона, отмечается снижение АД в среднем на 3,9 мм рт. ст.
Тактика врача при назначении гормональной контрацепции пациенткам с АГ [11]
Согласно рекомендациям ВОЗ, измерение АД – единственное исследование, которое необходимо проводить женщинам без ФР ССЗ перед назначением им КОК. Преимущества КОК преобладают над рисками только в случае наличия гестационной АГ в анамнезе, которая к настоящему моменту полностью разрешилась. В противном случае при наличии как неконтролируемой АГ, так и при АГ, хорошо контролируемой препаратами, применение КОК противопоказано. Альтернативой в таких случаях может стать применение прогестиновых или внутриматочных контрацептивов.
Сахарный диабет
Нарушению толерантности к глюкозе и сахарному диабету (СД) в настоящее время отводится важная роль в развитии атеросклероза. По некоторым данным, гормоны, входящие в состав КОК, снижают чувствительность тканей к глюкозе, что приводит к повышению секреции инсулина поджелудочной железой. В случае ограниченных компенсаторных возможностей поджелудочной железы развивается вначале относительная, а затем абсолютная инсулиновая недостаточность. Продиабетогенное действие КОК может проявиться у женщин с отягощенной наследственностью, у пациенток с синдромом поликистозных яичников и инсулинорезистентностью, в старшей возрастной группе, а также при наличии ожирения.
Результаты, свидетельствующие об отсутствии значимого влияния приема КОК на развитие СД, были получены при анализе дальнейшего наблюдения за участницами крупнейшего когортного исследования Nurses Health Study, начатого в 1976 г. СД 2 типа развился у 185 женщин, риск его был незначительно повышен у тех, кто продолжал принимать КОК (относительный риск [ОР] = 1,3), и даже несколько снижался у принимавших КОК в прошлом (ОР = 0,9). Кокрейновский обзор, опубликованный в 2006 г., не выявил какого-либо ухудшения контроля гликемии на фоне приема КОК пациентками с СД [13]. S.L. Kjos и соавт. (1990) наблюдали группу пациенток с гестационным СД в анамнезе в течение нескольких лет после родов. Через 3 года после родов у женщин, принимавших низкодозовые КОК с норэтиндроном или левоноргестрелом, риск развития СД не превышал таковой в контрольной группе, не получавшей КОК. Наконец K. Baptiste-Roberts и соавт. в ходе систематического обзора 14 исследований ФР развития СД 2 типа у пациенток с гестационным диабетом показали, что применение КОК не сопровождается увеличением частоты случаев СД [14]. С другой стороны, показан более высокий ОР развития инсульта (3,6 раза) и инфаркта миокарда [ИМ] (2 раза) у пациенток с сочетанием СД и ФР ССЗ (группа исследователей под руководством B. Tanis, 2001).
Тактика врача при назначении гормональной контрацепции пациенткам с СД [11]
Гестационный СД в анамнезе не является противопоказанием к назначению КОК. Низкодозированные КОК с высокоселективными прогестинами (например, дезогестрел, гестоден, хлормадинона ацетат) могут использоваться женщинами с нарушением толерантности к углеводам и в случае хорошо компенсированного неосложненного СД. При оценке возможности назначения КОК пациенткам с СД любого типа следует прежде всего оценить наличие комбинации ФР ССЗ (дислипидемия, АГ, курение, длительность заболевания более 20 лет) и осложнений диабета (ангиопатия, ретинопатия, нефропатия, полиневропатия). При наличии хотя бы одного дополнительного ФР или осложнения СД предпочтительно применение прогестиновых или внутриматочных контрацептивов.
Венозный тромбоз
Основные риски для здоровья при применении КОК обусловлены влиянием синтетических эстрогенов на выработку в печени некоторых глобулинов. Эстрогены способны повышать выработку V, VIII, X факторов свертывания и фибриногена, что может приводить к тромбозу – патогенетическому фактору, который лежит в основе развития сердечно-сосудистых катастроф. Данный эффект имеет четкий дозозависимый характер и не зависит от способа введения в организм КОК [15–18]. Прогестерон и его синтетические аналоги не оказывают выраженного влияния на синтез белков, они лишь уменьшают продукцию секс-стероид-связывающего глобулина. Подтверждения взаимосвязи применения КОК и тромбоза были получены в многочисленных проспективных исследованиях.
В частности, B. Gerstman и соавт. (1991) провели всесторонний анализ влияния различных доз эстрогенов на встречаемость венозной тромбоэмболии (ВТЭ) в своем историческом когортном исследовании с участием более 230 тыс. женщин в возрасте от 15 до 44 лет в штате Мичиган между 1980 и 1986 гг. Риск развития ВТЭ распределялся в данной популяции следующим образом: у принимавших КОК, содержащих менее 50 мкг эстрогенов, – 4,2 на 10 тыс. женщин-лет; при приеме 50 мкг ЭЭ риск составил 7, а при превышении содержания эстрогенов более 50 мкг – 10 случаев на 10 тыс. женщин-лет. Проведенные исследования оценивали в основном побочные эффекты КОК первого поколения, содержавших высокие дозы как эстрогенов, так и прогестинов.
Особенно выраженно риск развития тромбоза повышается при сочетании нескольких тромбогенных факторов, таких как врожденные нарушения свертываемости крови, курение, ожирение, возраст старше 40 лет, тромбоз глубоких вен или тромбоэмболия легочной артерии (ТЭЛА) в анамнезе, недавняя крупная хирургическая операция, длительная иммобилизация.
Врожденные нарушения свертываемости крови (дефицит натуральных ингибиторов коагуляции, антитромбина, протеинов C и S) повышают риск развития тромбозов при приеме КОК в 5–16 раз [19].
В 1993 г. был выявлен важнейший ФР развития тромбозов – полиморфизм фактора V Лейдена. Этот генетический дефект ассоциирован с резистентностью к активированному протеину С, который не может в достаточной степени проявлять свои антикоагулянтные свойства. Носители мутантного гена составляют 20–30 % среди лиц с первым эпизодом глубокого венозного тромбоза, 50 % – среди больных семейной тромбофилией и 70 % – среди пациенток, имевших повторные тромбозы. Распространенность мутации в общей популяции среди лиц европеоидной расы составляет около 5 % [20], риск для женщин репродуктивного возраста с данной мутацией, не использовавших КОК, составил 5,7 тромбоэмболического события на 10 тыс. женщин-лет. При приеме КОК женщинами из этой категории частота ВТЭ увеличивается до 28,5 случаев на 10 тыс. женщин-лет. Следует отметить, что абсолютный риск ВТЭ для таких женщин остается довольно низким. По мнению рабочей группы ВОЗ, при подборе контрацепции рутинный скрининг на наличие данной мутации нецелесообразен в связи с его высокой стоимостью и высокой вероятностью получения ложноположительных результатов [21]. Так, было установлено, что при скрининге 1 млн кандидаток для назначения КОК на основные известные нарушения или мутации факторов свертывания будут выявлены лишь у около 50 женщин с истинным повышением риска тромбоза и приблизительно у 62 тыс. женщин с ложноположительным результатом [21]. Вместе с тем наличие тромбозов в анамнезе служит абсолютным противопоказанием к назначению КОК (категория приемлемости 4 по ВОЗ).
Связь между ожирением, приемом КОК и риском тромбоза изучалась в исследовании MEGA (Multiple Environmental and Genetic Assessment), посвященном интегральной оценке ФР венозного тромбоза. В этом крупном исследовании типа «случай–контроль» анализировалась роль ожирения, применения КОК и протромботических мутаций в развитии ВТЭ. Риск ВТЭ был повышен как у лиц с избыточной массой тела индекс массы тела (ИМТ) между 25 и 30 кг/м2 (отношение шансов [ОШ] = 1,7 при 95 % ДИ 1,55–1,87), так и у женщин с ожирением (ИМТ ≥ 30 кг/м2, ОШ = 2,4 при 95% ДИ – 2,15–2,78) по сравнению с женщинами с нормальной массой тела. Риск развития тромбоза у женщин с ожирением, применяющих КОК, был в 24 раза выше такового для лиц с нормальным ИМТ, не использующих КОК [22]. По результатам эпидемиологических исследований Ø. Lidegaard (2002), для снижения риска побочных эффектов количество эстрогенов в препаратах второго поколения было уменьшено до 30 мкг/сут, что сопровождалось снижением риска возникновения тромбозов на фоне их приема в 4 раза. Тем не менее, по данным комитета экспертов ВОЗ (1998), риск развития венозных тромбозов при приеме даже препаратов второго поколения повышен.
Влияние прогестогенного компонента КОК на риск венозных тромбозов изучено в меньшей степени. Основное значение имеет не столько доза, сколько конкретный прогестаген, содержащийся в препарате. Так, в 1995 г. H. Jick и соавт. продемонстрировали, что КОК, содержащие прогестагены третьего поколения (гестоден, дезогестрел), повышают риск развития венозных тромбозов в 2 раза по сравнению с прогестагенами второго поколения (левоноргестрел) даже после коррекции на курение и ИМТ. Механизмами подобного эффекта считают развитие «приобретенной резистентности к активированному протеину С» и связывание прогестагенов с рецепторами других гормонов стероидной природы [12]. После опубликования результатов исследований, проведенных в Лейдене (Leiden Trombophilia Study) и ВОЗ (Multinational Case-Control Study by the WHO) в 1995 г., опасения по поводу безопасности приема КОК достигли апогея.
Мнение о еще большем повышении риска тромбозов при приеме КОК третьего поколения было подвергнуто справедливой критике в связи с высокой вероятностью статистической погрешности и других субъективных факторов. Среди таких факторов называют предпочтения врачей в отношении назначения новых КОК всем женщинам, нуждающимся в контрацепции, в т.ч. имеющим повышенный риск ВТЭ (недоучет противопоказаний), методологические вопросы (т. н. диагностическая субъективность, при которой повышенная настороженность в отношении возможного развития ВТЭ приводит к более частой ее диагностике), а также сложности при сравнении различных лекарственных форм КОК с разной продолжительностью действия [23].
Проведенный Suissa и соавт. (2000) комплексный анализ после корректировки на ряд сопутствующих факторов не выявил какой-либо разницы в риске ВТЭ для женщин, регулярно использующих низкодозовые КОК, содержащие прогестины первого и второго поколений, по сравнению с «новыми» гестагенами. Недавно специалисты Медицинского центра Лейденского университета провели расширенный систематический обзор с мета-анализом публикаций высокого качества для повторной оценки риска тромбоэмболий при приеме КОК, содержащих разные прогестины [24]. Показано, что применение КОК в 3,5 раза повышает риск развития ВТЭ, а относительный риск при приеме КОК, содержащих ЭЭ в дозе 30–35 мкг и гестоден, дезогестрел, ципротерона ацетат или дроспиренон, был одинаковым и на 50–80 % превышал таковой при использовании препаратов, содержащих левоноргестрел. Эффект ЭЭ в комбинации с гестоденом, дезогестрелом и левоноргестрелом был дозозависимым: более высокие дозы эстрогена были связаны с повышением риска тромбоза. По мнению исследователей, риск тромбоза определяется типом применяемого прогестина и дозой ЭЭ.
В 2011 г. FDA (Food and Drug Administration) опубликовало предупреждение о возможном повышении риска тромбозов при использовании дроспиренон-содержащих КОК. По результатам крупного ретроспективного когортного исследования было обнаружено, что среди женщин, принимавших левоноргестрел, заболеваемость тромбозом составила около 13 случаев на 100 тыс. женщин, в то время как прием новых препаратов на основе дроспиренона повышал риск развития тромбоза до почти 31 случая на 100 тыс. женщин [25]. Результаты оказались весьма неожиданными, т.к. за 10 лет использования препарата во многих исследованиях (в т.ч. в крупнейшем европейском исследовании EURAS с участием 58 674 женщин) были продемонстрированы данные, свидетельствующие о безопасности дроспиренона и риске тромбозов, сопоставимом с таковым при использовании левоноргестрела. К тому же в исследованиях, проанализированных FDA, не учитывались многочисленные ФР, которые сами по себе могут повышать риск тромбозов независимо от конкретного КОК. Был сделан следующий вывод: требуется проведение дополнительных крупных исследований.
Прогестиновые контрацептивы (ПОК, инъекционные) практически не влияют на систему свертывания крови, риск ВТЭ при приеме ПОК весьма низок [26, 27]. Мета-анализ A. Bergendal выявил статистически незначимое повышение риска ВТЭ при приеме ПОК (ОШ = 1,45) [28].
В другом небольшом исследовании было показано, что применение хлормадинона ацетата не сопровождается повышением риска ВТЭ даже для женщин с ФР (эпизоды тромбозов в анамнезе или врожденные нарушения свертываемости) (ОШ = 0,8 [0,2–3,9]) [27]. F. Rosendaal (2003) высказал мнение, будто КОК с хлормадиноном можно назначать пациенткам с риском ВТЭ. Данное мнение было подтверждено G. Schramm и соавт., которые провели сводный анализ данных 6 клинических исследований эффективности и безопасности КОК, содержавшего 30 мкг ЭЭ и 2 мг хлормадинона ацетата, с участием более чем 60 тыс. женщин. Риск тромбоза был достаточно низким и составил 2,4 на 10 тыс. пациентов-лет [29].
Тромбоэмболические осложнения обычно развиваются в течение первого года применения КОК, особенно опасны в этом отношении первые 4 месяца.
Тактика врача при назначении гормональной контрацепции пациенткам с венозными тромбозами или ФР их развития [11]
При наличии в анамнезе ВТЭ (тромбоз глубоких вен, ТЭЛА) применение КОК противопоказано. В острой фазе тромбоза рекомендуют использование барьерных методов. Впоследствии назначают прогестиновые гормональные контрацептивы. Следует отметить, что тромбоз поверхностных вен не считается ФР ВТЭ, ограничений по применению КОК он за собой не влечет.
При наличии доказанного лабораторного нарушения свертываемости крови у пациенток без тромбоэмболий в анамнезе подход аналогичен: предпочтение отдается монокомпонентным прогестиновым препаратам.
Наличие в семейном анамнезе тромбоэмболических событий у родственника первой линии в возрасте до 60 лет также служит противопоказанием к назначению КОК и допускает использование прогестиновых контрацептивов.
Как уже отмечено ранее, при назначении КОК скрининга на наличие тромбофилий не требуется, однако некоторые исследователи рекомендуют проведение скрининговых тестов женщинам, чьи родственники первой линии имели тромбоз в возрасте до 60 лет [30]. Среди рекомендуемых исследований – протромбиновое время, активированное частичное тромбопластиновое время, антитромбин, протеин C, протеин S, фактор V Лейдена и протромбин (FII) 20210A. Целесообразность такого тестирования признается не всеми.
Артериальные тромбозы
Хотя артериальные тромбозы и встречаются в 5–10 раз реже, чем венозные [31], их значение невозможно недооценить. Артериальный тромбоз – непосредственный патогенетический механизм развития таких ССО, как ИМ или инсульт. Данные Nurses’ Health Study (1988) с участием 119 061 женщины и периодом наблюдения 8 лет не показали повышения риска сердечно-сосудистых событий при приеме КОК (ОШ = 0,95 [0,81–1,11]). После поправки на сердечно-сосудистые ФР относительный риск для женщин, принимавших КОК, составил 0,8 (0,6–1,0) в отношении ИМ, 1,0 (0,7–1,3) – в отношении инсульта и 0,90 (0,7–1,2) в отношении летального исхода вследствие сердечно-сосудистых событий. Связи между длительностью приема КОК и риском сердечно-сосудистых событий выявлено не было. Однако для женщин, продолжавших принимать КОК, относительный риск ССО составил 2,5 (1,3–4,9), причем 70 % нежелательных событий произошли среди курильщиц [9]. Одно из наиболее крупных исследований, проведенное B.C. Tanis и соавт. (2001), показало повышение риска ИМ при применении КОК второго поколения, содержащих левоноргестрел, в 2,7 раза, в то время как влияние КОК третьего поколения на данный риск было значительно меньшим или даже сомнительным. Большое шведское проспективное исследование с участием 48 321 женщины в возрасте 30–49 лет длительностью 11 лет показало, что после поправки на возраст и сердечно-сосудистые ФР (АГ, курение, СД) риск ИМ как у прекративших, так и у продолжавших использование КОК пациенток достоверно не повышался [8].
О весомом вкладе приема КОК в развитие ИМ можно говорить лишь в случае наличия у женщины таких состояний, как курение, СД, АГ, т.е. множественных ФР ССЗ. Исследование с участием 1309 женщин, проведенное под эгидой ВОЗ (1997), показало, что ОР ИМ вследствие приема КОК составляет 1,1 у некурящих участниц без АГ. Тем временем у женщин с ФР вероятность ИМ резко возрастала. Так, для некурящих женщин с АГ такой риск составил 16,4, для курильщиц без гипертензии – 26,6, а при сочетании курения и гипертензии он достигал 71,4.
Инсульты у женщин репродуктивного возраста встречаются редко, однако их частота при применении КОК несколько выше. Еще в 1997 г. Heinemann и соавт. сообщили о повышении риска развития инсульта при приеме КОК первого поколения (ОШ = 5,3 при 95 % ДИ – 2,6–11) по сравнению с КОК новых поколений (ОШ = 1,53 при 95 % ДИ 0,71–3,31). При этом каких-либо различий по частоте инсультов между вторым и третьим поколениями КОК выявлено не было. Позднее, в 2002 г., были опубликованы результаты исследования RATIO с участием 1182 здоровых женщин в возрасте 18–49 лет. Риск инсульта при применении КОК был в 2,3 раза выше, чем у женщин, пользовавшихся негормональными методами контрацепции. Важно подчеркнуть, что при наличии у женщины мигрени с аурой (нередко встречающейся в репродуктивном возрасте) риск инсульта был в 2 раза выше, чем при мигрени без ауры [32]. В отношении рисков артериального тромбоза при применении прогестиновых контрацептивных препаратов известно значительно меньше в связи с малым числом исследований, которые в подавляющем большинстве включали весьма гетерогенные группы пациенток. Интерес представляют данные мета-анализа французских исследователей, показавших, что риск инсульта на фоне приема прогестиновых препаратов составляет 0,96 вне зависимости от способа введения. Риск инсульта при применении медроксипрогестерона ацетата был 0,89 [33].
Тактика врача при назначении гормональной контрацепции пациенткам с артериальными тромбозами или ФР их развития [11]
Комбинированные препараты противопоказаны при наличии у женщины кардиоваскулярных заболеваний (ишемической болезни сердца или инсульта в анамнезе). Предпочтительным методом в таких случаях является негормональный способ, например внутриматочная спираль. При наличии противопоказаний или плохой переносимости внутриматочных контрацептивов можно рассмотреть возможность назначения прогестиновых контрацептивов при условии консультации нескольких специалистов. Сходная стратегия применяется при наличии у пациентки мигрени или преждевременных сердечно-сосудистых событий (до 50 лет) в ее семейном анамнезе.
Ожирение
Данное состояние следует рассматривать в нескольких аспектах. Прежде всего это ФР ССЗ, распространенность которых неуклонно растет. Второй аспект – относительно высокая частота недостаточной эффективности гормональной контрацепции: при ожирении риск нежелательной беременности возрастает в 4 раза [34]. Следует отметить, что ожирение уже само по себе связано с повышенным риском ВТЭ. Их относительный риск возрастает по мере увеличения ИМТ с 2,2 для ИМТ 20–25 до 3,1–3,7 при ИМТ выше 25 кг/м2 (Collaborative Study, ВОЗ, 1995). Тем не менее показано, что сочетание ожирения и гормональной контрацепции обладает лишь аддитивными свойствами и не сопровождается дополнительным возрастанием рисков, как это происходит с другими ФР. Существуют данные, согласно которым ОР ИМ, который у женщин с ожирением составляет 3,4, повышается до 5,1 при сочетании ожирения и приема гормональных контрацеп-тивов [30].
Изменения метаболизма и увеличение объема распределения с теоретической точки зрения могут приводить к уменьшению эффективности гормональной контрацепции. Однако результаты исследований типа «случай–контроль» противоречивы. В то время как некоторые говорят о значительном увеличении риска нежелательной беременности при ожирении в 2–4 раза [35, 36], другие подвергают сомнению их правоту [37].
Тактика врача при назначении гормональной контрацепции пациенткам с ожирением [11]
Гормональная контрацепция для женщин с ожирением в отсутствие других ФР считается приемлемым методом контроля рождаемости. Хотя риск ВТЭ для женщин с ожирением (особенно висцеральным!) и избыточной массой тела повышен, он все равно остается достаточно низким. При сочетании нескольких ФР предпочтение следует отдавать прогестиновым контрацептивам или негормональным средствам. По мнению экспертов как США, так и европейских стран, прогестиновые препараты в таблетированной, инъекционной, внутриматочной, трансдермальной формах могут использоваться при ожирении без каких-либо ограничений.
Курение
Известны данные об экспоненциальном росте риска инсульта и ИМ с возрастом для курящих женщин, принимающих КОК. Артериальные тромбозы, по всей видимости, обусловлены влиянием этого «смертельного дуэта» на тромбообразование, а не на скорость развития атеросклероза. Протромботический эффект эстрогенов усиливается за счет ингибирования образования простациклина, повышенной выработки тромбоксана A2 и ингибитора фибринолиза PAI-1, а также уменьшения активности антитромбина III. Относительный риск ИМ находится в линейной зависимости от числа выкуриваемых сигарет и достигает 12,5 при курении более 20 сигарет в сутки. Содержание ЭЭ также влияет на риск тромбоза: снижение дозы эстрогенного компонента с 100–150 до 30 мкг в сутки привело к значительному снижению (но не исчезновению!) риска кардиоваскулярных осложнений [9]. Сочетание курения и приема КОК повышает риск развития геморрагического инсульта, который зависит от возраста, дозы ЭЭ и числа сигарет. При оценке индивидуального риска следует всегда иметь в виду эти три переменные величины, уделяя особое внимание возрасту, поскольку встречаемость ССО низка лишь среди молодых.
Тактика врача при назначении гормональной контрацепции курящим пациенткам [11]
Курильщицам старше 35 лет комбинированная контрацепция противопоказана. Если курящая женщина моложе 35 лет, в отсутствие сердечно-сосудистых ФР преимущества КОК преобладают над риском. Прогестиновые препараты (в таблетированной, инъекционной формах, в т.ч. импланты и внутриматочные устройства) можно применять вне зависимости от возраста и числа выкуриваемых сигарет.
Обобщая результаты эпидемиологических исследований, посвященных влиянию КОК на сердечно-сосудистую систему, можно сделать следующий вывод: для женщин моложе 40 лет без ФР этот метод контрацепции не связан с повышением частоты ССЗ. Риск осложнений при применении КОК возрастает при наследственной тромбофилической предрасположенности, наличии сердечно-сосудистой патологии, ожирении и курении, а также при сочетании нескольких ФР.
Рекомендации по применению КОК пациентками с повы-шенным риском развития ССО
За последние 40 лет достигнуты значительные успехи в разработке новых контрацептивных средств: содержание гормонов в КОК значительно снизилось, появились новые лекарственные формы гормональной контрацепции – пластыри, влагалищные кольца, а также прогестагеновые имплантационные и внутриматочные контрацептивы.
Большинство женщин могут применять контрацептивные средства не только без вреда, но и с пользой для собственного здоровья, однако теоретически контрацепция может влиять на течение и лечение ряда заболеваний и состояний, тем самым представляя угрозу здоровью.
В настоящее время большинство авторов считают, что КОК оказывают гораздо меньшее влияние на частоту ССЗ, чем такие ФР, как возраст, ИМТ, курение, АГ и СД, однако в практической деятельности при назначении гормональных противозачаточных средств нельзя не учитывать возможности неблагоприятного их действия на сердечно-сосудистую систему [9, 38, 39]. Врач должен оценивать наличие всех ФР и с учетом этого разрабатывать дальнейшую программу тактики и контроля приема КОК.
Так, например, прием КОК при осложненном СД, АГ, врожденных тромбофилиях повышает риск ССО.
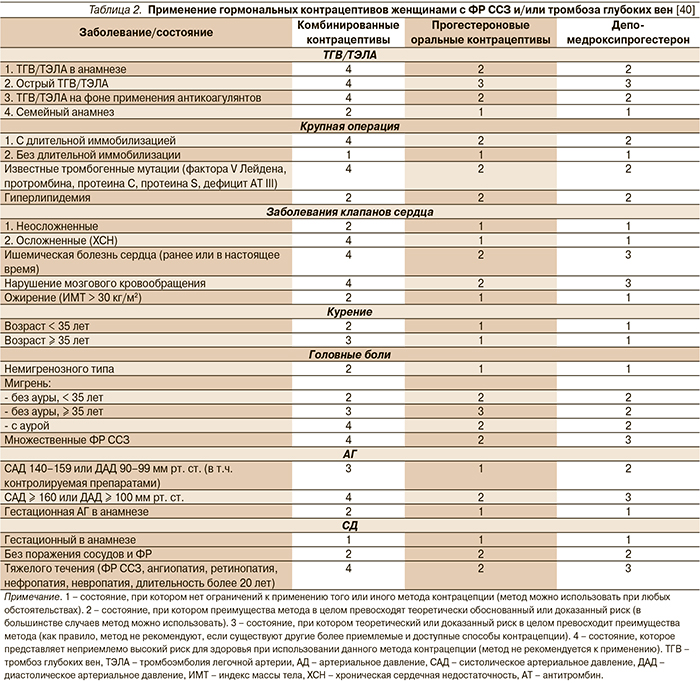
С учетом научно обоснованных данных об эффективности и безопасности тех или иных контрацептивов были разработаны международные медицинские критерии приемлемости методов контрацепции и практические рекомендации по их использованию при различных заболеваниях и состояниях [40]. Последние редакции этих рекомендаций были выпущены под эгидой ВОЗ в 2009 г. и адаптированы в России в виде Национальных медицинских критериев приемлемости методов контрацепции (2012) [41] (табл. 2).
Итак, к абсолютным противопоказаниям к использованию КОК относят выявление у женщины состояний, связанных с высоким риском развития тромбозов и тромбоэмболий: ИБС, перенесенные инсульты и динамические нарушения мозгового кровообращения по ишемическому типу, мигрень с аурой, заболевания периферических сосудов, СД с осложнениями или ФР ССЗ, ТГВ или ТЭЛА в анамнезе или в настоящее время, множественные ФР ССЗ, операции с длительной иммобилизацией. В тех случаях, когда применение КОК противопоказано, разумной альтернативой будут служить ПОК или негормональные (механические, барьерные и др.) контрацептивы.



