Введение
Инфекции ЛОР-органов, несмотря на значительные успехи в диагностике и лечении, остаются наиболее распространенными среди как взрослых, так и детей. В зимние периоды заболеваниями ЛОР-органов ежедневно страдают 6–8 человек из 1000, в летнее время это число снижается, но остается достаточно высоким – 2–3 на 1000 [1]. К инфекциям ЛОР-органов относятся наружные и средние отиты, синуситы, тонзиллофарингиты, эпиглоттиты, ларингиты. Эти инфекции могут вызываться различными вирусами и бактериями, требующими назначения рациональной терапии. В условиях современного фармацевтического рынка, перенасыщенного широко рекламируемыми антимикробными средствами для лечения ЛОР-органов, выбор оптимального антибактериального препарата (АБП) далеко не всегда легок. Рекомендации по рациональной антибактериальной терапии (АБТ) регулярно пересматриваются в связи с регистрацией новых АБП, а также накоплением информации об особенностях течения патологии ЛОР-органов и сравнительной эффективности различных АБП. Для ведения пациентов с ЛОР-патологией в разное время предлагались практически все классы АБП. Однако сегодня многие из них практически утратили свое значение и уже не рассматриваются как оптимальные средства терапии. Причиной тому стали разнообразные факторы, прежде всего неприемлемый профиль безопасности, плохая переносимость, распространение устойчивых микроорганизмов и наконец неудобство применения. В связи с этим особый интерес представляют препараты, прошедшие проверку временем и сохранившие высокую активность в отношении основных возбудителей ЛОР-заболеваний. Одним из них является 14-членный макролид рокситромицин, который уже более 25 лет с успехом применяется в клинической практике. Препарат был разработан фармацевтической компанией Hoechst Uclaf и появился на рынке в 1987 г. [2]. Рокситромицин обладает особенностями, отличающими его от других представителей класса макролидов, что позволяет рассматривать его в качестве клинически значимого АБП при лечении всех ЛОР-заболеваний. В настоящее время на фармацевтическом рынке препарат представлен под торговым названием «Эспарокси», производителем которого является Линдофарм ГмбХ, Германия.
Фармакологические свойства рокситромицина (Эспарокси)
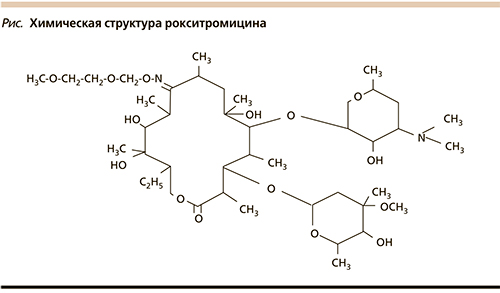
Эспарокси – полусинтетический антибиотик группы макролидов для приема внутрь. Оказывает бактериостатическое действие: связываясь с 50S-субъединицей рибосом, подавляет реакции транслокации и транспептидации, процесс образования пептидных связей между аминокислотами и пептидной цепью, тормозит синтез белка рибосомами, в результате чего угнетает рост и размножение бактерий. Однако следует отметить, что рокситромицин проявляет свою активность за счет создания более высоких внутриклеточных концентраций [3, 4]. Химическая структура рокситромицина представлена на рисунке [5].
Рокситромицин является типичным представителем 14-членных макролидов, в связи с чем спектр его активности приближается к таковому эритромицина, но при этом имеет ряд преимуществ.
Модификация лактонного кольца привела к появлению трех кардинальных отличий рокситромицина от эритромицина:
- расширение спектра антибактериальной активности, прежде всего за счет грамотрицательной флоры (Haemophilus influenzae, Neisseria spp. и некоторых других грамотрицательных палочек);
- более высокая кислотоустойчивость и улучшенная всасываемость в желудочно-кишечном тракте (ЖКТ);
- способность создавать более высокие концентрации в клетках и увеличение продолжительности периода полувыведения [3].
Фармакокинетика
Эспарокси по сравнению с другими макролидами имеет более высокую биодоступность при приеме внутрь, более устойчив к действию соляной кислоты, лучше и быстрее всасывается в ЖКТ. Пища не влияет на полноту абсорбции рокситромицина, но, как правило, замедляет ее скорость [6]. Это одно из преимуществ рокситромицина перед другими макролидами, например азитромицином, который следует принимать только натощак, т.к. пища уменьшает степень его адсорбции почти в 2 раза.
Важной фармакокинетической особенностью рокситромицина является достижение наиболее высоких по сравнению с другими макролидными антибиотиками концентраций в крови. Максимальная концентрация в плазме (Cmax) после перорального приема 150 мг препарата развивается через 2 часа и достигает в среднем 6,6–7,9 мг/л [3].
Рокситромицин хорошо распределяется в организме. Высокие концентрации, сопоставимые с уровнем в плазме и превышающие МПК90 для чувствительных микроорганизмов, создаются как в ЛОР-органах (слюне, миндалинах, среднем ухе, околоносовых пазухах), так и в легких, слезной жидкости, предстательной железе, миометрии, эндометрии, синовиальной жидкости, коже, других органах и средах [3].
У детей как после однократного приема (2,5 мг/кг), так и при курсовом назначении (2,5 мг/кг 2 раза в сутки) высокие уровни рокситромицина определяются в миндалинах, аденоидах и экссудате среднего уха [7].
Рокситромицин в организме почти не подвергается биотрансформации. Не более 5 % введенной дозы экскретируется в метаболизированном виде. Значительная часть препарата выделяется через ЖКТ и не более 10 % – с мочой. Кроме того, до 15 % могут элиминироваться через легкие [3]. Рокситромицин в меньшей степени, чем эритромицин, угнетает цитохром Р450, поэтому его взаимодействие с препаратами, метаболизирующимися в печени при участии микросомальных ферментов, менее вероятно. Так, не выявлено клинически значимого взаимодействия данного антибиотика с карбамазепином, варфарином, дизопирамидом, оральными контрацептивами, что очень важно для пациентов, которые принимают данные пре-параты.
Период полувыведения для взрослых в среднем составляет 8–10 часов и может увеличиваться до 15 часов при выраженной почечной недостаточности (клиренс креатинина < 10 мл/мин), но коррекции дозы в этом случае не требуется, как и для пациентов, находящихся на диализе [8]. Длительный период полувыведения позволяет назначать рокситромицин взрослым 1 раз в день, что очень удобно для пациента. Для детей период полувыведения имеет, как правило, бо'льшую продолжительность, чем для взрослых.
Спектр антимикробной активности рокситромицина (Эспарокси) в ЛОР-патологии
Эспарокси высокоэффективен при лечении ЛОР-инфекций: острого синусита (ОС) и хронического синусита (ХС), острого среднего отита (ОСО) и хронического среднего отита (ХСО), наружного отита (НО), острого тонзиллофарингита (ОТ), эпиглоттита.
Грамположительные кокки (ОСО, ХСО, НО, ОС, ХС, ОТ): рокситромицин активен в отношении Staphylococcus aureus (метициллиночувствительных штаммов – MSSA), Streptococcus pneumoniae, включая пенициллинорезистентные штаммы, β-гемолитического стрептококка группы А (БГСА).
Грамположительные палочки (ХСО, ХС, эпиглоттит): рокситромицин активен в отношении Listeria monocytogenes (МПК50 – 0,25 мг/л), Corynebacterium diphtheriae (МПК50 – 0,008 мг/л), Lactobacillus spp. (МПК50 – 0,06 мг/л). По уровню активности in vitro в отношении данных возбудителей рокситромицин несколько превосходит азитромицин [3, 9].
Грамотрицательные кокки (ОСО, ХСО, ОС, ХС: рокситромицин высокоактивен в отношении Moraxella catarrhalis (МПК50 – 0,12 мг/л) [9].
Грамотрицательные палочки (ОСО, ХСО, НО, ОС, ХС, ОТ, эпиглоттит): как и другие макролиды, рокситромицин активен в отношении Haemophilus ducreyi, Bordetella pertussis, Campylobacter jejuni и Gardnerella vaginalis, H. influenzае.
Внутриклеточные патогены (ОСО, ОТ): рокситромицин высокоактивен in vitro в отношении Mycoplasma pneumoniae, Chlamydia pneumoniae и Legionella spp. [9, 10, 11].
Анаэробы (ХС, эпиглоттит): рокситромицин, как и другие макролиды, проявляет активность в отношении Porphyromonas spp., Propionibacterium spp. и Fusobacterium spp. [9, 12].
Обоснованность применения Эспарокси в ЛОР-патологии
Для лечения ЛОР-патологии бактериальной природы применяются два основных класса антибиотиков: β-лактамы и макролиды. Соответственно, наибольший практический интерес представляют данные об активности различных представителей именно этих классов АБП в отношении ведущих возбудителей ЛОР-инфекций. У штаммов C. pneumoniae и M. pneumoniae в настоящее время отсутствует клинически значимая антибиотикорезистентность (АБР) к макролидам [13], однако все β-лактамы в отношении этих атипичных возбудителей не активны.
У типичных бактериальных возбудителей ЛОР-инфекций возможно развитие резистентности как к β-лактамам, так и к макролидам. Поэтому возможность эффективного применения различных препаратов этих классов для лечения в оториноларингологии во многом определяется частотой выделения возбудителей, имеющих различные механизмы приобретенной АБР в конкретном регионе.
Основным источником информации о чувствительности респираторных патогенов (S. pyogenes, S. pneumoniae и H. influenzae) к антибиотикам в РФ являются результаты многоцентрового проекта ПеГАС, проведенного в различных городах нашей страны с 1999 по 2009 г. Они свидетельствуют о том, что ситуация с АБР возбудителей инфекций дыхательных путей (ИДП) в России вполне благополучная [13, 14].
Не вызывает сомнений, что наибольшую активность in vitro в отношении штаммов БГСА проявляют β-лактамные антибиотики, к которым случаев развития приобретенной АБР у S. рyogenes не отмечено [14]. Однако частота приобретенной АБР к макролидам у штаммов пиогенного стрептококка также не превышает 10 %, что позволяет рассматривать антибиотики этого класса в качестве приемлемой альтернативы пенициллинам при лечении стрептококкового тонзиллофарингита.
Среди штаммов пневмококка, выделенных на территории РФ в 2006–2009 гг., изоляты с промежуточным уровнем резистентности к пенициллину составили 9,1 %, а с высоким уровнем (МПК пенициллина ≥ 2 мг/л) – 2,1 % [14]. В то же время в некоторых регионах РФ (в частности, в Дальневосточном федеральном округе) частота выделения пенициллинорезистентных пневмококков (ПРП) существенно выше и составляет 17,6 и 7,4 % штаммов с промежуточным и высоким уровнем АБР соответственно [15]. При анализе данных о распространенности ПРП оказалось, что частота выделения штаммов S. pneumoniae, не чувствительных к пенициллину, достигает 17,7–27,2 %.
Класс-препаратом определения чувствительности пневмококков к 14-членным макролидам и рокситромицину считается эритромицин [16]. По данным исследования ПеГАС-III, в среднем по России частота выделения штаммов S. pneumoniae, не чувствительных к эритромицину, составляет всего 4,6 % [15]. Таким образом, более 95 % штаммов пневмококков, выделенных на территории РФ, чувствительны ко всем макролидным АБП, в частности к рокситромицину. Примечательно также, что ситуация с резистентностью S. pneumoniae к макролидам благополучная во всех регионах РФ и не зависит от распространенности ПРП (от 9,1 до 25 % не чувствительных к пенициллину изолятов) [15]. Среди детей всех возрастных групп показатели устойчивости штаммов S. pneumoniae к макролидам в 2–3 раза ниже, чем к пенициллину, и даже в наиболее проблемных возрастных группах (1–3 года и 3–7 лет) не превышают 10 % (9,9 и 7,8 % соответственно). Подобная ситуация уникальна, поскольку в большинстве стран Европы частота резистентности S. pneumoniae к макролидам выше или соответствует распространенности ПРП [17]. Кроме того, во многих странах мира, в т.ч. пограничных с РФ, показатели резистентности к макролидам у S. pneumoniae и S. pyogenes существенно выше, чем в нашей стране [17]. Следовательно, при разработке рекомендаций по лечению инфекций, вызванных перечисленными микроорганизмами, следует обязательно учитывать российские особенности АБР возбудителей ИДП.
Изоляты гемофильной палочки, выделенные в РФ, сохраняют высокую чувствительность к аминопенициллинам: 95 % штаммов чувствительны, а АБР у оставшихся 5 % штаммов H. influenzae связана с продукцией β-лактамаз и преодолевается путем назначения ингибиторозащищенных препаратов. Активность различных макролидов в отношении H. influenzae неодинакова. Известно, что благодаря уникальному химическому строению молекулы рокситромицин активен в отношении H. influenzae [18].
В исследовании in vitro продемонстрирована способность рокситромицина препятствовать образованию биопленок штаммами, а также вызывать уменьшение массы и толщины уже сформированной биопленки. Поскольку образование биопленок считается одним из ведущих механизмов, обеспечивающих персистенцию и хронизацию бактериальной инфекции, эти данные могут служить дополнительным основанием к назначению рокситромицина при ЛОР-патологии [19].
Постантибиотический эффект Эспарокси
Рокситромицину присущ постантибиотический эффект, под которым понимается персистирующее ингибирование жизнедеятельности бактерий после их кратковременного контакта с АБП [20]. В основе эффекта лежат необратимые изменения в рибосомах микроорганизма, следствием чего является стойкий блок транслокации. За счет этого общее антибактериальное действие препарата усиливается и пролонгируется, сохраняясь в течение срока, необходимого для ресинтеза новых функциональных белков микробной клетки [21].
Наиболее отчетливый постантибиотический эффект, причем более длительный, чем у бензилпенициллина, рокситромицин проявляет в отношении S. pneumoniae, S. pyogenes, и H. influenzae [22].
Предполагается, что длительная терапия макролидами видоизменяет характер взаимодействия патогена с макроорганизмом, трансформируя его из инфекции в относительно доброкачественную колонизацию. А у некоторых больных при этом наблюдается и эрадикация возбудителя. С феноменом «трансформации инфекции в колонизацию» может быть связано нередко наблюдаемое при длительном применении макролидов более быстрое улучшение клинических и лабораторных показателей по сравнению с бактериологическими параметрами [23].
С учетом приведенных выше данных макролиды, в частности рокситромицин (Эспарокси), в РФ могут рассматриваться не только как средство, направленное против атипичных возбудителей, но и как эффективные препараты лечения ЛОР-патологии, вызванных как атипичными, так и типичными бактериальными патогенами – S. pyogenes, S. pneumoniae и H. influenzae.
Данные клинических исследований препарата Эспарокси
Результаты российских и зарубежных исследований подтверждают высокую эффективность рокситромицина при лечении ЛОР-инфекций как у взрослых, так и у детей [24–27]. Рассмотрим целесообразность назначения и эффективность препарата Эспарокси при наиболее часто встречаемой ЛОР-патологии.
Стрептококковый тонзиллофарингит
Единственный распространенный возбудитель тонзиллофарингита, при выделении которого показана АБТ, это БГСА; целью АБТ в данном случае является не только устранение симптомов тонзиллофарингита, но и прежде всего эрадикация БГСА из ротоглотки и профилактика возникновения поздних иммуноопосредованных осложнений (острой ревматической лихорадки и острого гломерулонефрита) [28].
С учетом универсальной чувствительности БГСА к β-лактамам АБП выбора в терапии тонзиллофарингита, вызванного БГСА, являются пенициллины, при наличии в анамнезе аллергических реакций на β-лактамы – макролиды и линкозамиды [29].
За последние годы появился ряд сообщений о случаях неэффективности пенициллина для эрадикации S. pyogenes со слизистой оболочки миндалин и задней стенки глотки, частота которых может достигать 30–40 % [30, 31]. Объединенные данные двух рандомизированных многоцентровых исследований [30, 32] показали, что, несмотря на 100 %-ную чувствительность S. pyogenes к пенициллину, микробиологическая неэффективность (отсутствие эрадикации БГСА из носоглотки на 10–14-й или 29–31-й день) отмечена среди 35 % пациентов, получавших феноксиметилпенициллин, и у 37 % больных, получавших бензилпенициллин [32].
Среди основных причин неудачной эрадикации БГСА отмечают низкую комплаентность 10-дневных курсов пенициллина, повторное заражение стрептококками от инфицированных членов семьи, разрушение пенициллина ко-патогенами полости рта, недостаточное проникновение АБП в ткань миндалин и внутрь эпителиальных клеток [30]. В ходе исследования, выполненного на культуре эпителиальных клеток слизистой оболочки глотки человека (HEp-2), показано, что БГСА, локализованные внутри клеток, сохраняли жизнеспособность, несмотря на воздействие пенициллина [32]. В то же время антибиотики группы макролидов обладали бактерицидным эффектом в отношении данных микроорганизмов.
Высокая эффективность рокситромицина при лечении ОТ подтверждена результатами многих рандомизированных клинических исследований. Так, клиническая эффективность рокситромицина, назначенного 10-дневным курсом, была сопоставимой с таковой β-лактамов (амоксициллина/клавуланата, цефаклора) и других макролидов (азитромицина, кларитромицина) при лечении острого фарингита, тонзиллита [24–26, 33]. В другом клиническом исследовании эффективность рокситромицина, назначенного однократно (300 мг/сут) пациентам с тонзиллофарингитом, сравнивалась с амоксициллином/клавуланатом (1,0 г 2 раза в сутки). По окончании терапии эффективность лечения рокситромицином составила 82 %, амоксициллином/клавуланатом – 78 % [34].
Высокая клиническая и бактериологическая эффективность рокситромицина была продемонстрирована и в многоцентровом контролируемом исследовании, включившем 205 детей с тонзиллитом, фарингитом, ринофарингитом, пневмококковой пневмонией, импетиго и пиодермией [35]. Клиническое выздоровление при приеме препарата в дозе 6 мг/кг/сут в течение 8 дней наблюдалось у 87,5–100,0 % больных. В группе пациентов, получавших рокситромицин, отмечена высокая степень эрадикации S. pyogenes, S. pneumoniae, S. aureus, H. influenzae и М. рnеumoniae.
Высокая эффективность и наилучшая переносимость рокситромицина получили еще одно подтверждение в клиническом исследовании профессора Т.И. Гаращенко (РГМУ). Рокситромицин и другие макролиды назначались детям при обострении хронического тонзиллита [27].
По данным одного из исследований, рокситромицин в дозе 150 мг 1 раз в сутки был приемлемой альтернативой пенициллину и эритромицину для профилактики наиболее частого осложнения ОТ – ревматической лихорадки [36].
Средний отит
Острый средний отит – распространенное заболевание, наиболее часто требующее назначения АБП. Основные возбудители среднего отита – S. pneumoniae, M. catarrhalis, H. influenzae. У детей старшего возраста также может быть выделен S. pyogenes, у детей дошкольного возраста – микоплазмы, хламидии [29].
С учетом данных о ведущей роли S. pneumoniae, H. influenzae и S. pyogenes в этиологии ОСО очевидно, что АБП, назначаемые для лечения данной нозологии, должны обладать высокой активностью в отношении этих возбудителей. На основании данных по АБР перечисленных микроорганизмов в РФ для лечения ОСО есть два класса АБП: β-лактамы (амоксициллин, амикацин и цефалоспорины II–III поколений) и современные макролиды, т.е. рокситромицин [13, 29].
В многочисленных контролируемых сравнительных исследованиях [25, 34, 37] показано, что рокситромицин не уступает амоксициллину/клавуланату, цефаклору, другим новым макролидам (азитромицину и кларитромицину), а нередко превосходит некоторые препараты, особенно пенициллины, по эффективности или безопасности. Так, в рандомизированной работе с участием 85 пациентов в возрасте от 18 лет и 91 года с ОСО рокситромицин показал выше эффективность по сравнению с амоксициллин/клавуланатом. Эффективность рокситромицина (300 мг 1 раз в сутки) была оценена в сравнении с амоксициллином/клавуланатом (1,0 г 2 раза в сутки). При суммарном анализе по окончании терапии эффективность лечения рокситромицином составила 82 %, амоксициллином/клавуланатом – 78 % [34]. Согласно данным еще одного исследования, рокситромицин не отличался по эффективности от амоксициллина/клавуланата при ЛОР-инфекциях различной локализации, но, как правило, лучше переносился [38]. В крупном международном несравнительном открытом исследовании, в которое были включены 40 тыс. пациентов, терапия рокситромицином продолжительностью от 7 до 14 дней сопровождалась клиническим эффектом более чем у 95 % больных инфекциями верхних и нижних отделов дыхательных путей (выздоровление или улучшение). При этом частота отмеченных нежелательных явлений не превышала 4 % [34, 39].
Рокситромицин 300 мг один раз в день сравнивали с кларитромицином 250 мг дважды в день в открытом рандомизированном исследовании 200 пациентов с инфекциями верхних дыхательных путей (синусит, фарингит и средний отит). Средняя продолжительность лечения составила 9 дней. Рокситромицин был более эффективным (р < 0,01), особенно при лечении среднего отита и фарингита, и лучше переносился (только 4 % побочных эффектов; р < 0,05) [25].
Эффективность рокситромицина в отношении детей с ОСО оказалась одинаково высокой при применении как два, так и один раз в сутки. Детям с массой тела менее 10 кг рокситромицин назначался в дозе 5 мг/кг/сут, более 10 кг – 10 мг/кг/сут [40].
В ряде других исследований показана высокая клиническая эффективность рокситромицина при инфекциях верхних и нижних отделов дыхательных путей – ОСО (91–96 %), пневмонии и фарингите (100 %) [41–44].
Рокситромицин активен в отношении всех возбудителей ОСО, хорошо переносится, принимается перорально, поэтому относится к препаратам выбора для лечения среднего отита.
Синусит
Риносинуситы являются пятой по частоте причиной назначения АБП (от 9 до 21 %). Наиболее частыми бактериальными возбудителями острого риносинусита являются S. pneumoniae (30–66 %), H. influenzae (20–30 %) и M. сatarrhalis (12–28 %). Реже в качестве этиологических агентов выступают S. pyogenes, Streptococcus spp., S. aureus, анаэробы и др. [29].
При бактериальной этиологии острого риносинусита показана АБТ, целями которой являются клиническое выздоровление пациента, эрадикация возбудителя инфекции и восстановление стерильности околоносовых пазух. Антибиотикотерапия уменьшает тяжесть и длительность клинических симптомов заболевания, предупреждает развитие гнойных осложнений, позволяет сокращать сроки лечения, предотвращать рецидивирование и переход процесса в хроническую форму [29].
Поскольку в РФ не распространены штаммы S. pneumoniae, устойчивые к пенициллину и макролидам, и β-лактамазопродуцирующие штаммы H. influenzae, а M. сatarrhalis крайне редко выделяются при ИДП у российских пациентов, в качестве препарата выбора при нетяжелом остром риносинусите допустимо и целесообразно использовать амоксициллин в обычных терапевтических дозах.
В качестве альтернативы могут использоваться амоксициллин/клавуланат или цефуроксима аксетил. При аллергии на β-лактамы назначают макро-лиды [29].
В открытом рандомизированном исследовании, в котором приняли участие 60 пациентов с острым и рецидивирующим синуситом, бактериологическая и клиническая эффективность рокситромицина 150 мг дважды в день сравнивалась с амоксициллином/клавуланатом 625 мг трижды в день. Пункции верхнечелюстных пазух выполнены 52 (83,3 %) пациентам. Микроорганизмы получены в 96 % случаев, причем все были чувствительны к рокситромицину и амоксициллину/клавуланату. Клиническая эффективность составила 93,1 % у пациентов, получавших рокситромицин, и 88,8 % у получавших амоксициллин/клавуланат. Переносимость была значительно лучше в группе рокситромицина: 3,4 % больных имели легкие побочные эффекты со стороны ЖКТ. Нежелательные явления в группе амоксициллин/клавуланата зарегистрированы у 25,9 % пациентов (р < 0,05). Таким образом, рокситромицин продемонстрировал клиническую и бактериологическую эффективность, аналогичную амоксициллин/клавуланату, но с лучшей переносимостью для лечения острого и рецидивирующего синусита [24].
Доказана эффективность рокситромицина в отношении одонтогенных синуситов [45]. По результатам многоцентрового двойного слепого исследования пациентов с острыми ородентальными инфекциями рокситромицин, назначавшийся в дозе 150 мг 2 раза в сутки, оказался сопоставимым по клинической эффективности с эритромицином этилсукцинатом, который применялся по 1,0 г 2 раза в сутки со средней продолжительностью терапии 8 дней, – 94 и 91 % соответственно [46].
Комплаентность
Возможность однократного приема – важное свойство препарата Эспарокси, обеспечивающее высокую комплаентность пациентов и, несомненно, эффективность лечения. Последнее заключение исходит из фармакокинетической/фармакодинамической концепции, основными требованиями которой является надежное перекрытие тканевой концентрацией препарата МПК для возбудителя в течение определенного времени. Необходимо отметить, что, согласно данным специально проведенного многоцентрового рандомизированного исследования, включившего 1588 пациентов с инфекциями различной локализации, эффективность антибиотика одинаково высока независимо от того, назначается он однократно в дозе 300 мг в сутки или в два приема по 150 мг [47]. Однократный прием в сутки препарата Эспарокси 300 мг обеспечивает более высокую комплаентность и представляется наиболее оптимальным для взрослых.
Безопасность Эспарокси
Макролиды рассматриваются как одна из самых безопасных групп лекарственных средств, а рокситромицин отличается наилучшей переносимостью среди макролидов, что является одним из важнейших его достоинств [48–51].
Нежелательные лекарственные реакции развиваются только у 3–4 % пациентов. Как правило, доминируют симптомы со стороны ЖКТ – абдоминальные боли, тошнота, диарея. Улучшенная переносимость рокситромицина по сравнению с эритромицином безусловно связана со значительно менее выраженным влиянием на кишечную флору и моторику ЖКТ. Рокситромицин очень редко вызывает аллергию, может использоваться больными бронхиальной астмой и другими заболеваниями аллергической природы [3].
Макролиды, в частности рокситромицин, плохо проникает через плаценту и в связи с этим создает низкие концентрации в кровотоке плода – 3,0; 2,6 % соответственно от концентрации в крови матери. В то же время уровень кларитромицина достигает 6,1 % от концентрации в крови матери [52].
В крупном клиническом исследовании не было выявлено статистически значимого повышения частоты встречаемости аномалий развития при использовании рокситромицина беременными, тогда как применение олеандомицина ассоциировалось с трехкратным повышением риска рождения незрелого плода [53].
Заключение
Большое значение в оториноларингологии имеет немедленно начатое лечение и правильно подобранная терапия с высокой клинической и бактериологической эффективностью. Антибактериальные препараты в ЛОР-практике должны быть высокоэффективными, безопасными и хорошо переноситься пациентами. Рациональное использование антибиотиков предупреждает развитие АБР, уменьшает продолжительность заболевания и предупреждает развитие осложнений. Макролиды существенно расширили возможности лечения ЛОР-патологии и позволили разработать качественные стандарты терапии. Высокая бактериальная эффективность, хорошая переносимость, удобство перорального приема – все это позволяет рекомендовать как взрослым, так и детям препарат рокситромицин, в частности Эспарокси, для использования в оториноларингологической практике.



