Серьезной проблемой здравоохранения во всем мире является увеличение распространенности остеопороза (ОП), проявления и осложнения которого обусловлены уменьшением массы и изменением микроархитектоники костной ткани и снижением прочности кости. В перспективе эта проблема приобретет еще более серьезный и глобальный характер, поскольку в современном обществе наблюдается увеличение продолжительности жизни и всеобщее постарение населения.
Первичный ОП – самостоятельное заболевание, которое развивается в любом возрасте, однако наиболее часто он встречается у женщин старше 50 лет в постменопаузальном периоде [1, 6]. За первые 5 лет после наступления менопаузы потеря костной массы у женщины может составить до трети от костной массы, утраченной за всю жизнь [6]. Вторичный ОП в большинстве случаев является симптомом других заболеваний или следствием проводимого лечения. Известно, что на вторичный ОП приходится более 2/3 случаев у мужчин, более половины у женщин в пре- или перименопаузе и приблизительно пятой части женщин в постменопаузе. Причины вторичного ОП многочисленны, а потенциальный риск переломов сопоставим с риском при первичном ОП. В общей структуре ОП на вторичные формы приходится от 15 до 20%, причем наибольшую часть составляет ОП при эндокринной патологии [17].
Профилактика ОП является наиболее важной задачей в проблеме ОП [4, 10]. Меры первичной профилактики включают обязательную оценку соответствия суточного потребления кальция рекомендованным возрастным нормативам, начиная с раннего детства и в течение всей последующей жизни, адекватное потребление кальция женщинами в периоды беременности и лактации [5]. При анализе питания особое внимание необходимо уделять потреблению молочных продуктов, которые являются основным источником кальция, поступающего с пищей. Вторичную профилактику ОП необходимо осуществлять, если имеют место достоверные факторы риска ОП, такие как ранняя менопауза, гипогонадизм, лечение глюкокортикоидами, антиконвульсантами, а также длительная супрессивная терапия тиреоидными гормонами. Наряду с этим вторичная профилактика необходима пациентам с заболеваниями, при которых повышается риск развития вторичного ОП (эндокринные заболевания, заболевания органов желудочно-кишечного тракта – ЖКТ, почек и др.) [17].
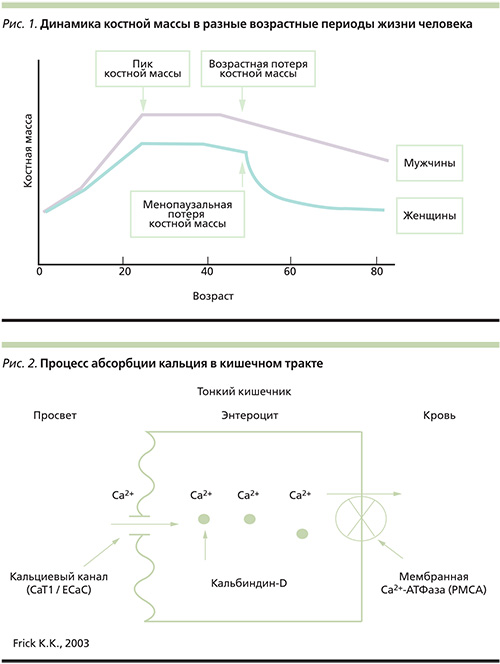
Костная ткань представляет собой активную динамическую систему, в которой постоянно происходят процессы резорбции старой кости и образования новой. Эти процессы составляют цикл костного ремоделирования, который начинается еще в утробе матери и продолжается в течение всей жизни человека [5, 6]. Согласно имеющимся данным, 90% костной массы формируются до 18 лет. На протяжении жизни человека скорость и направленность костного ремоделирования меняются (рис. 1). До 35–40 лет поддерживается нулевой баланс; потери костной массы начинаются с конца третьего десятилетия жизни, их скорость зависит от пола и возраста. Более половины объе-ма кости составляют неорганические минеральные вещества (кальций, фосфор, небольшое количество магния), которые поступают вместе с пищей. Кроме этого, в состав неорганического матрикса входят бикарбонаты, цитраты, фториды, соли магния, калия, натрия. Минеральные вещества придают костной ткани важные свойства: прочность и твердость. Установлено, что 99% кальция находятся в костях скелета в виде кристаллов гидроксиапатита – а10(РО4)6(ОН)2 – основного депо кальция в организме, и только 1 % – во внеклеточной жидкости и мягких тканях [1, 11]. Кроме того, около половины всего магния организма содержится в костях. Для поддержания оптимальной костной массы необходимо регулярное поступление остеотропных минералов, особенно кальция, достаточное для возмещения ежедневных потерь. Примерно 90% органического матрикса кости представлено коллагеном I типа, который обеспечивает упругость и прочность кости при различных нагрузках. Коллаген препятствует развитию хрупкости кости, приводящей к низкотравматическим переломам.
 Достаточное поступление кальция в организм необходимо в любом возрасте, однако основная масса костной ткани формируется в детстве и пубертатном периоде, когда процессы костеобразования преобладают над костной резорбцией, поэтому в это время особенно важно адекватное потребление кальция. Нормальный кальциевый баланс в организме поддерживается четким взаимодействием трех систем, включая ЖКТ, кости и почки. Максимальная абсорбция кальция в ЖКТ, составляющая около 50–60% от его суточного потребления, характерна для детского и подросткового возраста. Заметное снижение всасывания кальция происходит после 60 лет, причем чем ниже потребление кальция, тем больше выражено возрастное уменьшение его абсорбции [1, 19]. Пожилые люди плохо адаптируются к изменчивости в потреблении кальция, при этом кальциевый баланс у них в большей степени, чем у молодых лиц, зависит от поступления кальция в организм. Поэтому крайне важно своевременное восполнение дефицита пищевого кальция в этой возрастной группе.
Достаточное поступление кальция в организм необходимо в любом возрасте, однако основная масса костной ткани формируется в детстве и пубертатном периоде, когда процессы костеобразования преобладают над костной резорбцией, поэтому в это время особенно важно адекватное потребление кальция. Нормальный кальциевый баланс в организме поддерживается четким взаимодействием трех систем, включая ЖКТ, кости и почки. Максимальная абсорбция кальция в ЖКТ, составляющая около 50–60% от его суточного потребления, характерна для детского и подросткового возраста. Заметное снижение всасывания кальция происходит после 60 лет, причем чем ниже потребление кальция, тем больше выражено возрастное уменьшение его абсорбции [1, 19]. Пожилые люди плохо адаптируются к изменчивости в потреблении кальция, при этом кальциевый баланс у них в большей степени, чем у молодых лиц, зависит от поступления кальция в организм. Поэтому крайне важно своевременное восполнение дефицита пищевого кальция в этой возрастной группе.
Функции кальция в организме многообразны. Наряду с активным участием во всех физиологических процессах, протекающих в костной ткани, кальций регулирует клеточное деление, дифференцировку, пролиферацию и апоптоз, проведение нервных импульсов, цикл сокращениярасслабления скелетной мускулатуры, синтез и секрецию гормонов, ферментов, нейротрансмиттеров [1, 11, 18]. Существенно, что кальций участвует в поддержании тонуса сосудов, процессах свертывания крови и регуляции метаболизма гликогена, оказывает влияние на липидный обмен.
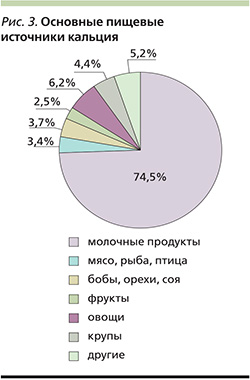
Важная роль в поддержании кальциевого гомеостаза и функционировании костной ткани принадлежит витамину D [1, 18]. Наряду с регуляцией кальциевого обмена витамин D влияет на ряд систем организма, таких как иммунная и кроветворная, контролирует клеточную пролиферацию, дифференцировку, апоптоз и ангиогенез [1, 12, 16]. Основной механизм, обеспечивающий всасывание 90% кальция, представляет собой витамин D-зависимый, активный транспорт кальция через энтероциты, который активизируется при дефиците витамина (рис. 2). Для реализации своего биологического действия витамин D, поступающий с пищей (эргокальциферол) и образующийся в коже из 7-дигидрохолестерола под воздействием ультрафиолетового света (холекальциферол), после 25-гидроксилирования в печени превращаются в 25(ОН)D3 (кальцидиол) – транспортную форму витамина D. После последующего 1α-гидроксилирования в почках при участии фермента 1α-гидроксилазы из 25(ОН)D3 образуется 1,25(ОН)2D3 (кальцитриол) – активная форма витамина D. Регуляция синтеза 1,25(ОН)2D3 в почках является непосредственной функцией паратиреоидного гормона (ПТГ); на его концентрацию по механизму обратной связи влияет содержание активного метаболита витамина D и Са2+ [21]. Снижение уровня сывороточного 25(ОН)D3 является наиболее информативным показателем дефицита витамина D (табл. 1). Недостаток витамина D может приводить к вторичному гиперпаратиреозу, что в свою очередь повышает риск переломов. Более того, D-дефицит вносит свой вклад в нарушение двигательной активности, в координацию движений и как следствие – к повышению риска падений, особенно у пожилых лиц [8, 12, 14].
К счастью, ОП – это одно из немногих заболеваний, когда возможна эффективная профилактика. Не вызывает сомнений тот факт, что сохранение костной массы – задача более легкая, чем прекращение потери или ее восстановление [1, 4, 14]. В настоящее время определены факторы риска ОП (например, возраст, масса тела, пол), часть из которых модифицируемые. Поэтому важно активно выявлять пациентов с заболеваниями, приводящими к снижению минеральной плотности кости, иначе говоря – формировать группы риска.
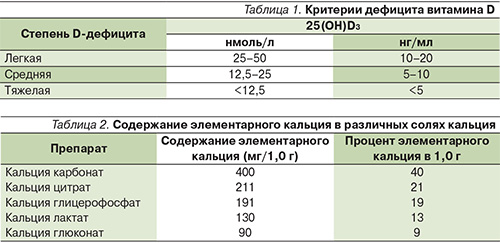
Достижение максимального пика костной массы в пределах индивидуальных генетических возможностей организма и уменьшение потерь костной массы в будущем составляют основу первичной профилактики ОП. Дефицит кальция и витамина D считается общепризнанным ведущим фактором развития практически всех форм ОП [15, 18, 20]. Следовательно, необходимо оптимальное потребление кальция во все возрастные периоды жизни человека, особенно в детстве, регулярные занятия физкультурой, достаточное пребывание на солнце, в т.ч. пожилых людей, отказ от вредных привычек, от увлечения несбалансированными диетами. Очевидно, что реальное потребление кальция с пищей в последние годы снижается, а основным источником являются молочные продукты (рис. 3).
Практика показывает, что в обычном суточном рационе человека, как правило, содержится не более 600–800 мг кальция [1, 5, 24]. В связи с этим в любом возрасте необходимо своевременно корригировать дефицит поступления кальция с пищей, активно используя препараты солей кальция [13, 20, 22].
Следует учитывать, что биоусвояемость кальция в значительной степени определяется химическими свойствами его солей [1, 6, 23]. В частности, соли кальция различаются по содержанию элементарного кальция, обусловливающего основные биологические эффекты. Это обстоятельство крайне важно учитывать при использовании конкретных препаратов для достижения оптимального потребления кальция (табл. 2).
Наибольшее количество элементарного кальция содержит карбонат кальция, что, несомненно, значимо для обеспечения необходимой суточной потребности в кальции. Вместе с тем применение цитрата кальция имеет свои клинические преимущества [11]. Как уже отмечалось, растворение солей кальция лучше происходит в кислой среде желудка. Наличие цитрата кальция позволяет обеспечивать хорошую всасываемость кальция даже у лиц с пониженной кислотностью [19]. Считается, что почти половина людей старше пятидесяти лет имеют сниженную или вовсе недостаточную кислотность. Кроме этого цитрат кальция отличает низкая способность к почечному камнеобразованию, что важно для длительного безопасного применения солей кальция. Это обусловлено тем, что цитрат кальция уменьшает количество оксалатов в моче [23]. Следовательно, оптимальной лекарственной формой является сочетание карбоната и цитрата кальция.
Для минимизации побочных эффектов и улучшения абсорбции препараты кальция следует принимать во время или после еды. Существует отрицательный дозозависимый эффект фармакотерапевтической активности кальция: эффективность всасывания солей кальция уменьшается при увеличении разовой дозы элементарного кальция более 600 мг, что является одним из компонентов физиологического защитного механизма организма от гиперкальциемии [1, 23]. Таким образом, если суточная доза элементарного кальция составляет более 600 мг, необходимо разделять ее на несколько приемов.
С целью профилактики и лечения ОП патогенетически обосновано назначение солей кальция и препаратов витамина D, причем их эффективность значительно увеличивается при совместном применении, что, несомненно, улучшает приверженность пациента длительному лечению. Препараты кальция и витамина D должны быть обязательным компонентом любой схемы лечения ОП, что повышает результаты антиостеопоретической терапии. В частности, назначение солей кальция и витамина D необходимо при терапии такими антирезорбтивными препаратами, как бисфосфонаты, рекомбинантный человеческий ПТГ [2, 17, 20].
Одним из эффективных комбинированных препаратов, содержащих кальций и витамин D, является Кальцемин Адванс – лекарственная форма, в 1 таблетке которой содержится оптимальная доза кальция в виде карбоната и цитрата (500 мг) и 200 МЕ холекальциферола. Кроме солей кальция и холекальциферола, в состав препарата входят марганец, медь, цинк и другие важные минералы, что также способствует формированию коллагена, отвечающего за эластичность и упругость костной ткани и ее полноценное восстановление, что обеспечивает эффективность препарата при его профилактическом или лечебном применении.
Для профилактики ОП Кальцемин Адванс назначают по 1 таблетке 1 раз в сутки, для комплексной терапии ОП – по 1 таблетке 2 раза в сутки во время еды, что соответствует оптимальной рекомендованной суточной потребности в кальции и витамине D [4, 6, 14]. При этом важно обращать внимание на постоянный прием полной рекомендуемой дозы. В практическом плане важно, что соли кальция и витамин D применяются для профилактики не только постменопаузального и сенильного, но и некоторых форм вторичного ОП [22]. Важно, что Кальцемин Адванс разрешен к применению в периоды беременности и лактации.
В заключение следует подчеркнуть, что компенсация хронического дефицита кальция и витамина D, широко распространенного патологического состояния, представляет важное профилактическое направление современной медицины. Активное применение комбинированных препаратов, содержащих соли кальция и витамина D, с целью профилактики и в комплексной терапии ОП совместно с основными антиостеопоротическими средствами позволяет на практике максимально оптимизировать лечебный процесс, повысить приверженность лечению и качество жизни пациентов.



