Введение
Диссеминированная аденокарцинома желудка и пищеводно-желудочного перехода, именуемая в последующем диссеминированным раком желудка (РЖ) – гетерогенное заболевание, результаты лечения которого остаются неудовлетворительными. Основным методом лечения является лекарственная терапия. Современные режимы химиотерапии (ХТ) позволяют не только увеличивать продолжительность жизни больных, но и на протяжении длительного времени обеспечивать пациентам хорошее качество жизни. Тем не менее медиана общей выживаемости (ОВ) больных не превышает 12 месяцев.
На протяжении многих лет предпринимаются попытки создания прогностической модели для больных диссеминированным РЖ. Одной из первых была клинико-морфологическая классификация Lauren, выделившая 2 подтипа опухоли – диффузный и кишечный, отличающихся различной этиологией, патогенезом и клиническим течением [1].
В 2004 г. I. Chau и соавт. при многофакторном анализе данных 1080 пациентов диссеминированным РЖ, участвовавших в трех рандомизированных исследованиях, в качестве независимых прогностических факторов выделили общее состояние больного, наличие метастазов в печень, по брюшине; уровень щелочной фосфатазы ≥100 ЕД/л; уровень гемоглобина ≤11 г/дл; удаление первичной опухоли в анамнезе; уровень лейкоцитов крови [2].
В настоящее время продолжается активное изучение прогностической и предиктивной значимости отдельных клинических факторов, таких как индекс массы тела, состояние иммунной системы [3], опухолевые маркеры [4], создаются различные молекулярно-генетические классификации [5, 6].
Нарастающее число зарубежных исследований свидетельствует о том, что при различных злокачественных опухолях (рак молочной железы, яичников, предстательной железы, колоректальный рак, немелкоклеточный рак легкого) одним из независимых неблагоприятных факторов прогноза продолжительности жизни больных является выявление диссеминированных опухолевых клеток (ДОК) в костном мозге (КМ) или циркулирующих в крови (ЦОК). Показано, что наличие ДОК в КМ пациентов, операбельных РЖ, коррелирует с сокращением безрецидивной и общей выживаемости, свидетельствуя о диссеминации процесса даже на ранних стадиях развития опухоли [7].
Дальнейшим развитием этого направления является изучение прогностического и предиктивного значения динамики ДОК и ЦОК на фоне противоопухолевого лечения.
Материал и методы
С ноября 2013 по апрель 2016 г. в отделении химиотерапии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России проведено исследование по выявлению ДОК в КМ больных диссеминированным РЖ до начала и по окончании ХТ 1-й линии.
Задачей исследования являлся анализ выживаемости без прогрессирования болезни (ВБП) и ОВ больных в зависимости от динамики ДОК в КМ пациентов на фоне ХТ.
В качестве ХТ 1-й линии всем больным был назначен режим mFOLFIRINOX: иринотекан 180 мг/м² в день 1+оксалиплатин 85 мг/м² в день 1+лейковорин 200 мг/м² в день 1+5-фторурацил 250 мг/м² внутривенно струйно в день 1 с последующей 48-часовой инфузией в дозе 2200 мг/м² с цикличностью каждые 2 недели.
ВБП определялась как временной интервал с момента начала ХТ 1-й линии до регистрации прогрессирования процесса или смерти от любой причины, если таковая наступит раньше.
ОВ определялась как временной интервал с момента начала ХТ 1-й линии до регистрации смерти пациента от любой причины.
Определение микрометастазов в КМ проводилось методом проточной цитометрии с окрашиванием антителами CD45 и EpCam или CD45 и цитокератинами, описанным ранее [8]. К ДОК-позитивным случаям (ДОК+) относили таковые с наличием не менее 1 опухолевой клетки на 10 млн миелокариоцитов.
Иммунофенотипическая диагностика осуществлена на материале, полученном при пункции костного мозга (1,0 мл).
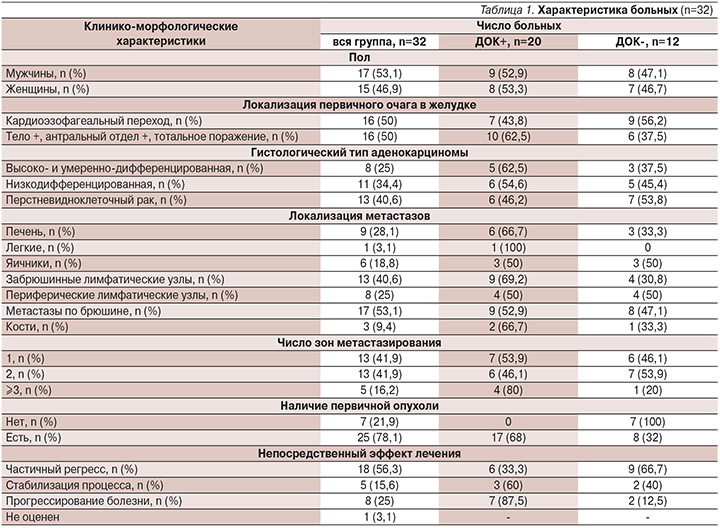
Анализ аспиратов костного мозга на наличие ДОК в КМ до начала и после окончания 1-й линии ХТ был выполнен 32 больным, характеристика которых представлена в табл. 1.
Результаты исследования
В аспиратах КМ, взятых до начала ХТ у 32 больных, ДОК были обнаружены (ДОК+) у 20 пациентов и отсутствовали (ДОК-) в 12 случаях.
При исходном (ДОК-)-статусе у 12 больных в аспиратах КМ, взятых после завершения ХТ, в 8 случаях ДОК по-прежнему не определялись (группа 1), но у 4 пациентов они были обнаружены (группа 2).
Из числа 20 исходных (ДОК+) случаев у 13 больных ДОК в КМ продолжали определяться после завершения ХТ (группа 3), а у 7 пациентов они не были выявлены (группа 4).
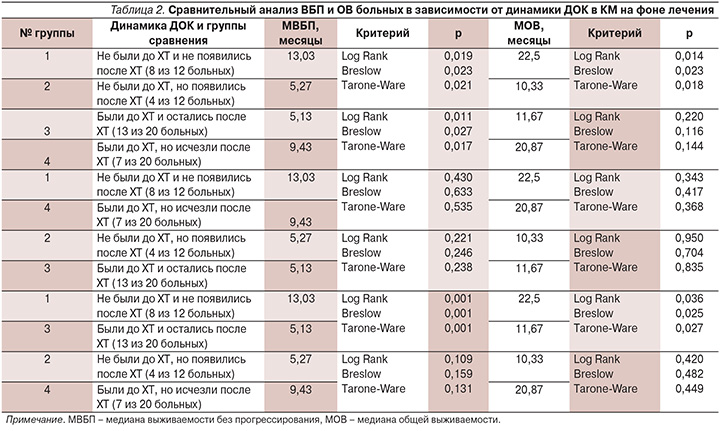
Сравнительный анализ медиан ВБП и ОВ больных в зависимости от динамики ДОК в КМ до и после ХТ представлен в табл. 2.
Обсуждение полученных результатов
Полученные данные свидетельствуют о высокой частоте вовлечения КМ в процесс диссеминации у первичных больных распространенным РЖ: 20 из 32 (62,5%). Оседание ДОК в преметастатических нишах КМ может происходить на любом этапе развития опухолевого процесса, в т.ч. и на фоне ХТ, о чем свидетельствует факт появления ДОК в КМ пациентов после ее завершения ( у 4 из 12 исходно ДОК-).
Появление ДОК в КМ сопровождается достоверным ухудшением как ВБП, так и ОВ больных (табл. 2, сравнение групп 1 и 2). Элиминация ДОК из КМ пациентов на фоне ХТ достоверно улучшает ВБП (табл. 2, сравнение групп 3 и 4). Несмотря на численную разницу в медианах ОВ больных с наличием ДОК в КМ после ХТ (11,67 месяца) и эрадикацией ДОК из КМ на фоне ХТ (20,87 месяца) статистической достоверности не получено. Возможно, это связано с малочисленностью анализируемых групп. Аналогичная ситуация складывается и в отношении сравнительного анализа выживаемости больных групп 2 и 4. Малочисленность групп не позволила выявить достоверных различий, несмотря на то что медианы ВБП и ОВ 7 больных с исчезновением ДОК в КМ после ХТ численно были явно выше, чем у 4 больных с появлением ДОК в КМ после ХТ: 9,43 и 5,27 и 20,87 и 10,33 месяца соответственно. Этот факт косвенно подтверждается отсутствием статистически значимых различий в выживаемости пациентов с отсутствием ДОК в КМ на протяжении всего периода исследования и исчезновением ДОК в КМ после проведения ХТ (табл. 2, группы 1 и 4).
Появление ДОК в КМ на фоне лечения крайне неблагоприятно, о чем свидетельствуют одинаковые значения медиан выживаемости пациентов групп 2 и 3 (табл. 2).
Отсутствие ДОК по сравнению с их наличием в КМ больных на протяжении ХТ сопряжено с достоверным улучшением показателей выживаемости (табл. 2, группы 1 и 3).
Результаты нашего исследования показывают, что динамика ДОК в КМ больных диссеминированным РЖ на фоне лечения имеет прогностическое значение: их персистенция или появление в процессе лечения свидетельствует о неблагоприятном прогнозе, а их отсутствие или исчезновение – признак благоприятного прогноза.
Перспективно дальнейшее изучение ДОК в КМ и их динамики на фоне лечения больных распространенным и локализованным РЖ как прогностического и предиктивного маркера.



