Введение
Последние десятилетия XX столетия ознаменовались прорывом в лечении многих заболеваний центральной нервной системы: появились технологии, позволяющие эффективно контролировать патологические состояния, расцененные ранее как фатальные. Одним из ярких достижений клинической неврологии стало внедрение в рутинную практику тромболитической терапии (ТЛТ) при лечении ишемического инсульта.
Первое описание тромболизиса при ишемическом инсульте (ИИ) было опубликовано в 1958 г. [1].
В 1963-м были представлены результаты небольшого клинического исследования использования тромболизиса при острой окклюзии в каротидном бассейне, верифицированные по данным ангиографии [2]. После внедрения в клиническую практику компьютерной томографии головного мозга в 1980 г. было проведено несколько клинических исследований по применению различных фибринолитиков для лечения ИИ: стрептолизина, плазмина, фибринолизина и тканевого активатора плазминогена (ТАП). По результатам этих исследований были получены негативные результаты использования фибринолизина, плазмина, стрептокиназы [3, 4]. Результаты пилотных исследований ТАП оказались противоречивыми [5]. Были получены данные о снижении эффективности ТАП при увеличении времени от момента появления первых симптомов инсульта до начала введения фибринолитика [6, 7].
Впервые клиническая эффективность ТАП была продемонстрирована в двух исследованиях, проведенных в Европе и США, результаты которых были опубликованы в 1995 г. Первым крупным исследованием по изучению эффективности применения ТАП, внушившим оптимизм, стало международное двойное слепое плацебо-контролируемое исследование The European Cooperative Acute Stroke Study (ECASS) [8]. Исследование показало снижение суммарной частоты смертельных исходов и инвалидизации при лечении ТАП по сравнению с плацебо по достижении 3-месячного периода наблюдения за пациентами соответственно у 59,1 и 70,8 % больных. Однако такой показатель, как 30-дневная летальность, в группе ТАП и группе плацебо был сопоставим, а частота геморрагической трансформации инфаркта мозга оказалась в 3 раза выше в группе больных, получавших ТАП, по сравнению с контрольной группой. Почти одновременно с ECASS были опубликованы результаты североамериканского рандомизированного двойного слепого плацебо-контролируемого исследования по изучению эффективности применения ТАП при его внутривенном введении The National Institute of Neurological Disorders and Stroke Recombinant Tissue Plasminogen Activator Stroke Study (NINDS) [9].
В данном исследовании ТАП или плацебо назначали больным в течение первых 3 часов от появления неврологической симптоматики. В группе пациентов, получавших ТАП, функциональное восстановление было лучше на 30 % и были зафиксированы значимо лучшие исходы через 6 и 12 месяцев. Частота геморрагических осложнений (внутримозговых кровоизлияний) в группе ТАП была достоверно выше (6,4 и 0,6 % соответственно), но уровень летальности в группах ТАП и плацебо достоверно не различался (21 и 17 % соответственно).
На основании результатов исследования NINDS в 1995 г. в США ТАП был разрешен к рутинному применению при лечении ИИ. Протокол этого исследования стал основой применения тромболизиса при ИИ: критерии отбора, трехчасовое терапевтическое окно, доза ТАП 0,9 мг/кг. Позднее данная методика была разрешена к применению в Канаде, затем в странах Евросоюза. В Российской Федерации ТЛТ при ИИ начала применяться с 2005 г. [10].
В настоящее время единственным препаратом, разрешенным для внутривенной ТЛТ ИИ, является рекомбинантный ТАП (альтеплаза, Актилизе для РФ). Это гликопротеин, состоящий из 527 аминокислот. После введения препарат находится в неактивной форме и активируется только после связывания с фибрином. Метаболизируется главным образом в печени. Период полувыведения составляет 5 минут.
В 2008 г. были опубликованы результаты исследования The third European Cooperative Acute Stroke Study (ECASS 3) показавшего, что внутривенный тромболизис в пределах 3,0–4,5 часов от появления симптомов инсульта эффективен и безопасен [11].
Эти данные нашли отражение в Рекомендациях Европейской инсультной организации [12, 13] и в Российских клинических рекомендациях по проведению тромболитической терапии при ишемическом инсульте 2012 г. [14].
С целью совершенствования оказания помощи больным с ишемическим инсультом в Республике Татарстан в 2006 г. было принято решение о внедрении метода тромболитической терапии. Впервые метод был применен в мае 2006 г. в неврологическом отделении Межрегионального клинико-диагностического центра (МКДЦ) Казани [15].
Материал и методы
Данный анализ проведен на материалах, полученных по результатам работы сосудистых центров Республики Татарстан. В настоящее время в регионе функционирует 13 первичных и 2 региональных центра, один из которых является головным сосудистым центром. К 2013 г. в данных центрах всего были пролечены более 22 тыс. пациентов с ИИ и проведено 918 внутривенных тромболизисов.
При поступлении пациента в специализированное приемное отделение, приближенное к блоку лучевой диагностики, проводился клинический осмотр с оценкой неврологического статуса по шкале инсульта Национального института здоровья США (NIHSS), забор крови для стандартных лабораторных исследований. При выявлении клинических признаков мозгового инсульта проводились рентгеновская компьютерная томография головного мозга, магнитно-резонансная томография (МРТ) в режимах спин-эхо, инверсия-восстановление (FLAIR), диффузионно-взвешенный режим (DWI), Angio – 3D TOF, CBF (МРТ 1 Т, GE, США). Патогенетический вариант инсульта определен согласно критериям TOAST (Trial Of Org 10172 in Acute Stroke Treatment).
По результатам анамнеза, данных клинической картины, лабораторных и инструментальных методов исследования принималось решение о проведении тромболитической терапии. В основе выбора тромболизиса лежали оптимизированные на базе НИИ инсульта РГМУ критерии Европейской инициативы по инсульту и Американской инсультной ассоциации.
Доза препарата альтеплазы (Актилизе) определяется из расчета 0,9 мг/кг массы тела пациента, но не более 90 мг, 10 % препарата вводят внутривенно болюсно в течение 1–2 минут, остальная доза – внутривенно капельно в течение 60 минут.
Результаты и обсуждение
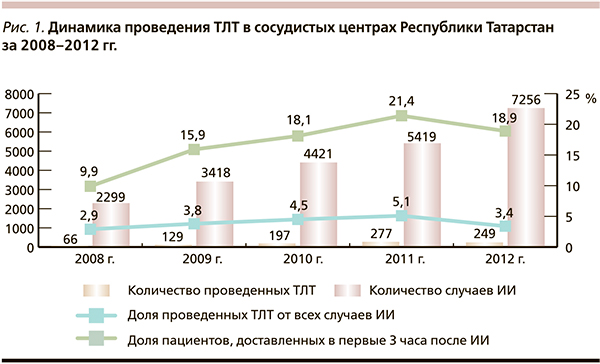
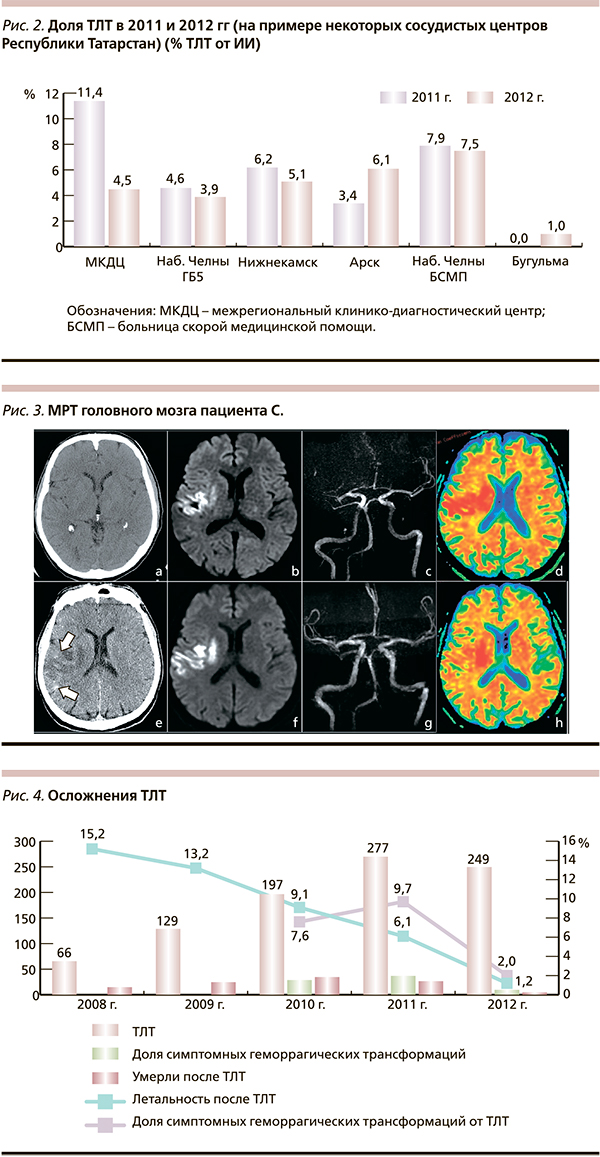
При оценке работы всей системы сосудистых центров региона за пятилетний период обращает на себя внимание увеличение доли ТЛТ с 2,9 в 2008 г. до 5,1 % в 2011-м с последующим некоторым снижением этого показателя в 2012 г. до 3,4 % (рис. 1). Анализ данного факта может отражать следующие тенденции, понимание которых позволит влиять на организационную стратегию. Так, с одной стороны, на фоне увеличения общего числа пациентов с ИИ, пролеченных в сосудистых центрах, от 5419 в 2011 г. до 7256 в 2012-м, доля пациентов, доставленных в первые 3 часа от начала заболевания, снизилась с 21,4 до 18,9 %. С другой стороны, в 2012 г. во вновь открытых сосудистых центрах ТЛТ была проведена только единичным пациентам (рис. 2), что связано с психологическим феноменом при принятии решения о проведении ТЛТ в сосудистых центрах, начинающих работать по современным стандартам.
Наиболее частыми неблагоприятными реакциями при введении ТАП являются геморрагические осложнения. Риск ТЛТ всегда ассоциируется с развитием кровоизлияний. При введении алтеплазы может произойти кровотечение в любом органе или части тела. Выделяют следующие виды кровотечений, связанных с применением тромболитической терапии: поверхностные кровоизлияния (подкожные, внутримышечные – в местах инъекций, ушибов, кровотечения со слизистой ротовой полости) и внутренние (в желудочно-кишечном, урогенитальном трактах, бронхо-легочные и забрюшинные кровотечения, кровоизлияния в центральной нервной системе, кровотечения из паренхиматозных органов).
Наиболее частым осложнением тромболитической терапии при лечении ИИ считаются внутримозговые кровоизлияния, в первую очередь геморрагические трансформации ишемического очага. Необходимо учитывать, что с введением фибринолитика можно связать только те осложнения, которые развились в течение 24–36 часов после введения алтеплазы [16]. Геморрагическая трансформация в зоне инфаркта – естественное явление в процессе развития церебрального инфаркта: трансформация белого инфаркта в красный. Архитектоника сосудов головного мозга, строение гематоэнцефалического барьера обусловливает исключительную предрасположенность головного мозга к геморрагической трансформации. Большая часть геморрагических трансформаций протекает асимптомно (рис. 3).
В соответствии с критериями регистра инсульта SITS-MOST симптомными считаются трансформации, приводящие к усугублению неврологического дефицита на 4 балла и более по шкале инсульта NIHSS или к смерти больного; остальные трансформации расцениваются как бессимптомные [17].
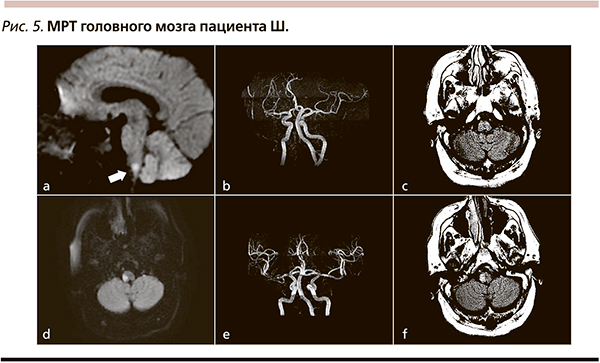
При анализе деятельности сосудистых центров Республики Татарстан обращает на себя внимание снижение количества геморрагических осложнений при проведении ТЛТ. Отмечается обратно пропорциональная зависимость летальности после ТЛТ и количества проведенных тромболизисов (рис. 4), что, вероятно, связано с накоплением опыта и проведением строгого контроля приверженности к критериям отбора пациентов на ТЛТ со стороны руководящего и мониторирующего все сосудистые центры Республиканского головного сосудистого центра. В 2012 г. летальность больных, получивших ТЛТ, составила 2 %, а число симптомных геморрагических трансформаций не превышало 1,2 %. В то же время у 67 % пациентов с ИИ после внутривенной ТЛТ наблюдалось «драматическое улучшение» (уменьшение выраженности неврологического дефицита по шкале NIHSS на 4 и более баллов через сутки).
Клинические примеры
Клинический случай 1
Пациент Ш. 68 лет, длительно страдавший артериальной гипертензией, был доставлен через 90 минут после развития слабости в правых конечностях и нарушения глотания. При поступлении выявлены правосторонний гемипарез, выраженная бульбарная и мозжечковая симптоматики (NIHSS 6 баллов). По данным МРТ головного мозга (рис. 5), очаг ишемии в продолговатом мозге выявлялся только в режиме DWI (a), в режиме FLAIR очаг ишемии (b) не визуализировался, кроме этого выявлялась окклюзия правой позвоночной артерии (b). Через 140 минут от момента появления первых симптомов заболевания пациенту была начата тромболитическая терапия. На фоне тромболизиса состояние улучшилось – парез и бульбарные нарушения регрессировали полностью. По шкале NIHSS через 24 часа от начала заболевания неврологический дефицит оценивался на 3 балла. По данным МРТ головного мозга, проведенной через сутки, очаг ишемии в продолговатом мосту визуализировался в режимах DWI (d) и FLAIR (f),сохранялась окклюзия правой позвоночной артерии (e). На фоне дальнейшего лечения пациент вернулся к полному самообслуживанию, к 30-му дню от начала заболевания степень функциональных ограничений по модифицированной шкале Рэнкина составила 1 балл.
Клинический случай 2
Пациент С. 67 лет в анамнезе острый инфаркт миокарда, страдающий генерализированным атеросклерозом (атеросклероз артерий нижних конечностей, атеросклероз коронарных артерий), был доставлен через 150 минут после развития слабости в левых конечностях (рис. 3). При поступлении выявлены анозогнозия, плегия в левых конечностях, чувствительные нарушения; неврологический дефицит по шкале NIHSS составил 15 баллов. По данным МРТ головного мозга в режиме DWI и на картах ADC, выявлены очаг ишемии в правой гемисфере (b, d), признаки окклюзии правой средней мозговой артерии по данным магнитно-резонансной ангиографии (c); по данным рентгеновской компьютерной томографии головного мозга очаговых изменений не было (a). Пациенту был проведен внутривенный тромболизис через 190 минут после появления первых симптомов заболевания. Через 24 часа был зафиксирован регресс симптоматики с уменьшением выраженности двигательных нарушений (NIHSS 8 баллов). По данным нейровизуализационных исследований, через 24 часа были зафиксированы по данным магнитно-резонансной ангиографии реканализация правой средней мозговой артерии (g), уменьшение очага по картам ADC (h), а также асимптомная геморрагическая трансформация с формированием петехий по границе зоны ишемии (е). На фоне дальнейшего лечения пациент вернулся к самообслуживанию, к 30-му дню от начала заболевания значение по модифицированной шкале Рэнкина составило 2 балла.
Заключение
Тромболитическая терапия с применением препарата Актилизе эффективна в лечении ИИ. Полученный опыт в течение нескольких лет показывает, что хороший результат от лечения с применением современных методов можно получить только при хорошей организации работы с минимизацией дореперфузионного периода и четким соблюдением протокола ТЛТ. Создание сети сосудистых центров позволяет внедрить наиболее эффективное применение данного метода лечения ИИ.



