Инфекции нижних дыхательных путей (НДП) включают ларингит и трахеит (согласно Международной классификации болезней 10-го пересмотра, кодируются как J04), бронхит (J20–21), пневмонию (J13–18). Важно различать внебольничные и госпитальные инфекции, т.к. этим определяется спектр патогенных возбудителей [1–4].
В соответствии с рекомендациями Всемирной организации здравоохранения в клиническом диагнозе при острых респираторных заболеваниях (ОРЗ) указывают локализацию инфекционного процесса, этиологию (если это возможно), ведущие клинические синдромы, характер и тяжесть течения [2].
Чаще всего (95 %) острые респираторные инфекционные заболевания имеют вирусную природу, реже (обычно как осложнение вирусных инфекций) – бактериальную. Однако в ряде случаев они могут быть обусловлены атипичной флорой (микоплазмами, хламидиями, легионеллами, пневмоцистами), редко – грибковой.
Среди вирусных возбудителей ОРЗ наиболее частые вирусы гриппа, парагриппа, аденовирусы, респираторно-синцитиальный, корона- и риновирус, ECHO (Enteric Cytopathic Human Orphan)- и Коксаки вирусы. Среди бактериальных возбудителей в настоящее время лидируют пневмококк (Streptococcus pneumoniae) и гемофильная палочка (Hemophilus influenzae) [3].
Все методы этиологической диагностики имеют ретроспективный характер. Поэтому при назначении терапии руководствуются клиническими показаниями и эпидемиологической ситуацией [4].
Для всех ОРЗ характерна сезонность, более высокая частота в экологически неблагополучных регионах, в регионах холодного, жесткого климата, а также для детей раннего возраста в период расширения контактов, с началом посещения детского коллектива.
Острый бронхит – острое воспаление слизистой оболочки бронхов, вызываемое различными инфекционными, физическими или химическими факторами. Это одно из наиболее частых заболеваний НДП, обычно проявляющее у детей вирусной инфекцией, реже – ее бактериальным осложнением.
Вариации клинической картины бронхита определяются причинным фактором, этиологией респираторной инфекции. Основные симптомы острого бронхита: кашель, обычно сухой, навязчивый в начале заболевания впоследствии переходящий во влажный, продуктивный; сухие и разнокалиберные влажные хрипы в легких. Рентгенологическая картина характеризуется неспецифичным изменением легочного рисунка. Инфильтративные и очаговые изменения в легочной ткани отсутствуют [3]. В классификации обычно выделяют острый (простой) бронхит, острый обструктивный бронхит и острый бронхиолит [1].
Острый бронхиолит (J21) рассматривают как форму острой респираторно-вирусной инфекции с преимущественным поражением нижних отделов респираторного тракта, что клинически нередко сопровождается выраженным бронхообструктивным синдромом (БОС) и дыхательной недостаточностью. Для острого бронхиолита характерна выраженная (до 60–80 в минуту) одышка с участием вспомогательной мускулатуры, втяжением уступчивых мест грудной клетки, раздуванием крыльев носа, цианозом, обилием влажных мелкопузырчатых и крепитирующих хрипов с обеих сторон (картина «влажного легкого»). Рентгенологически из-за резкого вздутия легочной ткани сосудистый рисунок может выглядеть обедненным.
Острый бронхиолит встречается преимущественно у детей первого полугодия жизни и часто обусловлен респираторно-синцитиальной или парагриппозной (III типа) инфекцией.
Прогноз бронхиолитов, как правило, благоприятный, за исключением редких случаев формирования стойких бронхолегочных изменений в виде облитерирующего бронхиолита (чаще при микоплазменной, легионеллезной или аденовирусной инфекциях). В случае повторных эпизодов БОС последние чаще протекают в виде обструктивного бронхита [2–4].
Острый обструктивный бронхит (J20), так же как и бронхиолит, является проявлением острой респираторной вирусной инфекции, но в отличие от него характеризуется диффузным поражением бронхов разного калибра. Типичный БОС, определяющий тяжесть состояния, обычно развивается на 3–4-й день ОРЗ и может сохраняться неделю и более, постепенно уменьшаясь. Рентгенологически при обструктивном бронхите определяются признаки вздутия легочной ткани (повышенная прозрачность, горизонтальное положение ребер, высокое стояние и уплощение куполов диафрагмы), усиление сосудистого рисунка.
Впоследствии на фоне ОРЗ у значительного числа (54 %) детей раннего возраста возможны повторные эпизоды обструктивного бронхита, которые при всем своем сходстве не сопровождаются развитием бронхиальной астмы (БА). Частота их убывает с возрастом. Рецидивы обструктивного бронхита, очевидно, обусловлены гиперреактивностью бронхов, всегда связаны с ОРЗ и обычно прекращаются к возрасту 3–4 лет [5].
Острый (простой) бронхит (J20) – наиболее частое проявление респираторной инфекции НДП. При остром простом бронхите в легких выслушиваются различного рода рассеянные сухие и разнокалиберные влажные хрипы, перкуторные изменения отсутствуют. Рентгенологически при остром простом бронхите отмечается усиление бронхососудистого рисунка, чаще – в прикорневых и нижнемедиальных зонах, расширение и неструктурность корней легкого.
В случаях повторных (2–3 раза и более в течение года) эпизодов бронхита (с обструкцией или без) речь может идти о рецидивирующем бронхите (J20). Строго говоря, термин «рецидивирующий бронхит» несостоятелен, поскольку рецидивирование обусловлено особенностями не бронхита, а пациента. Поэтому важно в каждом конкретном случае установить причину рецидивирования и истинный диагноз. Термин иногда используется при диспансерном наблюдении больных до выяснения причины рецидивирования воспаления бронхов.
В практическом отношении важны критерии дифференциальной диагностики бронхитов и бактериальной пневмонии. Диффузные изменения в легких, как и выраженная обструкция, более характерны для бронхита. В пользу пневмонии свидетельствуют стойкая фебрильная температура, асимметрия физикальных данных, выраженный токсикоз и воспалительные гематологические сдвиги. Всем пациентам с локальной симптоматикой показано рентгенологическое исследование. Наличие очаговых, инфильтративных теней в ткани легкого дает основание для постановки диагноза пневмонии [2–4, 6, 7].
Пневмония – острое инфекционное заболевание с поражением паренхимы легкого, диагностируемое по синдрому дыхательных расстройств и/или физикальным данным и сопровождающееся очаговыми/инфильтративными тенями на рентгенограмме [6, 7].
Пневмонии делятся по типу (в зависимости от распространенности процесса) на очаговые (в т.ч. очагово-сливные), сегментарные (моно- и полисегментарные), долевые (крупозные), по тяжести – на тяжелые, средней тяжести, по течению – на острые (разрешившиеся в сроки до 1,5–2,0 месяцев) и затяжные (разрешение в сроки более 1,5–2,0 месяцев), с гладким или осложненным течением (инфекционно-токсический шок, плеврит, легочная деструкция в виде абсцесса, булл, пневмоторакса, пиопневмоторакса). В силу клинических особенностей иногда выделяют интерстициальные пневмонии. При оценке тяжести пневмонии учитывается степень выраженности токсикоза, дыхательной и сердечно-сосудистой недостаточности, метаболических нарушений и функциональных расстройств со стороны различных органов и систем [3, 6, 7].
Для типичных инфекций, наиболее частыми возбудителями которых являются S. pneumoniae, H. influenzae, характерно острое начало с выраженной лихорадочной реакцией, интоксикацией, кашлем, соответствующими физикальными изменениями. Для атипичных инфекций характерны подострое малосимптомное начало с нормальной или субфебрильной температурой, отсутствие интоксикации, конъюнктивит (приблизительно в половине случаев), сухой навязчивый коклюшеподобный кашель, обилие крепитирующих хрипов в легких. Возбудителями атипичных внебольничных пневмоний чаще всего являются Mycoplasma pneumoniae, Chlamydia spp. Следует отметить, что этиологическая значимость внутриклеточных возбудителей (хламидий, микоплазм, легионелл) за последнее десятилетие возросла до 25–40 %, особенно для детей младенческого и подросткового возраста [7]. Усиливается роль смешанной этиологии [4].
Бактериальные пневмонии (как и бактериальные бронхиты) обычно развиваются на 3–5-й день от начала острого респираторно-вирусного заболевания на фоне еще не угасших катаральных явлений со стороны верхних дыхательных путей. У ребенка повышается температура тела до 38–39 °С, он возбужден или апатичен, нарушается сон, больной отказывается от еды, питья, у детей раннего возраста нередко отмечается срыгивание, рвота. Нарушения дыхания проявляются в виде раздувания крыльев носа, втяжения надключичных ямок и межреберных промежутков, одышки. У детей первых месяцев жизни могут появляться пена у рта, цианоз носогубного треугольника. В большинстве случаев отмечается влажный кашель, но он может быть и сухим, навязчивым, болезненным. Дети старшего возраста могут жаловаться на боли в грудной клетке, слабость, усталость, потливость по ночам. При тщательном обследовании отмечается укорочение перкуторного звука над легкими или тимпанит, выслушиваются мелкопузырчатые, иногда крепитирующие хрипы на стороне поражения. Выраженное укорочение перкуторного звука, переходящее в тупость, ослабление или отсутствие дыхания над пораженными участками легкого позволяют заподозрить полисегментарную пневмонию с плевральными осложнениями. Диагноз пневмонии следует всегда подозревать при лихорадке выше 38 °С в течение 3 суток и более, наличии одышки (более 50–60 в минуту – у детей до 1 года, более 40 в минуту – у детей старше 1 года), втяжении уступчивых мест грудной клетки при дыхании (в отсутствие крупа и БОС) [2, 4, 6, 7].
Пневмония, как правило, сопровождается выраженными реакциями со стороны крови (лейкоцитозом, сдвигом формулы влево, ускоренной СОЭ), однако диагноз пневмонии является клинико-рентгенологическим и потому требует рентгенологического подтверждения [6].
Лечение
Лечение ОРЗ желательно проводить в домашних условиях. Госпитализации подлежат лишь больные с тяжелыми и осложненными формами, а также дети первого полугодия жизни, из-за социально неблагополучных условий, при невозможности организации их лечения в домашних условиях, а также больных, лечение которых на дому в течение 2–3 дней не дает эффекта [6].
Принципы и характер лечебных мероприятий при ОРЗ определяются ведущими клиническими синдромами: наличием гипертермии, стеноза гортани, судорог, токсикоза, бронхиальной обструкции, дыхательной недостаточности [2–4].
В терапии острых респираторных заболеваний у детей используют:
- симптоматическое лечение, в т.ч. местное (снижение температуры тела, лечение ринита, облегчение боли в горле и т.д.);
- противовирусные и антибактериальные средства (по строгим показаниям);
- муколитики, отхаркивающие и противокашлевые средства;
- антигистаминные препараты (при наличии аллергических проявлений);
- противовоспалительные средства (особенно при крупе, БОС);
- немедикаментозные методы (по возможности);
- средства иммунокоррекции (при необходимости).
Противовирусная терапия острых респираторных вирусных инфекций (ОРВИ) может включать:
- химические средства – арбидол, римантадин, тилорон (для детей старше 7 лет);
- интерфероны и их индукторы – лейкоцитарный интерферон, рекомбинантный интерферон, меглюмина акридонацетат и криданимод.
Показано, что эффективность профилактического применения арбидола существенно возрастает при его сочетании с селен-активом, т.к. при этом одновременно осуществляется воздействие не только на иммунный, но и на метаболический статус организма. Неосложненные бактериальной инфекцией ларингиты, трахеиты, бронхиты не требуют антибактериальной терапии!
Для профилактики бактериальных осложнений возможно применение (по показаниям) только местных антибактериальных средств (фузафунгин детям старше 2,5 лет). Это местный антибактериальный препарат с противовоспалительным действием. Размер частиц фузафунгина составляет меньше 1 мкм, что позволяет им проникать в самые отдаленные участки респираторного тракта. Фузафунгин на треть снижает потребность в системных антибиотиках [2].
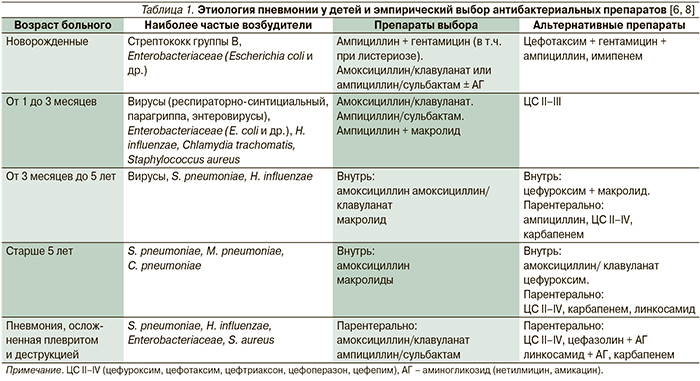
Антибактериальная терапия показана только при ОРВИ, осложненных бактериальной инфекцией [7–10]. Одновременное с антибактериальными средствами назначение с профилактической целью противогрибковых препаратов, как правило, нецелесообразно. При наличии показаний к назначению системного антибиотика выбор стартового препарата осуществляется эмпирически с учетом вероятной этиологии и лекарственной чувствительности предполагаемого возбудителя (табл. 1). При этом всегда предпочтительна монотерапия пероральным лекарственным препаратом. Правильность выбора антибиотика подтверждается быстрой положительной клинической динамикой. В отсутствие таковой в течение двух дней решают вопрос о смене антибиотика или используют комбинацию препаратов для расширения антибактериального спектра [2–4, 6]. В настоящее время в амбулаторной практике в качестве антибактериальных препаратов первого выбора наиболее широко при лечении острых инфекций НДП используют три группы антибиотиков, т.н. препараты «золотого» стандарта: β-лактамы (амоксициллины, в т.ч. ингибиторозащищенные, цефалоспорины II–III поколений) и макролиды [8–10].
Все препараты группы β-лактамов действуют бактерицидно. Механизм действия этих антибиотиков заключается в их способности проникать через клеточную оболочку бактерий и связываться с т.н. пенициллинсвязывающими белками. В результате нарушается синтез пептидогликана в микробной стенке, что приводит к нарушению строения клеточной стенки.
За последнее десятилетие во всем мире, но особенно в Западной Европе, наблюдается отчетливое увеличение инфекций, вызываемых патогенами, продуцирующими β-лактамазы – ферменты, способные разрушать β-лактамное кольцо в структуре пенициллинов и цефалоспоринов. Данный механизм защиты является основным для таких возбудителей, как S. aureus, Moraxella catarrhalis, H. influenzae, Klebsiella pneumoniae, E. coli, Bacillus fragilis. В настоящее время синтезированы соединения, инактивирующие β-лактамазы бактерий: клавулановая кислота (клавуланат), сульбактам и тазобактам. Применение комбинированных «защищенных» препаратов показано в случаях инфекций, вызываемых патогенами, продуцирующими β-лактамазы, а также при повторных курсах амоксициллина. Однако в России и СНГ это не так актуально, т.к. частота подобных штаммов невелика (не более 5–6 %). Наиболее часто используется сочетание амоксициллина и клавуланата. Для достижения эрадикации ведущих возбудителей амоксициллин/клавуланат (в пересчете на амоксициллин) детям с массой тела более 40 кг следует использовать в дозе 500 мг 3 раза в сутки или 875 мг 2 раза в сутки; детям с массой тела менее 40 кг – в дозе 40 мг/кг/сут, разделенной на 3 приема, или 45 мг/кг/сут, разделенной на 2 приема.
Большое удобство для педиатров представляют лекарственные формы аминопенициллинов для перорального приема в виде растворимых таблеток, что существенно улучшает приверженность лечению. Высвобождение действующего вещества в зоне максимального всасывания обеспечивает максимально возможную биодоступность при минимальном количестве побочных эффектов. При применении комбинации амоксициллина + клавулановой кислоты) диарейный синдром развивается в 2,5 раза реже, чем при других ингибиторозащищенных формах амоксициллина. Высокая эффективность и минимальное количество побочных эффектов не случайно обеспечивают лидерство этим препаратам, являющимся наиболее широко назначаемыми в педиатрической практике.
Цефалоспорины – наиболее многочисленное и разнообразное по химической структуре семейство β-лактамных антибиотиков, получившее широкое распространение в клинической практике благодаря высокой эффективности и низкой токсичности. Выделяют несколько поколений цефалоспоринов, что отражает не только хронологию появления препаратов, но и различия в антибактериальных свойствах. Кроме того, цефалоспорины принято подразделять на парентеральные и пероральные.
Цефалоспорины I поколения в настоящее время используются редко в связи с довольно узким спектром их антимикробной активности.
Цефалоспорины II поколения отличаются от цефалоспоринов I поколения повышенной активностью в отношении грамотрицательных бактерий (H. influenzae, M. catarrhalis) и бактерий кишечной группы (E. сoli, Klebsiella, Enterobacter, Providencia, индол-положительных Proteus). По активности в отношении грамположительных бактерий эти антибиотики несколько уступают цефалоспоринам I поколения. Цефаклор и цефуроксим аксетил являются самыми распространенными в мире цефалоспоринами для приема внутрь и в настоящее время считаются эталонными пероральными препаратами для лечения инфекций дыхательных путей.
Цефалоспорины III поколения по сравнению с цефалоспоринами I и II поколений хуже действуют на грамположительные кокки, однако имеют более высокую активность в отношении различных грамотрицательных микроорганизмов, включая многие полирезистентные нозокомиальные штаммы. Некоторые из цефалоспоринов III поколения (цефтазидим, цефоперазон) активны в отношении Pseudomonas aeruginosa, а цефотетан и латамоксеф имеют также выраженную антианаэробную активность. Пероральные цефалоспорины III поколения (цефиксим, цефтибутен) используются в терапии внебольничных пневмоний средней тяжести. Для лечения тяжелых форм внебольничной пневмонии используются парентеральные цефалоспорины III поколения (цефотаксим, цефтриаксон, цефтазидим, цефоперазон). Антибиотики цефалоспоринового ряда для парентерального введения назначают в дозе 50–80–100 мг/кг/сут, разделенной на 2–3 введения.
Цефалоспорины III поколения отличаются от цефалоспоринов I и II поколений не только по спектру своего действия, но и по фармакокинетическим показателям. У многих из этих препаратов отмечены длительный период полувыведения, высокие устойчивые уровни концентраций в сыворотке крови, что позволяет сокращать частоту их введения. Так, цефтриаксон имеет самый длительный период полувыведения, поэтому вводится 1 раз в сутки, что, несомненно, повышает его значение в педиатрической практике. Кроме того, при парентеральном введении цефтриаксон прекрасно проникает в легочную ткань и плевральную жидкость, где бактерицидные концентрации в отношении чувствительных респираторных патогенов сохраняются в течение 1–2 суток [8–10].
В целом цефалоспорины являются разумной альтернативой аминопенициллинам, однако с учетом все же гораздо большего риска серьезных побочных эффектов (особенно со стороны крови) они остаются препаратами второго выбора.
В целом эмпирическая антибиотикотерапия внебольничных инфекций НДП у детей в большинстве случаев может быть успешной при использовании β-лактамных антибиотиков. Неэффективность стартовой терапии β-лактамами может свидетельствовать как о резистентности микрофлоры, так и об атипичной этиологии пневмонии. В этом случае показано назначение макролидов. Макролиды также используются в качестве альтернативных при неэффективности или непереносимости β-лактамных антибиотиков.
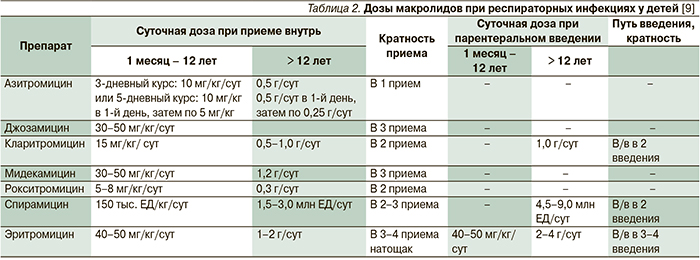
Высокая эффективность использования макролидных антибиотиков в терапии внебольничных пневмоний связана со спектром их антимикробной активности, включающим большинство респираторных патогенов, в т.ч. атипичных возбудителей, а также со способностью создавать в очагах воспаления высокие концентрации, превышающие таковые в сыворотке крови. Кроме того, макролиды не разрушаются β-лактамазами. Практически ценно то, что макролиды относятся к препаратам с минимальным количеством побочных эффектов. Низкая токсичность макролидов позволяет использовать их в педиатрии для лечения детей всех возрастных групп, тем более что они высокоэффективны при пероральном применении. Новые макролиды в отличие от эритромицина обладают удовлетворительными вкусовыми качествами, особенно детские формы (суспензии и саше), реже вызывают побочные эффекты, имеют лучшие фармакокинетические параметры, что позволяет принимать их 1–2 раза в сутки коротким курсом (табл. 2).
Спектр антимикробной активности макролидов включает грамположительные кокки (Streptococcus spp., Staphylococcus spp., включая пенициллинрезистентные штаммы), грамположительные палочки (Сorynebacterium diphtheriae, Listeria monocytogenes), грамотрицательные кокки (Мoraxella catarrhalis), грамотрицательные палочки (Вordetella pertussis, Legionella spp.). Хламидии, микоплазмы, уреаплазмы и спирохеты высокочувствительны к макролидам. Следует подчеркнуть, что ни один из новых макролидов практически не действует на штаммы золотистого стафилококка, устойчивые к эритромицину. Метициллинрезистентные штаммы S. aureus устойчивы ко всем макролидам.
Несмотря на сходство, все макролиды обладают некоторыми особенностями. Так, кларитромицин по сравнению с другими макролидами проявляет наилучший эффект в отношении стрептококков, золотистого стафилококка, легионелл, хламидий. Азитромицин – единственный макролид, имеющий клинически значимую активность к Н. influenzae (включая ампициллинрезистентные штаммы). Азитромицин также превосходит другие макролиды по действию на М. catarrhalis, Neisseria spp. Спирамицин активен в отншении ряда пневмококков и β-гемолитических стрептококков группы А, резистентных к 14- и 15-членным макролидам.
Макролидные антибиотики принимают внутрь за час до или через 2–3 часа после еды, т.к. основное их всасывание происходит в тонком кишечнике. Это существенно повышает их биодоступность (от 30 до 65 %) [10].
Поскольку макролидные антибиотики являются липофильными соединениями, они хорошо распределяются в организме, проникая во многие органы и ткани. По способности проникать через гистогематические барьеры макролиды превосходят β-лактамы. Несомненным достоинством макролидов остается их способность создавать высокие и стабильные концентрации в тканях, превышающие уровень препаратов в сыворотке крови (в 10–100 раз), что обусловливает наибольшую эффективность этих препаратов в отношении внутриклеточных возбудителей. В частности, макролиды интенсивно накапливаются в миндалинах, легких, бронхиальном секрете, плевральной жидкости. В отличие от многих других антибиотиков макролиды хорошо проникают и создают высокие концентрации в различных клетках – гранулоцитах, моноцитах, альвеолярных макрофагах, фибробластах, что имеет существенное значение при лечении пневмоний, вызванных внутриклеточными патогенными микроорганизмами. Кларитромицин, джозамицин, азитромицин проникают в фагоцитирующие клетки и транспортируются в очаг воспаления. Для всех макролидов характерно наличие постантибиотического эффекта, выражающегося в продолжении подавления роста бактерий при прекращении приема антибиотика, что имеет большое клиническое значение. Наиболее продолжительный постантибиотический эффект отмечен у азитромицина.
Гиперчувствительность к макролидным антибиотикам отмечается редко. Эти препараты не обладают перекрестными аллергическими реакциями с β-лактамами, что позволяет использовать их пациентам с аллергией на пенициллины и цефалоспорины.
Антимикробный спектр макролидов обусловливает их широкое применение при инфекциях НДП. Они эффективны для 80–90 % больных бронхитами и внебольничными пневмониями.
Длительность антибактериального лечения, как правило, составляет от 5 до 10–14 дней. Если в течение 2 суток улучшения нет или оно незначительно, следует сменить антибиотик или добавить второй для расширения антимикробного спектра.
Фторхинолоны применяют только к детям старше 12 лет и по витальным показаниям. Хотя в последние годы и появились доказательства безопасности их применения детьми в более раннем возрасте, до настоящего времени эти препараты для широкого применения в педиатрической практике не разрешены и используются лишь в особых случаях.
Ко-тримоксазол эффективен только при пневмоцистной инфекции.
Лихорадка выше 38–38,5 °С требует назначения жаропонижающих лекарственных средств (препарат первого выбора – парацетамол) при угрозе судорог, выраженном нарушении самочувствия ребенка.У детей в возрасте до 3 месяцев желательно не допускать повышения температуры выше 38 °С. При «бледной» лихорадке обязательна комбинация антипиретика с сосудорасширяющим и антигистаминным препаратами.
Для купирования судорог используют диазепам или оксибутират натрия. Фенобарбитал не применяют!
При крупе применяют ингаляционную (предпочтительнее небулайзерную) терапию, местные (суспензия будесонида в высоких дозах) и системные глюкокортикостероиды.
При БОС используют ингаляции бронхолитиков (сальбутамол) через небулайзер, в зависимости от тяжести состояния добавляют ингаляции суспензии будесонида и преднизолон парентерально.
Для борьбы с кашлем (если это необходимо) используют противокашлевые препараты центрального действия (наркотические – кодеинсодержащие и ненаркотические – бутамират), а также периферического действия. Применение противокашлевых препаратов детьми требует осторожности и зачастую не является необходимым.
Течение респираторных инфекций, как правило, сопровождается нарушением образования, изменением состава и вязкости бронхиальной слизи. Для улучшения реологических свойств секрета, активации механизмов эвакуации мокроты имеется много разнообразных муколитических и отхаркивающих средств [11].
Мукоактивные препараты прямого действия – тиолики – разжижают мокроту за счет деполимеризации макромолекул секрета вследствие разрыва дисульфидных связей. Оказывают отхаркивающее, секретомоторное, муколитическое, противокашлевое и антиоксидантное действия, стимулируют выработку сурфактанта. Широко известным препаратом этой группы является N-ацетилцистеин.
Секретолитики (мукоактивные препараты непрямого действия) – производные алкалоида вазицина. Снижают адгезию секрета, деполимеризуют мукопротеиновые и мукополисахаридовые волокна секрета. Оказывают секретолитический, секретомоторный и противокашлевой эффекты. К препаратам этой группы относятся бромгексин и амброксол.
Мукорегуляторы (мукоактивные препараты непрямого действия) являются производными карбоцистеина. Регулируют выработку секрета железистыми клетками. Нормализуют реологические параметры секрета, ускоряют мукоцилиарный транспорт, оказывают противовоспалительное действие.
К этой группе относятся препараты карбоцистеина.
Традиционные отхаркивающие средства рефлекторного действия активируют гастропульмональный мукокинетический рефлекс и тем самым усиливают перистальтику бронхиальной мускулатуры, работу мерцательного эпителия, секрецию бронхиальных желез. В эту группу входят различные отхаркивающие препараты растительного происхождения. Прием внутрь отхаркивающих средств рефлекторного действия необходимо сопровождать обильным питьем. При острых воспалительных процессах в дыхательных путях это наиболее эффективно. Традиционные отхаркивающие средства на основе глицеринового эфира гвиакола (гвайфенезин) повышают эффективность кашлевого рефлекса и одновременно улучшают колебания ресничек мерцательного эпителия, в связи с чем ускоряют мукоцилиарный транспорт и оказывают разжижающее действие.
Необходимо особо отметить получивший в последнее время распространение препарат, содержащий сухой экстракт листьев лекарственного плюща (hedera helix), известного с глубокой древности. Сапонин гедеракозид С и его производное α-гедерин, содержащиеся в плюще, не только обладают выраженными отхаркивающим и муколитическим (секретолитическим) действиями, но и при концентрации α-гедерина свыше 400 ммоль/мл проявляются его бронхолитический, а также спазмолитический терапевтические эффекты, т.к. α-гедерин повышает активность β2-адренорецепторов, увеличивает уровень цАМФ, тем самым расслабляя бронхи и увеличивая их просвет. Препарат хорошо переносится, применяется с первых дней жизни, выпускается как в сиропе, так и в каплях и саше, высокоэффективен в лечении кашля у детей с острым бронхитом и острым обструктивным бронхитом. Следует отметить, что в отличие от многих других фитопрепаратов Проспан является хорошо стандартизованным лекарственным средством.
Другие традиционные отхаркивающие средства (резорбтивного действия, мукогидратанты, бронхорроики) стимулируют бронхиальные железы и/или гидратируют секрет, разжижают мокроту.
Комбинированные препараты в последнее время довольно популярны и могут включать различные отхаркивающие, противокашлевые, спазмолитические и другие средства. Однако следует иметь в виду, что их назначение требует индивидуального подхода, а сочетания препаратов в них не всегда рациональны.
При использовании большинства отхаркивающих средств лечебный эффект обычно наступает не сразу, а на 2–4-й день лечения. Их эффективность вариабельна, определяется характером и тяжестью бронхолегочной патологии, индивидуальными особенностями больного ребенка.
Наличие бронхиальной обструкции всегда ухудшает эвакуацию мокроты. Поэтому при клинических и функциональных признаках нарушений бронхиальной проходимости необходимо сочетанное применение отхаркивающих средств с бронхолитиками, обязательное увлажнение дыхательных путей.
Использование атропиноподобных и антигистаминных (I поколения) средств при кашле у детей нецелесообразно, т.к. они обладают «подсушивающим» слизистую оболочку эффектом, сгущают мокроту и затрудняют ее эвакуацию. Комбинация отхаркивающих средств с седативными и противокашлевыми препаратами также часто нерациональна в отношении детей.
Для эффективной эвакуации мокроты в комплексе лечения детей с бронхолегочной патологией целесообразно использовать ингаляции, постуральный и вибрационный массаж (по состоянию больного). Для эффективного разжижения и эвакуации мокроты совершенно необходима адекватная гидратация.
Детям раннего возраста, а также при выраженном рвотном рефлексе и высоком риске аспирации противопоказаны отхаркивающие препараты, увеличивающие объем секрета, усиливающие рвотный и кашлевой рефлексы.
Выбор того или иного мукоактивного средства или их сочетаний должен определяться индивидуальными особенностями больного, характером заболевания, выраженностью кашля, экссудации, характером мокроты, опираться на знания механизмов действия и фармакокинетики лекарственных препаратов [11]. В последнее время все чаще в терапии ОРЗ с целью уменьшения выраженности воспалительной реакции и сокращения сроков болезни используют противовоспалительные средства. Некоторое распространение получил фенспирид, определенный эффект применения которого подтвержден отдельными фармакоэкономическими исследованиями.
Средства иммунокоррекции включают: иммуноглобулины для внутривенного введения (в тяжелых случаях, у иммунокомпрометированных больных); бактериальные лизаты; рибосомальные иммуномодуляторы. По мере улучшения состояния ребенка к лечению, как правило, подключают следующие методы немедикаментозной терапии: массаж, лечебная физкультура; физиотерапевтическое лечение (в настоящее время имеет ограниченное применение); тепловые и отвлекающие процедуры (с осторожностью, после стойкой нормализации температуры); витамины (желательно поливитамины) в комплексе с микроэлементами. В период реконвалесценции особенно часто болеющим детям рекомендуют назначать адаптогены природного происхождения [12].
Профилактика
Выздоровление от ОРВИ всегда связано с активацией иммунных реакций и формированием иммунитета к возбудителю. Однако в силу большого разнообразия этиологических агентов защиты от ОРВИ в дальнейшем это не обеспечивает. Профилактическая вакцинация имеет ограниченное значение. До настоящего времени отношение к ней остается неоднозначным. Профилактика связана в основном с предотвращением контактов в эпидемический сезон, закаливанием, а также применением препаратов интерферона и других средств, повышающих неспецифическую резистентность организма, что в последнее время приобретает все большую популярность. При частых ОРЗ большое значение приобретает выяснение причины, лежащей в основе заболевания, и организация полноценной дифференцированной комплексной реабилитации таких детей [12].
Для профилактики инфекций, вызванных такими возбудителями, как S. pneumoniae, H. influenzae, в последнее время появились вакцины Пневмо 23 и Акт-ХИБ [2, 3, 6].



